芝麻素对代谢综合症大鼠心肌NT、NF-κB和MMP-9蛋白表达的影响
孔 祥,杨解人,张明义,吴向起
(皖南医学院药理学教研室,国家中医药管理局中药药理三级实验室,安徽芜湖 241002)
代谢综合症(metabolic syndrome,MS)是以胰岛素抵抗为病理生理基础,伴有中心性肥胖、高血脂、高血压、糖尿病或空腹血糖增高的症候群[1]。MS中的每个致病因素均能对心脏造成严重危害。随着MS发病率呈明显上升趋势,心血管并发症亦急剧增加。芝麻具有“补肝肾、润五脏、增气力、消炎止痛、生发”等功效,长久以来一直被视为滋补圣品。芝麻素(sesamin,Ses)是从芝麻中提取出的活性成份,药用价值日益受到重视。日本学者报道[2-3]Ses对于高血脂和高血压患者有一定的降脂和降压作用。我们之前研究报道[4-5]Ses通过抗氧化应激改善饮食诱导的MS大鼠心肌和肾脏损伤,通过降低c-fos蛋白表达逆转肾性高血压伴高血脂大鼠心肌肥厚[6],但Ses对两肾一夹术伴高脂高糖饮食诱导的MS大鼠心肌重构的影响尚未见文献报道。
硝基酪氨酸(NT)是内源性过氧亚硝酸盐阴离子(ONOO-)的特异性标记物。核因子-κB(NF-κB)作为重要的转录因子在心肌炎症反应、细胞坏死、凋亡等病理生理过程发挥重要作用。基质金属蛋白酶(MMPs)是特异性降解细胞外基质的锌依赖性蛋白酶家族,在心肌重构中起重要作用。因此,本实验采用两肾一夹术伴高糖高脂饮食诱导大鼠MS模型,观察Ses对大鼠心肌组织中NT、NF-κB和MMP-9蛋白表达的影响,以探讨其防治MS大鼠心肌重构的作用及可能机制。
1 材料
1.1 动物和饲料♂SD大鼠52只,体质量200~240 g,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2007-0001。解放军总医院实验动物中心啮齿类动物实验室分笼饲养,自由进食和饮水。饲料配方见作者之前报道[7],由军事医学科学院实验动物中心制作,许可证号:SCXK(军)2002-018。高糖高脂饲料含有18%蛋白质,22%脂肪(含15%熟猪油和2%胆固醇),46%碳水化合物(含25%蔗糖)。饲料的热量组成和密度如下,高糖高脂饲料:蛋白16%,脂肪44%,碳水化合物40%和4.5 Kcal·g-1;普通饲料:蛋白 28%,脂肪13%,碳水化合物 59%和 3.1 Kcal·g-1。
1.2 主要试剂和药物Ses(纯度>94%),由芜湖天一绿宝科技有限公司提供(批号04312)[7];甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)试剂盒购自深圳迈瑞生物医疗公司;胰岛素(insulin,Ins)放免试剂盒购自北京普尔伟业生物科技公司;总抗氧化能力(T-AOC)试剂盒购自南京建成生物工程研究所;NT和NF-κB p65抗体购自Santa Cruz公司;MMP-9和β-actin抗体购自武汉博士德公司;辣根过氧化物酶标记二抗购于北京中杉金桥生物技术有限公司;ECL试剂盒购于Pierce公司。
Tab 1 Effects of Ses on BW,SBP and lipid metabolism in MS rats( ± s)

Tab 1 Effects of Ses on BW,SBP and lipid metabolism in MS rats( ± s)
*P<0.05 vs sham;#P<0.05 vs model
Group Dose/mg·kg-1 n BW/g SBP/kPa TG/mmol·L -1 TC/mmol·L -1±0.48 Model - 10 630.5 ±27.1* 23.6 ±0.91* 2.06 ±0.49* 3.47 ±1.27*Ses 120 8 563.3 ±40.5# 18.6 ±1.21# 1.41 ±0.36*# 2.36 ±0.52*#60 8 587.9 ±35.0* 20.2 ±1.21*# 1.65 ±0.22*# 2.82 ±0.45*30 8 611.3 ±43.8* 21.6 ±0.87* 1.83 ±0.32* 3.20 ±0.62 Sham - 10 523.2 ±31.3 15.4 ±0.79 0.90 ±0.33 1.17*
2 方法
2.1 模型制备、分组及处理Goldblatt法复制大鼠肾性高血压模型,适应1周后除假手术组外,其余大鼠给予高糖高脂饲料12周。NIBP无创尾动脉血压测定分析系统检测大鼠收缩压(systolic blood pressure,SBP)[7,8],术后 5 周达 21.3 kPa 以上的 44 只大鼠随机分为 MS模型组(model,n=10),Ses高、中、低剂量治疗组(120、60、30 mg·kg-1,n=8),另设假手术组(sham,n=10)。Ses用0.5%羧甲基纤维素制成混悬液,假手术和模型组给予等容积羧甲基纤维素。于每日上午9时灌胃给药,1 h后自由进食,连续给药8周。于实验结束后(13周末),大鼠禁食 12 h,称体重(body weight,BW),麻醉后腹主动脉取血,分离血清。迅速开胸,取心脏,称全心湿重(heart wet weight,HWW)和左心室湿重(left ventricle wet weight,LVWW)。取部分心肌用10%甲醛固定,用于HE和Masson染色,部分冻存于-80℃冰箱备用。
2.2 血液指标检测酶法测定血清TC、TG含量,血糖仪测定大鼠空腹血糖(fasting blood glucose,FBG),放免法测血清Ins水平,比色法测血清T–AOC,具体步骤见试剂盒说明书,并严格按说明书正规操作。采用李氏法[9]计算胰岛素敏感指数(insulin sensitive index,ISI):ISI=Ln(1/FBG ×FIns)。
2.3 Western blot检测心肌 NT、NF-κB 和 MMP-9蛋白表达参照 Schreiber等[10]和作者之前的报道[7],分别提取心肌组织核蛋白和总蛋白,取上清用Lowry法进行蛋白定量。以40 μg蛋白/泳道上样,经SDS-PAGE凝胶电泳后,电转膜至PVDF膜,室温封闭2 h。洗膜后分别加入一抗(NT 1∶800;NF-κB p65 1 ∶1 000;MMP-9 和 β-actin 1 ∶500稀释)4℃孵育过夜。洗膜后二抗(1∶2 500稀释)室温孵育2 h。ECL化学发光法显色,拍摄照片。根据积分吸光度(integrated absorbance,IA)值对比分析条带强弱,以β-actin为内参照进行半定量分析。
2.4 心肌组织病理学检查石蜡横断面连续切片5~6片,厚度约5 μm,切片常规脱蜡脱水,HE染色观察心肌病理改变。Masson染色后,运用Image-Pro Plus 6.0 Software图像分析系统,将图像放大400倍,随机选取10个视野,通过测量选定区域染色组织的面积(蓝色代表胶原纤维),计算每个视野中胶原面积与心肌组织总面积的比值,取其均值即为每只大鼠胶原容积分数(collagen volume fraction,CVF)。含胶原丰富的冠脉细小血管区域不纳入测量范围内。
2.5 统计学分析数据结果以±s表示,采用SPSS 13.0软件分析,多组间比较采用单因素方差分析和q检验。
3 结果
3.1 对BW、SBP和血脂的影响MS模型组BW、SBP、TG和TC较假手术组增高(P<0.05)。与模型组相比,Ses 120、60 mg·kg-1组 SBP 和 TG 明显降低;120 mg·kg-1组 BW 和 TC明显降低(P<0.05),表明Ses具有降低血压和血脂的作用,与作者之前报道一致(Tab 1)。
3.2 对FBG、Ins水平和 ISI的影响MS模型组FBG和血清Ins水平增高,ISI明显降低(P<0.05)。与模型组相比,Ses 120、60 mg·kg-1组 FBG、Ins水平降低,ISI明显上升(P<0.05),说明Ses具有降低血糖和改善胰岛素敏感性的作用(Tab 2)。
Tab 2 Effects of Ses on FBG,INS level and ISI in MS rats(±s)
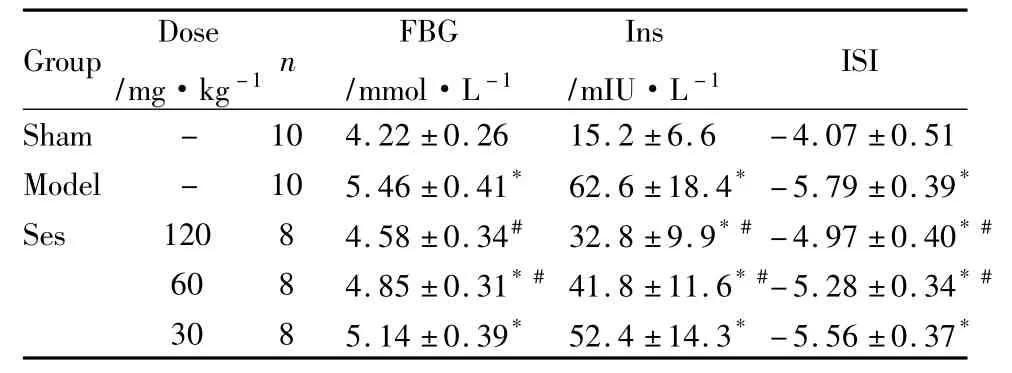
Tab 2 Effects of Ses on FBG,INS level and ISI in MS rats(±s)
*P<0.05 vs sham;#P<0.05 vs model
Group Dose/mg·kg-1n FBG/mmol·L -1 Ins/mIU·L-1ISI Sham - 10 4.22 ±0.26 15.2 ±6.6 -4.07 ±0.51 Model - 10 5.46 ±0.41* 62.6 ±18.4* -5.79 ±0.39*Ses 120 8 4.58 ±0.34# 32.8 ±9.9*# -4.97 ±0.40*#60 8 4.85 ±0.31*#41.8 ±11.6*#-5.28 ±0.34*#30 8 5.14 ±0.39* 52.4 ±14.3* -5.56 ±0.37*
3.3 对HWW、LVWW和T-AOC的影响MS模型组HWW和LVWW增高,血清T-AOC明显降低(P <0.05)。与模型组相比,Ses 120、60 mg·kg-1组HWW 降低,T-AOC明显上升;120 mg·kg-1组LVWW降低(P<0.05),表明Ses具有改善心肌肥厚和抗氧化应激的作用(Tab 3)。
Tab 3 Effects of Ses on HWW,LVWW and T-AOC in MS rats(±s)
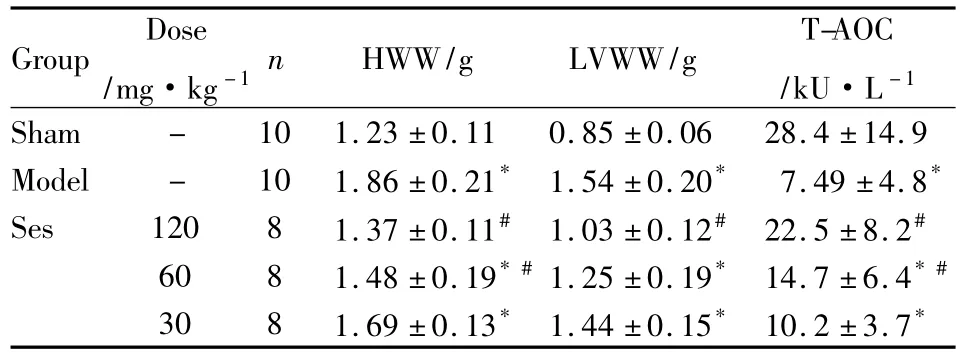
Tab 3 Effects of Ses on HWW,LVWW and T-AOC in MS rats(±s)
*P<0.05 vs sham;#P<0.05 vs model
Group Dose/mg·kg-1n HWW/g LVWW/g T-AOC/kU·L -1 Sham - 10 1.23 ±0.11 0.85 ±0.06 28.4 ±14.9 Model - 10 1.86 ±0.21* 1.54 ±0.20* 7.49 ±4.8*Ses 120 8 1.37 ±0.11# 1.03 ±0.12# 22.5 ±8.2#60 8 1.48 ±0.19*#1.25 ±0.19* 14.7 ±6.4*#30 8 1.69 ±0.13* 1.44 ±0.15* 10.2 ±3.7*
3.4 对心肌病理变化和CVF的影响HE染色可见,MS模型组心肌细胞排列紊乱,肌纤维增粗肥大,组织中可见炎性细胞浸润。Ses 120 mg·kg-1组病理变化较模型组明显改善(Fig 1A~C)。光镜下Masson染色显示胶原纤维呈蓝色,心肌细胞呈红色。镜下观察和半定量分析表明MS模型组心肌间质胶原纤维明显增多,排列紊乱,分布不均,CVF明显增高(P<0.05)。Ses 120 mg·kg-1组胶原积聚明显减轻,排列趋于规则,CVF降低(P<0.05,Fig 1D ~G)。
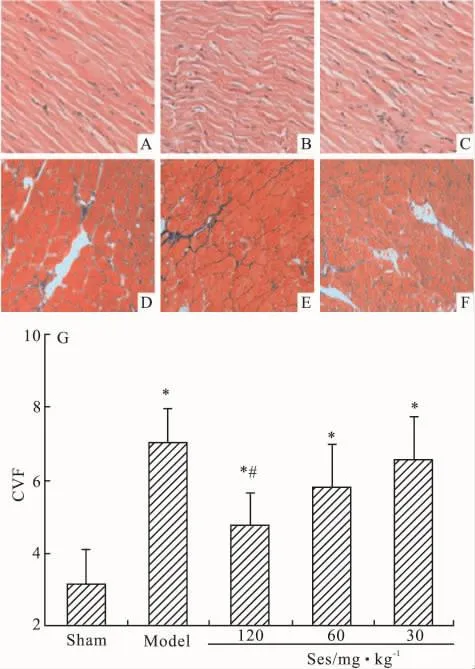
Fig 1 Effects of Ses on pathological changes of myocardium and CVF in MS rats
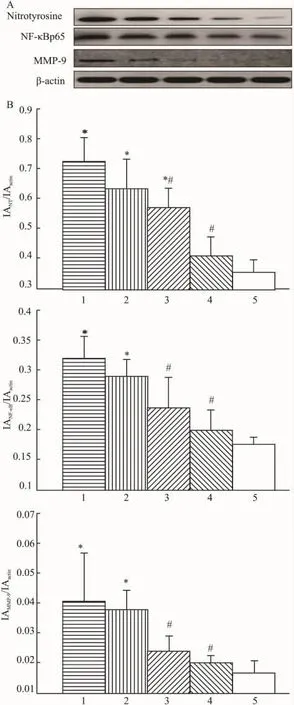
Fig 2 Effects of Ses on myocardial protein expression of NT,NF-κB and MMP-9 in MS rats
3.5 对心肌NT、NF-κB和MMP-9蛋白表达的影响由 Fig 2可见,MS模型组心肌 NT、NF-κB和MMP-9蛋白表达较假手术组分别增加2.03、1.81和2.40 倍(P <0.05)。Ses120、60 mg·kg-1组 NT表达较模型组降低44%和21%,NF-κB表达降低37%和26%,MMP-9表达降低50%和41%(P<0.05)。
4 讨论
本实验结果显示,两肾一夹术和高糖高脂饮食13周诱导的MS大鼠存在高血压、高血脂和高血糖的“三高”症状,同时伴有胰岛素抵抗,说明模型制备成功。进一步观察发现大鼠全心湿重、左室湿重明显增加,心肌纤维增粗肥大,排列紊乱,心肌间质胶原纤维增多,提示MS大鼠模型在具备代谢紊乱的基础上,伴有严重心肌损伤和重构症状。我们前期研究发现长期高糖高脂饮食可诱导以代谢紊乱为主要特点的MS大鼠模型,予以Ses治疗可改善其轻度的心肌损伤[4]。本研究发现,两肾一夹术伴高脂高糖饮食制备的MS模型予以Ses治疗8周后,大鼠体重、全心湿重和左室湿重明显降低,心肌胶原纤维明显减少,证明Ses具有改善MS大鼠心肌肥厚和抗纤维化的作用。
T-AOC是反映机体整体抗氧化水平的重要指标之一。ONOO-是由活性氧中的超氧阴离子与NO迅速反应生成的产物,是活性和毒性很强的氧化剂,可代表氧化应激水平的升高。ONOO-性质活泼,不易检测,但其在体内可与酪氨酸残基结合生成稳定的终末代谢物NT。本实验发现MS大鼠血清TAOC明显降低,心肌ONOO-特异性标记物NT蛋白表达明显增高,提示氧化应激在MS发生发展中发挥重要作用。Ses治疗8周后T-AOC升高,NT表达减少,说明改善氧化应激状态是Ses防治MS心肌损伤的机制之一,与我们之前结论一致[4]。
NF-κB是一种广泛存在的核转录因子,在静息状态下主要由p50/p65异源二聚体与抑制物IκB结合形成无活性的三聚体。机体受到外界刺激后,IκB解离、降解,p50/p65移位进入细胞核。p65与靶基因启动子区域的κB位点结合,调节基因表达,参与炎症、应激反应和细胞凋亡。因此,p65亚基被认为是NF-κB表达最广泛,活性最强的亚单位。文献报道NF-κB调控和转录的多种细胞因子在心脏炎症反应和器官损伤中发挥重要作用[11]。MMPs包括胶原酶、明胶酶和基质溶解素等,是一类分解细胞外基质的锌依赖性蛋白酶家族,在心肌组织重构中起重要作用。明胶酶(MMP-9)的特性近年来备受关注,认为其通过刺激纤维性胶原合成参与纤维化的发生[12]。本实验亦发现MS大鼠左室肥大和胶原沉积,同时心肌NF-κB p65和 MMP-9蛋白表达增加。Ses治疗后可降低蛋白表达,提示Ses防治心肌重构机制与下调NF-κB和MMP-9表达有关。
研究证明活性氧能直接或间接激活各种下游信号通路,对心肌产生严重损伤,在心脏疾病发生和发展中起信号分子作用。文献报道活性氧能使IκB解离,使得NF-κB p65进入核中与DNA结合,启动或加强基因转录[13],增加心衰模型心肌MMPs表达和活性[14]。本研究中Ses降低MS大鼠心肌NF-κB和MMP-9蛋白表达作用是其自身的药理学特性,还是依赖于Ses抗氧化作用的继发结果尚需进一步探讨。近年来,Wu等[15]发现Ses能降低肿瘤坏死因子(TNF)处理的人主动脉内皮细胞NF-κB活性和蛋白表达。Harikumar等[16]报道Ses能降低TNF处理的人慢性白血病KBM-5细胞MMP-9蛋白表达,多种炎症、致癌因素处理的KBM-5细胞NF-κB活性。因此,结合上述报道,我们认为Ses改善MS心肌重构的机制除抗氧化应激外,还与下调NF-κB和MMP-9蛋白表达有关,但确切机制有待于进一步探讨。
[1] Eckel R H,Grundy S M,Zimmet P Z.The metabolic syndrome[J].Lancet,2005,365(9468):1415 -28.
[2] Hirata F,Fujita K,Ishikura Y,et al.Hypocholesterolemic effect of sesame lignan in humans[J].Atherosclerosis,1996,122(1):135-6.
[3] Miyawaki T,Aono H,Toyoda-Ono Y,et al.Antihypertensive effects of sesamin in humans[J].J Nutr Sci Vitaminol,2009,55(1):87-91.
[4] 黄 凯,杨解人,周 勇.L-芝麻素对代谢综合征大鼠心肌损伤的抑制作用[J].中国药理学与毒理学杂志,2008,22(5):341-7.
[4] Huang K,Yang J R,Zhou Y.Inhibitory effect of L-sesamin on myocardial damage of metabolic syndrome rats[J].Chin J Pharmacol Toxicol,2008,22(5):341 -7.
[5] 吴向起,杨解人.芝麻素的抗氧化作用及其对代谢综合征大鼠肾病的影响[J].中国药理学通报,2008,24(8):1065 -9.
[5] Wu X Q,Yang J R.Antioxidation and renoprotective effect of sesamin in metabolic syndrome rats[J].Chin Pharmacol Bull,2008,24(8):1065-9.
[6] 孔 祥,杨解人,郭莉群,等.芝麻素对肾性高血压伴高血脂大鼠心肌肥厚的影响[J].中国实验方剂学杂志,2008,14(12):44-7.
[6] Kong X,Yang J R,Guo L Q,et al.Effects of sesamin on myocardial hypertrophy in renal hypertensive-hyperlipidemia rats[J].Chin J Exp Tradit Med Formul,2008,14(12):44 - 7.
[7] Kong X,Yang J R,Guo L Q,et al.Sesamin improves endothelial dysfunction in renovascular hypertensive rats fed with a high-fat,high-sucrose diet[J].Eur J Pharmacol,2009,620:84 -9.
[8] 孔 祥,杨解人,郭莉群,等.单纯肾性和复合型肾性高血压大鼠主动脉功能的对比研究[J].中国药理学通报,2009,25(2):252-5.
[8] Kong X,Yang J R,Guo L Q,et al.A comparing study of aortic function between renal hypertension rat and renal hypertensive-hyperlipidemia rat[J].Chin Pharmacol Bull,2009,25(2):252 -5.
[9] 李光伟,潘孝仁,Lillioja S,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656 -60.
[9] Li G W,Pan X R,Lillioja S,et al.A new insulin-sensitivity index for the population-based study[J].Chin J Intern Med,193,32(10):656-60.
[10] Schreiber E,Matthias P,Müller M M,et al.Rapid detection of octamer binding proteins with mini-extracts,prepared from a small number of cells[J].Nucleic Acids Res,1989,17(15):6419 -23.
[11]齐洪涛,刘志华,蒋 彬,等.辛伐他汀对慢性心力衰竭兔心肌PPARγ mRNA、蛋白表达及核因子 κB表达、活性的影响[J].中国药理学通报,2010,26(1):115 -20.
[11]Qi H T,Liu Z H,Jiang B,et al.Simvastatin prevents hypertrophy and keeps cardiac function in myocardium of rabbit with overlord by promoting PPAR gamma and inhibiting NF-kappa B[J].Chin Pharmacol Bull,2010,26(1):115 -20.
[12]王 玫,刘继勇,韩 盈,等.丹皮酚对TNF-α诱导真皮成纤维细胞MMP-9 mRNA及细胞因子表达的影响[J].中国药理学通报,2009,25(4):458 -61.
[12] Wang M,Liu J Y,Han Y,et al.Effect of paeonol on the expression of MMP-9 mRNA and cytokines production in human skin fibroblasts induced by TNF-α[J].Chin Pharmacol Bull,2009,25(4):458-61.
[13] Anderson M T,Staal F J,Gitler C,et al.Separation of oxidantinitiated and redox-regulated steps in the NF-κB signal transduction pathway[J].Proc Natl Acad Sci USA,1994,91(24):11527 -31.
[14] Siwik D A,Pagano P J,Colucci W S.Oxidative stress regulates collagen synthesis and matrix metalloproteinase activity in cardiac fibroblasts[J].Am J Physiol Cell Physiol,2001,280(1):53 -60.
[15] Wu W H,Wang S H,Kuan I I,et al.Sesamin attenuates intercellular cell adhesion molecule-1 expression in vitro in TNF-alphatreated human aortic endothelial cells and in vivo in apolipoprotein-E-deficient mice[J].Mol Nutr Food Res,2010,54(9):1340 -50.
[16] Harikumar K B,Sung B,Tharakan S T,et al.Sesamin manifests chemopreventive effects through the suppression of NF-κB-regulated cell survival,proliferation,invasion,and angiogenic gene products[J].Mol Cancer Res,2010,8(5):751 - 61.

