细菌耐药:挑战与对策
肖永红
(浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江 杭州 310003)
1 细菌耐药的趋势与危机
细菌耐药发生发展过程与临床抗菌药物的使用密切相关,在青霉素还未正式应用于临床的1940年,Abraham和Chain首先在大肠埃希菌发现青霉素酶,1956年Newton与Abraham在蜡样芽孢杆菌发现头孢菌素酶,细菌耐药问题逐渐引起重视,其后耐酶青霉素(甲氧西林、苯唑西林等)应用于临床,1960年便出现耐甲氧西林金黄色葡萄球菌(MRSA),进入21世纪美国首先报道了对万古霉素耐药的金黄色葡萄球菌(VRSA);革兰阴性菌耐药情况也是如此,迄今为止,细菌产生的β-内酰胺酶已从普通酶发展到广谱酶、超广谱酶、碳青霉烯酶、水解酶β-内酰胺酶抑制剂的酶等,细菌耐药已经成为全球严峻的公共卫生挑战。
1.1 革兰阳性菌耐药
1.1.1 葡萄球菌耐药 临床分离葡萄球菌对青霉素类耐药率已经超过90%,主要原因在于产生青霉素酶,临床基本不再使用青霉素治疗葡萄球菌感染。自1960年第一株MRSA在英国发现以来,耐药菌逐渐向全球蔓延,各国MRSA比率在5%~70%,凝固酶阴性葡萄球菌甲氧西林耐药比例更高。这类细菌常常表现为多重耐药,包括所有β-内酰胺抗菌药物、氨基糖苷类药物、大环内酯类、磺胺类、喹诺酮类等,仅对糖肽类、利奈唑胺等少数药物保持敏感。耐甲氧西林葡萄球菌是主要的院内感染菌之一[1-2]。
耐药监测调查发现各国由于抗菌药物应用状况、感染控制措施差异,MRSA分离率存在较大差异;欧洲MRSA分离率为2%~54%,其中北欧、中欧与斯堪地亚纳国家分离率较低,如荷兰、德国、瑞士、瑞典等在5%以下,而法国、英国、葡萄牙、希腊、意大利、罗马尼亚等则在30%~60%;美国医院MRSA分离率在60%以上,且呈不断上升趋势,MRSA从1995年的22%增加到2001年57%,ICU病房从1993年的35.9%上升到2003年的64.4%,同样在美国南部MRSA分离率明显高于其他地区。中国耐药监测发现,2007年院内感染MRSA分离率在60%以上,连续耐药监测发现近10年MRSA上升了一倍以上,中国分离MRSA耐药谱更广,耐药基因型别主要为SCCmecIII型。亚洲其他地区MRSA分离率分别为日本(67%)、台湾(60%)、香港(55%)、新加坡(52%)[3-6]。
除医院获得MRSA外,近年来社区获得MRSA(CA-MRSA)正成为耐药菌不断蔓延的重要标志。1993年在澳大利亚从未接触过抗菌药物的土著人士中分离出基因型别独特的MRSA,其后相继在美国、欧洲报道既往健康人群(特别是青少年)感染MRSA的报道,这些菌株大多产Panton-Valentine杀白细胞素(PVL),引起皮肤化脓性感染、坏死性肺炎等,这些菌株除对β-内酰胺类耐药外,对磺胺、四环素等敏感,由于其独特的生物表现与来源,被称为CA-MRSA。世界各地已有CA-MRSA暴发流行的报告,但具体流行情况尚不完全清楚。2001-2002年美国疾病控制与预防中心(CDC)在三个地区(亚特兰大、明尼苏达、巴尔的摩)进行的调查发现,CA-MRSA分离率为8%~20%,亚特兰大的感染发病率为 25.7/100 000,巴尔的摩为 18/100 000;近期美国亚特兰大、休斯敦皮肤感染葡萄球菌中超过70%为CA-MRSA[6-8]。
由于MRSA流行,临床治疗葡萄球菌感染主要依靠万古霉素,在1997年日本发现临床分离MRSA对万古霉素敏感性降低,万古霉素对其MIC值为2~4 mg/L,菌体改变主要为细胞壁增厚,在这类细菌中又分为两种,一种为万古霉素中介葡萄球菌(VISA),另一种为万古霉素异质性中介葡萄球菌(hVISA),后者主要表现为在子代菌体中,只有部分个体对万古霉素敏感性降低,其发生机制尚不明了。由于检验技术要求较高,对VISA和hVISA的流行情况尚不清楚。中国临床分离的万古霉素中介葡萄球菌比例为11.1%~17%[9]。2002年美国密歇根州糖尿病足感染患者分离出对万古霉素耐药金黄色葡萄球菌(VRSA),为世界首例,迄今已有9例同样细菌感染的报道,大多集中在美国密歇根州,万古霉素对细菌的M IC值为16~1 024 mg/L,耐药基因为vanA型,可能来源于万古霉素耐药肠球菌,如果这种细菌流行,临床感染治疗将基本无药可用[2,10-11]。1.1.2 链球菌耐药 肺炎链球菌对青霉素类、大环内酯类耐药在部分国家与地区十分突出,如韩国耐青霉素肺炎链球菌比例高达80%以上,中国香港耐青霉素肺炎链球菌比例为50%左右,西班牙耐药率30%,中国各地调查发现,耐青霉素肺炎链球菌而搭比例约15%,但对青霉素中介的肺炎链球菌耐药比例为30%左右,是临床治疗肺炎链球菌感染的严峻挑战[12-13]。
各种链球菌(包括肺炎链球菌、β-溶血链球菌)对大环内酯类抗菌药物耐药非常严重,但各地耐药差异较大,无论肺炎链球菌还是溶血性链球菌,耐药率均在10%~70%。欧洲国家中意大利、法国的肺炎链球菌对大环内酯耐药率超过40%,而德国、荷兰、捷克、波兰、北欧国家耐药率在10%以下;美国在30%左右;中国超过70%。肺炎链球菌对大环内酯类耐药机制主要包括靶位变异和主动外排,前者对大环内酯类、克林霉素、链阳霉素耐药(MLSB型),而后者只对大环内酯类耐药(MefA型),前者耐药水平高,后者表现为低水平耐药。北美主要为MefA型耐药,而中国与欧洲主要为MLSB型。因此,大环内酯类抗菌药物作为社区呼吸道感染治疗药物的价值在不同地区有所不同。β-溶血链球菌对大环内酯类耐药情况与肺炎链球菌相似,可能部分地区耐药率较肺炎链球菌稍低,如北美、欧洲,中国2007年监测结果β-溶血链球菌对红霉素耐药率为59.2%,且大多为高水平耐药[12,14-16]。
1.1.3 肠球菌耐药 肠球菌属于人体消化道微生态环境中的正常微生物群,常见医院感染病原菌之一,可引起心内膜炎、泌尿系感染、败血症及伤口感染等,中国医院感染监控网的统计分析在革兰阳性菌中居第4位。青霉素、氨苄西林曾经是治疗肠球菌感染的主要药物,近年来肠球菌对青霉素耐药情况十分常见,万古霉素已经成为治疗肠球菌感染的主要抗菌药物,而万古霉素耐药肠球菌在世界各地呈现不同流行水平。与粪肠球菌相比较,屎肠球菌耐药更加突出。
2005年中国全国细菌耐药监测结果表明,医院感染分离粪肠球菌对青霉素、氨苄西林耐药率为15%~23%,屎肠球菌耐药率超过80%,两者对氟喹诺酮类耐药率分别为50%与90%,但肠球菌对万古霉素耐药菌株非常少见,2007年为3%以下,主要分离自重症监护室。美国耐万古霉素肠球菌(VRE)最初出现于1989年,其后迅速增加,美国CDC医院感染监控系统(NNIS)的数据表明,1989-1999年,VRE在美国ICU医院感染患者中分离率由0.4%上升到25.2%,2006-2007美国国家医疗安全网络(NHSN)监测VRE检出率33.3%,其中万古霉素耐药粪肠球菌为6.9%,屎肠球菌为80%。全球各地VRE发生率差别较大,替加环素评价与监测研究(TEST)监测发现VRE屎肠球菌在中国、加拿大、德国在3%以下,英国、意大、瑞士、印度、巴基斯坦在40%以下,而韩国、美国、阿根廷在60%以上[17-19]。
利奈唑胺是新型抗阳性菌药物,对包括VRE在内的肠球菌具有抗菌活性,但由于本品可以通过简单抗菌靶位改变耐药,临床已经有对其耐药菌株分离,甚至个别重症监护室已经有耐利奈唑胺肠球菌、金黄色葡萄球菌感染暴发流行的报道。
1.2 肠杆菌科细菌耐药
1.2.1 大肠埃希菌与肺炎克雷伯菌耐药 作为肠杆菌科细菌的主要代表,大肠埃希菌与肺炎克雷伯菌是社区和医院感染的常见病原菌,中国医院感染与耐药监测中这两种细菌分别处于临床常见细菌第一、第三位,主要耐药问题在于对β-内酰胺类、喹诺酮类耐药[17]。
大肠埃希菌和肺炎克雷伯菌对β-内酰胺抗菌药物耐药的主要机制在于产生超广谱β-内酰胺酶(ESBL),该酶主要对包括青霉素、三代和四代头孢菌素、氨曲南在内的β-内酰胺类耐药,只有碳青霉烯、头霉素类对其稳定,对β-内酰胺类/β-内线胺酶复方敏感;全球各地分离的大肠埃希菌、肺炎克雷伯菌产酶率差异较大,一般大肠埃希菌产酶率低于肺炎克雷伯菌。中国全国细菌耐药监测结果表明,2007年两种细菌产酶率分别为35%、25%,ICU来源细菌产酶率更高,达70%以上,儿童来源细菌产酶率高于成人患者。TEST连续三年监测结果发现,肺炎克雷伯菌产酶率在南美为44%、亚洲太平洋地区22.4%、北美7.5%、欧洲13.3%[17,20-23]。
除产ESBL外,这两种细菌还可以产生以AmpC为代表的头孢菌素酶,但更多的产头孢菌素酶细菌在肠杆菌属之中。值得关注的是首先在肺炎克雷伯菌发现的KPC型非金属碳青霉烯酶,这类酶几乎能水解所有β-内酰胺抗菌药物,2001年首先在美国北卡罗莱州发现,其后迅速在世界各地有报道,包括以色列、中国、巴西、希腊等都有报道,已发现有7种酶型(KPC-2~8),虽然肺炎克雷伯菌的整体检出率不高,但在临床分离的其他细菌中已有发现,包括大肠埃希菌、催产克雷伯菌、产气肠杆菌、阴沟肠杆菌、液化沙雷菌、肠炎沙门菌、铜绿假单胞菌等,这种趋势值得关注[24-25]。
大肠埃希菌对氟喹诺酮耐药在中国是非常突出问题,监测结果显示大肠埃希菌对左氧氟沙星、环丙沙星的耐药率在70%以上,社区感染病原菌耐药率也在50%以上;肺炎克雷伯菌耐药率在35%。全球整体耐药仍然以亚洲地区最为严重,欧美地区耐药率较低,大肠埃希菌对环丙沙星的耐药率韩国为35%、台湾23%、英国4%、美国3%;肺炎克雷伯菌则为韩国12%、台湾11%、英国11%、美国7%[17,25-26]。细菌对喹诺酮类主要耐药机制主要在于抗菌靶位变异,特别是DNA旋转酶A亚单位(gyrA)和拓扑异构酶IV C亚单位(parC)变异,但近年来有关质粒介导的喹诺酮类耐药在全球流行成为关注热点,这种耐药主要通过保护抗菌位点,阻碍药物与靶位结合有关,具有这种机制的细菌对喹诺酮类呈现低水平耐药,但为靶位变异耐药的选择提供了便利,其介导基因为qnr,已发现有qnrA、B、S三型,其中A型较为常见,在几乎所有人类居住的大陆上都有发现,最常存在于肠杆菌科属细菌中,如大肠埃希菌、肺炎克雷伯菌、弗氏柠檬酸杆菌属和斯氏普罗威登斯菌中,检出率在0.4%~94%;除此之外,质粒介导的氨基糖苷乙酰化酶变异酶AAC(6’)-Ib-cr可以水解喹诺酮之哌嗪环(环丙沙星、诺氟沙星),使抗菌药物失活,这种质粒介导耐药也广泛存在于世界各地,上海地区大肠埃希菌检出率为51%,而美国检出率为28%[27-28]。
1.2.2 其他肠杆菌科细菌耐药 肠杆菌属细菌是医院感染常见病原体,其耐药情况与大肠埃希菌、克雷伯菌具有相似之处,中国耐药监测分离医院感染肠杆菌属对广谱青霉素、三代头孢菌素、喹诺酮类、庆大霉素等耐药明显,但耐药率较大肠埃希菌稍低;与大肠埃希菌不同之处在于,这类细菌由于主要产生以AmpC为代表的头孢菌素酶,耐药谱更广,临床主要采用碳青霉烯类、四代头孢菌素进行治疗。SENTRY监测1998-2003北美地区结果表明,肠杆菌属对头孢他啶、头孢吡肟、阿米卡星、亚胺培南、环丙沙星耐药率分别为17.5%、0.4%、0.2%、0.1%、4.6%,远低于中国2005年结果,其分别是26.1%、0%、21.7%、0%和26.1%[29]。
沙门菌和志贺菌是常见社区肠道感染病原菌,其耐药情况较其他肠杆菌科细菌低,中国2005年监测结果表明,两者对头孢曲松耐药率分别为5.2%和6.1%,对环丙沙星耐药率为0%和15.1%,对庆大霉素耐药率为13.3%和30.3%[17]。
1.3 葡萄糖非发酵菌耐药
1.3.1 铜绿假单胞菌耐药情况 铜绿假单胞菌是医院感染常见细菌,特别是在重症监护室分离率更高,中国细菌耐药监测2007年结果显示,铜绿假单胞菌为医院感染中第二常见细菌,对铜绿假单胞菌感染,一般采用阿米卡星、左氧氟沙星、碳青霉烯、头孢他啶、头孢吡肟治疗,但细菌对这些药耐药,甚至多重耐药已经呈逐年增加趋势,部分耐药率已经处于较高水平。中国细菌耐药监测2007年结果表明,铜绿假单胞菌对上述抗菌药物的耐药率分别为21.9%、31.7%、33.2%、29.9%、25.3%;而2005年美国MYSTIC(Meropenem Yearly Susceptibility Test Information Collection)监测结果分别为 10.4%、22.4%、7.3%、9.8%、4.8%[17,29]。
铜绿假单胞菌对碳青霉烯类耐药是值得关注的问题,这类细菌耐药常常表现为多重耐药,甚至泛耐药现象,细菌可能对所有既往有效的药物耐药,给临床感染治疗带来严峻挑战。铜绿假单胞菌对碳青霉烯类耐药主要在于产生碳青霉烯酶,其中金属碳青霉烯酶在铜绿假单胞菌的流行尤为突出,主要酶型包括IMP、VIM、GIM,欧洲耐药监测2007年报告,33个参加国家中6个国家铜绿假单胞菌对碳青霉烯类耐药超过25%,其中希腊为51%,这些国家来源菌株都发现VIM-1型酶;而德国还发现GIM型酶流行;IMP型酶则在中国、日本、台湾、加拿大、澳大利亚等均有发现[24,30]。
1.3.2 不动杆菌耐药情况 近年来鲍曼不动杆菌正成为临床重症患者感染主要病原菌之一,中国耐药监测结果发现不动杆菌为第4位常见细菌[17],尤其是鲍曼不动杆菌的耐药性增加十分迅速,多重耐药或泛耐药菌株所致感染暴发流行在世界各地都有报道,多重耐药鲍曼不动杆菌被称为革兰阴性“MRSA”。
2007年中国细菌耐药监测发现,鲍曼不动杆菌对阿米卡星、左氧氟沙星、头孢哌酮/舒巴坦、亚胺培南耐药率分别为51.5%、45.8%、13.4%、23.4%;美国2005年MYSTIC结果分别为妥布霉素(10.4%)、左氧氟沙星(22.4%)、哌拉西林/他唑巴坦(9%)、亚胺培南(7.3%);欧洲2002-2004年MYSTIC结果显示该菌对以下药物敏感率为亚胺培南(69.8%)、环丙沙星(34%)、庆大霉素(47.6%)[17,30-31]。需要关注的是,鲍曼不动杆菌对多黏菌素B耐药菌株已在全球各地发生,北美、亚太、欧洲与南美地区耐药率分别为1.7%、1.9%、2.7%、1.9%[23]。
2 细菌耐药造成严重的公共卫生后果
细菌耐药不仅仅带来临床感染性疾病治疗困难,更为严重的是由于多重耐药与泛耐药菌株流行,感染治疗失败率增加,患者病死率大幅上升;如果耐药菌长期在医疗机构流行,住院患者耐药菌感染率上升,患者住院时间将大幅度延长,这将直接影响医疗技术进步和医疗质量提高。在治疗耐药菌感染中,需要应用更多的医疗手段,选择昂贵治疗药物,占用更多的医疗资源,给整个医疗卫生保健体系带来严重的经济负担,这将严重影响人人享有基本医疗保健的基本目标的实现。
美国研究发现MRSA感染病死率为21%,而敏感菌感染为8%;产超广谱酶大肠埃希菌感染和敏感菌比较,平均住院时间分别为21与11天,治疗有效率分别为39%与83%,患者病死率分别为38%与14%;耐亚胺培南、铜绿假单胞菌感染患者住院时间为15.5天,敏感菌为9天,病死率分别为31.1%与16.7%。青霉素耐药与敏感肺炎链球菌肺炎患者平均住院时间为14与10天,耐药者人均多花费1 600美元。对三代头孢菌素耐药肠杆菌感染与敏感菌比较死亡率高5.2倍,住院时间长1.5倍,医疗费用高1.5倍(表1)。据估计,美国2002年由于耐药菌感染导致直接医疗费用增加50亿美元[32-34]。
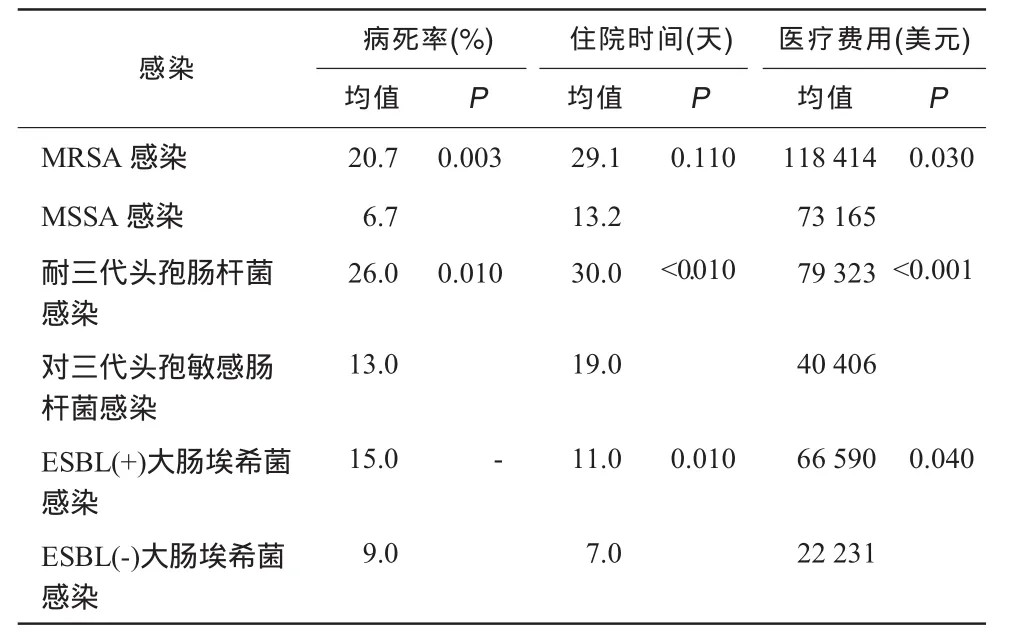
表1 常见耐药菌感染对医疗质量和医疗费用影响
我国耐药菌感染与非耐药菌感染比较,患者病死率增加2.17倍,人均住院日延长15.8天,多花住院费用16 706元[35]。据测算,2005年我国因细菌耐药而多支出药费36.6亿元,住院费288.83亿元。因耐药菌感染死亡的人数为48.9万人;抗菌药物不合理使用与细菌耐药所导致的经济负担高达1 000亿元以上,是导致医疗费用上涨的重要原因。卫生部指出由于结核耐药所导致的结核病卷土重来,每年使我国丧失3.5亿劳动日,经济损失90亿元。
3 应对细菌耐药挑战
细菌耐药(Bacterial resistance)已经成为威胁人类安全的公共健康问题之一,2010年4月7日世界卫生日主题发出呼吁:抵御耐药性——今天不采取行动,明天就无药可用(Combating drug resistance no action today,no cure tomorrow),提醒全球各国,必须对细菌耐药采取积极行动。为此世界卫生组织提出了六条控制细菌耐药的一揽子计划:①制定具有经费保证的综合性国家计划,明确责任,全民参与;②加强监测与实验室能力建设;③确保质量可靠的基本药物持续供给;④规范和促进包括畜牧业在内的药物合理使用,确保医疗质量;⑤强化感染预防与控制;⑥鼓励创新与新疗法的研究与开发。其中合理用药、感染防控、监测与实验室能力建设以及创新研究直接与基础与临床医学相关[36-39]
3.1 各国政府需要高度重视细菌耐药问题,以负责任的态度采取有效应对措施
细菌耐药已经不再是单纯医学问题,已经成为威胁全人类安全的公共卫生问题。遏制细菌耐药不能仅限于专业领域,单纯依靠医务人员也无法取得积极成果。政府管理部门需要站在全球高度认识细菌耐药,制定相关管理法规、实施耐药控制计划;控制耐药不仅仅只停留在口号,需要有实际可行的计划,包括必要的管理与财政支持。抗菌药物管理涉及医疗、药品零售和动物养殖等多个部门与环节,只有把这些分散在各部门的任务纳入到统一管理之中,采取协调合作的方式,使抗菌药物在各部门间的管理方式、方法、强度等达成一致,才能真正使抗菌药物管理不留死角,细菌耐药的产生不留空间。
3.2 建立控制细菌耐药的技术支撑体系
掌握细菌耐药流行情况以及相关信息,对制定抗菌药物管理和应用指导具有十分重要的价值。细菌耐药监测需要成为立体化网络,包括各个层面和各个地区的耐药信息采集。不同监测所获得的信息互相配合,各自发挥不同管理与临床价值:国家级细菌耐药监测,对掌握一国耐药变迁,制定抗菌药物管理政策和药物研究开发指引具有不可替代作用;各医疗机构耐药监测,对指导临床抗菌药物应用最为直接。与细菌耐药监测相匹配的抗菌药物生产、流通、应用监测,对掌握药品消费状况,合理应用现状等具有重要意义。
3.3 以合理用药为中心,遏制细菌耐药
所谓抗菌药物合理应用包含两方面内容,一方面必须明确抗菌药物只对细菌性感染有效,也就是抗菌药物应用指征是各种细菌感染,非细菌感染不能使用抗菌药物;另一方面则是需要根据感染病原菌及其药物敏感性、患者病理生理状况和抗菌药物本身特征选择恰当的抗菌药物,制定正确的给药方案;要做到合理使用抗菌药物,必须熟悉以下内容:①正确诊断细菌性感染是合理使用抗菌药物的前提;②掌握细菌耐药变迁,因地制宜选择药物;③熟悉抗菌药物特点,针对不同感染类型选择药物;④了解患者病理生理状况,制定正确给药方案;⑤不断学习新知识,提高感染性疾病治疗水平:同其他医学门类一样,感染性疾病研究也呈现日新月异的情况,新的疾病不断出现,新的诊疗方法、新的抗菌药物、新的用药办法等目不暇接,临床医师应该孜孜不倦地学习掌握抗菌药物应用新理论、新技术,始终处于抗菌药物合理应用领先地位。
3.4 开展科学研究,探索治疗耐药菌感染新技术、新方法
抗菌药物研究开发经约70余年历史,药物种类已经超过20余类,抗菌靶位已经涵盖几乎所有菌体结构,新抗菌药物的研究开发进入“贫矿”时期,原有的研究与开发方式已经无法满足日益严峻的耐药菌感染治疗需求。科学研究工作者,需要积极行动起来,一方面深入研究细菌耐药的发生发展和耐药机制,探索克服耐药的手段;另一方面,需要以新的思路和新的理念进行研究,利用现代科学研究成果,开辟抗感染治疗新方法,如疫苗、免疫制剂、生物制剂等,这有这样才能打破“新药研发-临床应用-细菌耐药”的恶性循环,使感染性疾病的治疗方法有更多选择。
3.5 加强科普知识宣传,提高民众对抗菌药物合理使用与细菌耐药的认识
抗菌药物的过度使用不仅仅源于医务人员的错误,与社会人群对这类药物的不正确认识也有非常密切关系。必须通过各种途径、采用不同方式开展广泛的公众教育,使普通人群认识到合理用药的重要性和细菌耐药的危害性,避免对抗菌药物的过度依赖,减少对临床抗菌药物应用的影响,把抗菌药物应用真正建立在基于临床需要的基础之上。
[1] Chambers HF.The changing epidemiology of Staphylococcus aureus?[J].Emerg Infect Dis,2001,7(2):178-182.
[2] Karchmer AW,Bayer AS.Methicillin-resistant Staphylococcus aureus:an evolving clinical challenge[J].Clin Infect Dis,2008,46 (S5):342-343.
[3] Boucher HW,Corey GR.Epidem iology of methicillin-resistant Staphylococcus aureus[J].Clin Infect Dis,2008,46(S5):344-349.
[4] Klevens RM,Morrison MA,Nadle J,et al.Invasive methicillin-resistant Staphylococcus aureus infections in the United States[J].JAMA,2007,298(15):1763-1771.
[5] 赵彩云,肖永红,王珊,等.甲氧西林耐药金黄色葡萄球菌葡萄球菌染色体mec型别研究[J].中华传染病杂志,2007,25(10):611-615.
[6] Aiello AE,L owy FD,W right LN,et a l.Meticillin-resistant Staphylococcus aureus among US prisoners and m ilitary personnel:review and recommendations for future studies[J].Lancet InfectDis,2006,6(6):335-341.
[7] Chambers HF.Community-associated MRSA:resistance and virulence converge[J].N Engl JMed,2005,352(14):1485-1487.
[8] Fridkin SK,Hageman JC,Morrison M,et al.Methicillin-resistant Staphylococcus aureus disease in three communities[J].N Engl J Med,2005,352(14):1436-1444.
[9] Sun WJ,Chen HB,Liu YD,et al.Prevalence and characterization of heterogeneous vancomycin-intermediate Staphylococcus 2 aureus(hVISA)from 14 cities in China[J].Antimicrob Agent Chemother,2009,53(9):3642-3649.
[10] Finks J,Wells E,Dyke TL,et al.Vancomycin-Resistant Staphylococcus aureus,M ichigan,USA,2007[J].Emerg Infect Dis, 2009,15(6):943-945.
[11] Hiramatsu K,Aritaka N,Hanaki H,et al.Dissem ination in Japanese hospitals of strains of Staphylococcus aureus heterogeneously resistant to vancomycin[J].Lancet 1997,350(9092): 1670-1673.
[12] Pallares R,Fenoll A,Linares J,et al.The epidem iology of antibiotic resistance in Streptococcus pneumoniae and the clinical relevance of resistance to cephalosporins,macrolides and quinolones[J].Int JAntim icrob Agent,2003,22(S1):15-24.
[13] Clinical and Laboratory Standards Institute.Performance Standards for Antimicrobial Susceptibility Testing;Seventeenth Informational Supplement[J].NCCLS publication,2008,27(1): M 100-S17.
[14] 姚成,于泽波,肖永红.重庆地区肺炎链球菌耐药性与分子流行病研究[J].中华流行病学杂志,2005,26(6):431-434.
[15] 肖永红,刘健,王哲,等.大环内酯类耐药化脓性链球菌表型与基因型研究[J].中国抗生素杂志,2007,32(4):323-326.
[16] Leclercq R.Mechanisms of Resistance to Macrolides and Lincosam ides:Nature of the Resistance Elements and Their Clinical Implications[J].Clin Infect Dis2002,34(4):482-492.
[17] 肖永红,王进,赵彩云,等.Mohnarin 2006-2007细菌耐药监测报告[J].中华医院感染学杂志,2008,18(8):1051-1056.
[18] Pootoolal J,Neu J,W right GD Glycopeptide antibiotic resistance.Annu.Rev.Pharmacol[J].Toxicol,2002,(42):381-408.
[19] Werner G,Coque TM,Hammerum AM,et al.Emergence and spread of vancomycin resistance among enterococcus in Europe [J].Eurosurveillance,2008,13(47):1-11.
[20] 肖永红,王进.Mohnarin 2006-2007报告:重症监护室细菌耐药监测结果[J].中华医院感染学杂志,2008,18(9):1223-1227.
[21] 李湘艳,肖永红.Mohnarin 2006-2007报告:14岁以下患者耐药监测[J].中国抗生素杂志,2008,33(10):579-589.
[22] Reinert RR,Low DE,Rossi F,et al.Antim icrobial susceptibility among organisms from the Asia/Pacific Rim,Europe and Latin and North America collected as part of TEST and the in vitro activity of tigecycline[J].J Antim icrob Chemother 2007,60 (5):1018-1029.
[23] Isturiz R Global resistance trends and the potential impact on empirical therapy[J].Int J Antim icrob Agent 2008,32(S4): S201-S206.
[24] Hawkey PM,Jone AM.The changing epidem iology of resistance [J].JAntim icrob Chemother,2009,64(S1):i3-i10.
[25] Patel JB,Rosheed JK,Kitchel B.Carbapenemases in Enterobacteriaceae:Activity,Epidemiology,and Laboratory Detection[J]. Clin M icrobiolNewsl,2009,31(8):55-63.
[26] Livermore DM,James D,Reacher M et al.Trends in fluoroquinolone(ciprofloxacin)resistance in Enterobacteriaceae from bacterem ias,England and Wales,1990-1999[J].Emerg Infect Dis,2002,8(5):473-478.
[27] Martinez-Martinez L,Cano LE,Rodriguez-Martinez J,et al. Plasmid-mediated quinolone resistance[J].Expert Rev Anti Infect Ther,2008,6(5):685-711.
[28] Robicsek A,Jacoby GA,Hooper DC.Theworldw ide emergence of plasm id-mediated quinolone resistance[J].Lancet Infect Dis, 2006,6(10):629-640.
[29] Sadera HS,Fritschea TR,Jones RN.Potency and spectrum trends for cefepime tested against 65 746 clinical bacterial isolates collected in North Americanmedical centers:Results from the SENTRY Antim icrobial Surveillance Program(1998-2003) [J].Diag M icrobiol Infect Dis,2005,52(3):265-273.
[30] Rhomberga PR,Jones RN.Contemporary activity ofmeropenem and comparator broad-spectrum agents:MYSTIC program report from the United States component[J].Diag M icrobiol Infect Dis,2005,57(2):207-215.
[31] Unal S,Garcia-Rodriguez JA.Activity ofmeropenem and comparators against Pseudomonas aeruginosa and Acinetobacter spp. isolated in the MYSTIC Program,2002-2004[J].Diagn M icrobiol Infect Dis,2005,53(4):265-271.
[32] Lee SY,Kotapati S,Kuti JL,et al.Impact of extended-spectrum beta-lactamase-producing Escherichia coliand K lebsiella species on clinical outcomes and hospital costs:a matched cohort study [J].Infect Control Hosp Epidem iol,2006,27(11):1226-1232.
[33] Cosgrove SE.The relationship between antim icrobial resistance and patient outcome:mortality,length of hospital stay,and health care costs[J].Clin Infect Dis,2006,42(S2):82-89.
[34] Engemann JJ,Carmeli Y,Cosgrove SE,et al.Adverse clinical and econom ic outcomes attributable to methicillin resistance among patientsw ith Staphylococcus aureus surgical site infection [J].Clin Infect Dis,2003,36(5):592-598.
[35] 杨莉,肖永红,王进,等.抗菌药物耐药对住院费用影响分析[J].中国药物经济,2009,(1):16-20.
[36] WHO,Policy package to combat antim icrobial resistance.April 7th,2011,Geneva.
[37] 肖永红.感染科医师应该成为抗菌药物合理应用的中坚[J].国际流行病学与传染病学杂志,2009,36(1):1-3.
[38] 肖永红.抗菌药物的药代动力学/药效学概念及其临床意义[J].中华医学杂志,2004,84(22):1914-1915.
[39] 肖永红.抗菌药物合理应用体系与实践[J].中国抗生素杂志,2009,34(S1):109-113.

