兔多杀性巴氏杆菌的分离与PCR鉴定
苗立中 ,李 峰,王 艳,李书光,谢金文,沈志强
(山东省滨州畜牧兽医研究院,山东滨州 256600)
兔巴氏杆菌病(又称兔出血性败血症),是由多杀性巴氏杆菌引起的急性、致死性传染病。兔巴氏杆菌病临床上以出现鼻炎、地方流行性肺炎、全身性败血症、中耳炎、结膜炎、子宫积脓和睾丸炎等特征。本病发生后多呈散发性,因此难以净化兔群,如不及时采取有效措施会引起家兔生长缓慢、饲料报酬降低或大批死亡及药物防治费用增加,给养兔业造成严重的经济损失。2010年3月山东淄博某兔场养殖的种兔和肉兔,出现急性死亡,经本院兽医诊断中心对病死兔进行病原分离与鉴定,证实为兔多杀性巴氏杆菌引起。
1 发病情况及病理变化
发病兔场存栏兔856只,其中成年兔532只,小兔324只。发病期间病兔156只,发病率18.2%;发病死亡83只,其中小兔26只。部分兔未发现任何症状即突然死亡。
大多数病兔表现精神沉郁,行动迟缓,被毛零乱,有的食欲减弱或不食,鼻端被毛潮湿、缠结,眼结膜、鼻腔黏膜充血、出血,鼻腔有黏液流出,呼吸急促、困难,用前爪抓擦外鼻孔。腹泻,排绿色稀粪,体温40.7℃~42.2℃,一般发病后1~3 d死亡;病程稍长的,可见病兔四肢关节肿胀,行动不便。
剖检死兔,可见腹膜、皮下组织有小点出血;喉气管有点状出血;心包膜有出血斑点;肺呈多发性肺炎,有气肿出血;肝脏肿大、质脆、棕黄色,表面有出血点;脂肪变性;脾脏、肾脏肿大、出血;胃肠道出血,小肠出血严重,十二指肠呈卡他性出血性肠炎,肠系膜出血;淋巴结肿大、出血。
2 实验室常规分离及分子生物学诊断
2.1 材料
2.1.2 试验药品 麦康凯琼脂,购自北京双旋微生物培养基制品厂;琼脂粉,购自中国惠兴生化试剂有限公司;马丁肉汤培养基、鲜血琼脂培养基及生化试剂,均按常规方法制备。生化管均购自杭州天和微生物试剂有限公司。药敏纸片购自北京天坛药物生物技术开发公司。
2.1.3 实验动物 小鼠体重18~22 g,购自山东中医药大学动物实验中心。实验兔体重3.0~3.5 kg由山东绿都生物科技有限公司实验动物中心提供。
2.1.4 受试菌液的制备 分离菌株纯化后接种于5.0m L马丁肉汤,37℃培养20 h,活菌计数后,调整菌液浓度,使其达到1×109CFU/m L作为感染试验用菌液。
2.2 方法
2.2.1 病料涂片镜检 无菌采取兔的心血、肝脏和脾脏组织,干燥固定后分别做革兰染色和瑞氏染色,然后镜检观察。
2.2.2 病原分离培养及纯化 无菌取肺脏、肝脏、脾脏、肾脏、淋巴结、脑组织和鼻内分泌物分别接种于鲜血琼脂培养基、麦康凯琼脂培养基平板上[2],37℃培养48 h,从鲜血琼脂培养基挑取单个典型菌落再次接种于该培养基上进行培养48 h;再次挑取单个典型菌落,将其一半接种到鲜血琼脂斜面上进行纯培养,同时将另一半菌落涂片、革兰染色、镜检;纯培养物置4℃冰箱中保存,备用。
2.2.3 生化试验 从4℃冰箱内取出2株疑似巴氏杆菌分离株和标准菌株纯培养物,在超净台内分别挑取单菌落穿刺接种葡萄糖、蔗糖、乳糖等生化管内,相同的生化管接种 3管,用封口膜封口,放入37℃恒温培养箱中培养72 h观察结果。
2.2.4 致病性及动物回归试验 取健康小鼠12只,随机分成 3组,Zp1、Zp2为试验组,Zp3为对照组。3组小鼠各皮下注射相应的菌株肉汤培养物0.2m L/只(1.0×109CFU/m L),观察小鼠死亡情况,死亡小鼠进行剖检,观察组织病变;采其心血涂片、染色、镜检,同时采集肝脏、脾脏、肺脏进行细菌分离培养。
自四川建立首台高压氧舱、开设新学科以来已有39年,39年在历史的长河中弹指一挥间,但对一门交叉学科而言,从建立到发展,却是一段跋涉与攀登的历程,反映了一代人的坚持与努力。值此四川省医学会90周年华诞之际,我们自豪地说:在推动现代医学的发展浪潮中,四川省的高压氧医务人员做为一个团结进取、善于探索、勇于实践的学术群体,对四川和全国医学事业的发展做出了特殊贡献。让我们继续携手同行,用我们的智慧和双手为当代中国高压氧医学谱写新的篇章。
家兔回归试验:取16只健康家兔随机分为4组,在腿部做好标记。两组试验组家兔接种分离菌株纯化物Zp1和Zp2,标准对照组接种Zp3株,颈部皮下,2m L/只(1.0×1010CFU/m L);阴性对照组注射等量生理盐水,4组家兔相同条件饲养。接种后48 h内每8 h测体温1次,并记录。对死亡家兔进行剖检,取其心血涂片、染色、镜检,同时采集死亡兔肝脏、脾脏、肺脏进行细菌分离培养。
2.2.5 药敏试验 按常规方法进行药敏试验。判定标准为抑菌环直径在15 mm以上为高度敏感(青霉素高敏为20mm以上);10~15mm为中度敏感;10 mm以下为低度敏感;无抑菌环为不敏感。
2.2.6 PCR鉴定 上游引物 P1:5′-ATCCGCTATTYACCCAGTGG-3′。下游引物 P2:5′-GCTGTAAACGAACTCGCCAC-3′。
纯培养的单个菌落接种于马丁肉汤,37℃摇床培养16 h,煮沸法提取DNA。
PCR扩增反应体系(25μL):灭菌去离子水17μL,10×Bu ffer 2.5μL,10mmo l/L dNTP 2μL,10 pmol/μL 上 、下游引物各1μL,模板1μL,Taq酶(5 U/μL)0.5μL。反应条件:95℃预变性5m in、94 ℃变性40 s、55 ℃退火40 s、72 ℃延伸1 min,30个循环。PCR产物1%琼脂糖电泳,凝胶成像仪观察结果。
3 结果
3.1 细菌涂片镜检 将病料涂片,分别用革兰染色和瑞氏染色后显微镜下观察,瑞氏染色的涂片可见两极着色明显的球杆菌,两极之间两侧连线明显,革兰染色为阴性、两端着色较深的单个或成对的球杆菌。
3.2 细菌分离培养结果 将病料分别接种于鲜血琼脂培养基平板、麦康凯琼脂培养基平板,置于37℃恒温箱中培养48 h后观察,可见鲜血琼脂培养基上菌落为圆形隆起、光滑湿润、边缘整齐、浅灰色、半透明、直径为2~3 mm,在折光检验时呈现蓝绿色;麦康凯琼脂平板无菌生长。取典型菌落涂片,经革兰染色及瑞氏染色后镜检,可见球杆菌。
3.3 生化试验结果 见表1。
生化试验结果如表1所示,符合多杀性巴氏杆菌的生化特性。3.4 致病性试验结果 Zp1株、Zp2株、Zp3株3组小鼠均在接种后48 h内全部死亡。剖检死亡小鼠,3株菌在接种局部均可见肌肉及皮下组织水肿和炎症,胸腔和心包有浆液性纤维素渗出物,心外膜有多数出血点,肝脏、淋巴结水肿增大,取肺脏、肝脏等病变组织涂片,瑞氏染色镜检发现两极浓染的球杆菌;革兰染色镜检为两极浓染的阴性球杆菌,符合多杀性巴氏杆菌的形态特性。
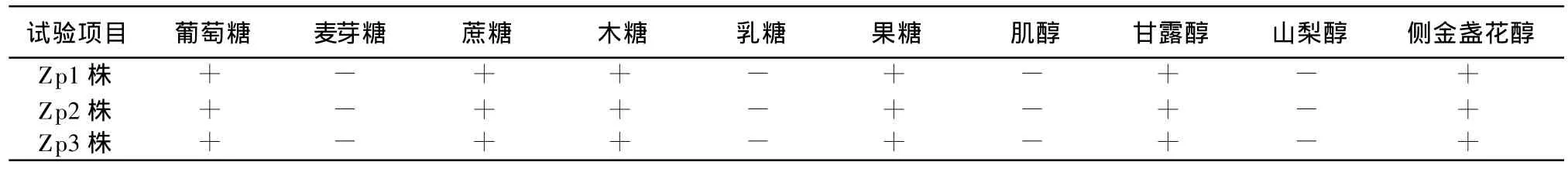
表1 3株菌的生化试验结果
家兔回归试验两试验组及标准对照组家兔于48 h内全部死亡,死前精神委靡,呆立不动,食欲减退,呼吸困难,体温升高;阴性对照组家兔均健活,无任何临床症状。立即剖检死亡家兔,可见其心外膜、呼吸道黏膜、肺脏、淋巴结有出血斑点。用心血涂片、革兰染色、镜检,显为阴性球杆菌。
3.5 药敏试验结果 两分离菌株各种药物抑菌圈的大小基本一致,参照前述药敏试验判定标准可知,头孢噻呋、环丙沙星、氧氟沙星、氟苯尼考和磺胺六甲氧嘧啶对分离菌Zp1、Zp2有较好的药物敏感性,多西环素、卡那霉素、红霉素、新霉素中敏;青霉素、链霉素、土霉素、四环素低敏。
3.6 菌落PCR鉴定结果 扩增产物在1%琼脂糖凝胶中电泳分离后,通过凝胶成像系统显示结果如图1,在457 bp处有一条亮带,为目的条带,证明PCR扩增成功。

图1 菌落PCR鉴定的电泳结果
4 讨论
4.1 根据流行病学调查、临床表现、病理变化、分离菌株形态染色镜检观察、培养特性、生化特性、致病性试验、PCR鉴定等结果,可以确定所分离的菌株为兔多杀性巴氏杆菌。
4.2 从药敏试验的结果来看,此兔群分离的多杀性巴氏杆菌的耐药性较强,14种抗生素中只有5种高敏,可能与临床中不合理使用抗生素有关。此兔群经头孢噻呋、氟苯尼考等高敏药物治疗,同时采用相应综合防制措施,治疗效果显著,病情得到了控制。4.3 兔多杀性巴氏杆菌PCR鉴定方法,(本试验采取从纯培养物中进行检测),大大缩短检测时间,能够快速诊断疫病,对于尽快采取防制措施有重要的实践意义。

