微藻固定燃烧烟气中CO2的研究进展
张一昕,赵兵涛,熊锴彬,张忠孝,郝小红,刘涛
1 上海理工大学能源与动力工程学院,上海 200093
2 中国海洋大学海洋生命学院,青岛 266003
近年来,温室效应导致的气候变暖问题已经成为全球关注的环境、科学、政治和经济问题[1]。在所有温室气体中,CO2对温室效应的贡献最大,大气中的 CO2浓度已经从工业革命前的 0.028%增长至0.036%[2]。目前,普遍认为人类活动所释放的CO2是造成大气中CO2浓度升高的主要原因,其中很大一部分来自于石化燃料的燃烧。随着对能源的需求不断增长,单纯的通过提高能源利用效率来控制CO2的排放已经难以为继,采用稳定、安全和环境可接受 CO2捕捉和封存 (CCS) 技术已经成为控制CO2排放的重要手段。
在CCS技术中,首先通过烟气分离、富氧燃烧和燃烧前分离等手段在生产能源的过程中把CO2分离出来。然后,把CO2储存到地下蓄水层和深海中以避免CO2重新释放到大气中。海洋微藻生物固定烟气中的 CO2作为一种不同于物理、化学分离法(例如吸收法、吸附法和中和反应) 的新型气体分离技术 (图1),已成为一种重要和有效的CCS技术。其基本原理是微藻通过光合作用把烟气中的CO2作为碳源加以吸收利用并转化为有价值的化学物质。近年来,对生物法固定燃烧烟气中的CO2进行了广泛的研究。结果表明,微藻生物固定烟气中CO2是一种有效的CCS技术,并具有大规模应用于减少燃烧烟气中CO2排放的潜力。
基于微藻固定燃烧烟气中 CO2技术的巨大潜力,本实验室在国家自然科学基金的支持下,开展了对该技术的研究工作,并取得了一定进展。本文将结合本实验室的相关研究,对国内外对该技术在藻种的筛选和培养、高效光生物反应器的研发和微藻固碳产物的利用等方面的研究情况进行综述和总结,并对其技术前景进行展望。
1 微藻生物固定CO2的优势
生物固定 CO2是地球上最主要和最有效的固碳方式,在碳循环中起决定作用。生物固定和封存CO2是通过光合作用利用光能把水、CO2和矿物质转化为有机化合物,无需额外的能源消耗,也不会带来二次污染,利用此法来进行CO2减排是符合自然界循环和节省能源的理想方式。能利用该法进行固碳的主要是植物、光合细菌以及藻类。
与通过物理法和化学法实现CO2的固定和封存相比较,微藻生物固定CO2具有光和速率高、生长速度快、环境适应性强和CO2的分离和捕捉成本低等优点。如果可以获得合适的藻种,此方法可直接用于固定烟气中的CO2。微藻能够把CO2转化为碳水化合物和油脂,因此微藻固碳产生的藻体可以用于生产食物、化学产品和生物质能源。因为具有以上优点,所以微藻固定CO2有望成为一种技术上可行且具有经济价值的CO2固定方法[3-4]。
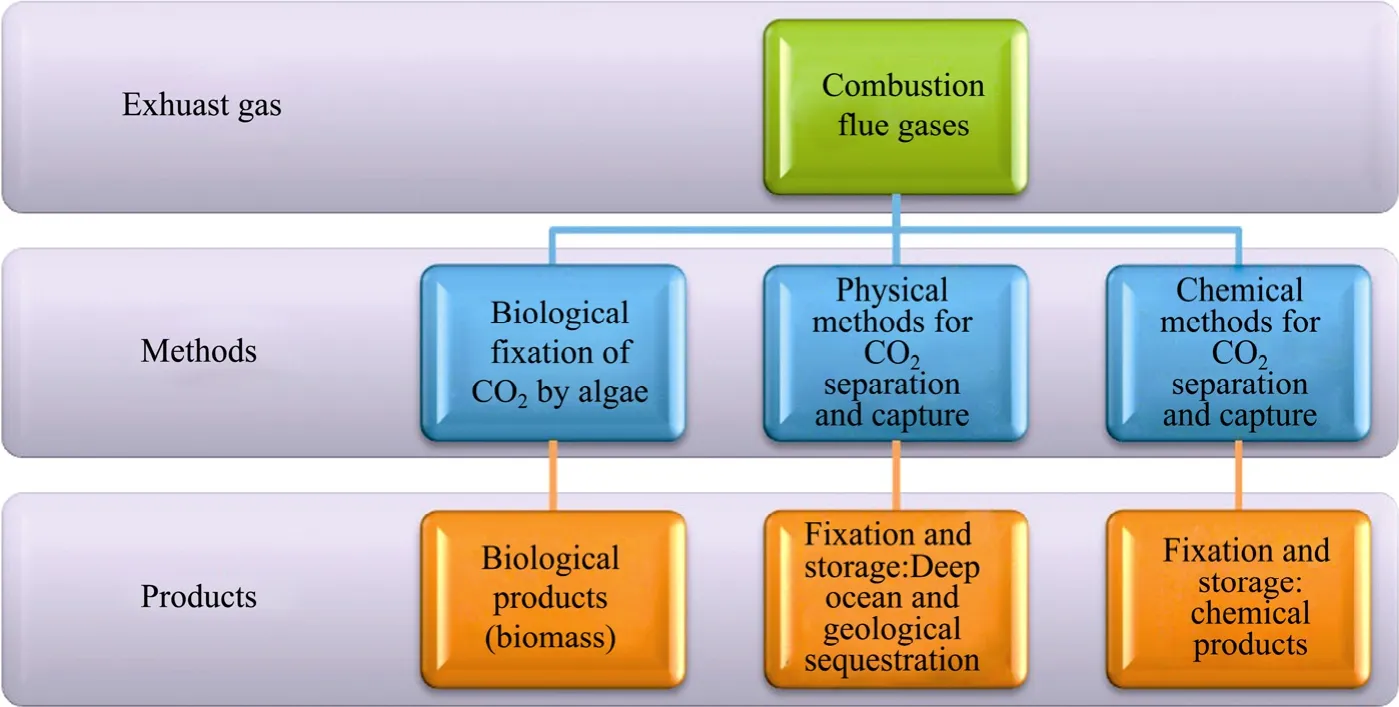
图1 常见的CCS技术路线图Fig. 1 Typical technical scheme of industrial CO2 capture and storage.
2 微藻固定燃烧烟气中CO2的研究进展
目前国内外对微藻固定CO2的研究主要集中在以下 3个方面:筛选和培养生长速度快、能够耐受高浓度CO2、SOx、NOx等污染物的藻种;高效光生物反应器的研发;微藻固碳产物的利用。
2.1 藻种的筛选培养以及烟气中污染物的影响
当CO2的浓度高于 5%时,大多数微藻的生长将受到抑制[5-6],而工业排放的气体中的CO2浓度一般为 10%~20%,并同时含有对微藻有毒害作用的物质,例如 SOx、NOx等。因此,用于直接固定工业排放的气体中的CO2的微藻除了要求对CO2的转化率高、生长速率快、耐受pH范围宽之外,还要能够耐受高CO2浓度和耐受SOx、NOx等有害物质。
Sakai等[7]分离筛选出了可耐受高浓度 CO2和高温的藻种Chlorella H-84和A-2,当CO2浓度不超过40%时对这两种藻的生长影响很小,同时这两种藻能够耐受42 ℃的高温,当温度达到45 ℃时则无法生长,在20% CO2和40 ℃的条件下其生长率达到最大值。Sung等[8]分离得到了一种可耐受高浓度 CO2并且环境适应性强的藻种 Chlorella sp. KR-1,在CO2浓度为10%时此藻种的生长率达到最大,其藻干重最大日增长量达到1.15 g/(L·d),培养6 d后藻液浓度可达到5.7 g/L,当CO2浓度提高至30%~50%时藻细胞浓度仍能达到较高的水平,当CO2浓度提高至70%时,培养6 d后藻液浓度只能达到0.71 g/L。当pH值在4以上变化时Chlorella sp. KR-1的生长几乎不受影响,当pH为3.5时则其生长被完全抑制;当温度在 25 ℃~35 ℃之间时,Chlorella sp. KR-1的生长状况最好,当温度达到40 ℃时其生长受到轻微的抑制。de Morais等[9]从热电厂的废物处理池中分离出了Scenedesmus obliquus和Chorella kessleri,在工作容积为1.8 L的光生物反应器中进行通气培养,在光照期每小时供气15 min,流量为0.54 L/min,并测定了它们在不同CO2浓度下的生长特性。Scenedesmus obliquus在CO2浓度为6%时生比长率为0.261 d−1,高于通空气培养时的比生长率 0.216 d−1,在 CO2浓度为 12%和 18%时Scenedesmus obliquus的生长率和在CO2浓度为6%时无明显差别。Chorella kessleri在CO2浓度为6%和12%时的比生长率达到0.267 d−1,为最大值,当CO2浓度达到18%时其比生长率降至0.199 d−1,但仍生长得较好。Hanaga等[10]的研究表明Scenedesmus和 Chorella可以在 CO2浓度高于 50%的条件下生长。de Morais等[11]在对Spirulina sp.的研究中采用3个工作容积为1.8 L的光生物反应器串联通气,每个反应器底部都设有鼓泡装置,光照期每2 h供气15 min,流量为 0.3 vvm (Volume gas per volume media per min),发现其在CO2浓度为6%时比生长率达到最大值 0.44 d−1,在 CO2浓度增至12%时仍能快速生长,比生长率可达0.33 d−1。这些藻种均可适应工业排放气体中所含有的高浓度 CO2。本实验室对Chorella sp.在燃烧烟气CO2浓度条件下进行驯化培养,并把驯化后的藻种用于不同烟气特性条件包括不同流量和不同浓度条件下的测定实验,实验采用工作容积为1 L的光生物反应器,在光照期通过反应器底部的鼓泡装置连续供气。结果发现,在CO2浓度为10%时Chorella sp.的最大比生长率可达0.6 d−1,高于CO2浓度为15%和20%时。对藻液的供气量同样会影响微藻的生长,当通入流量为100 mL/min的含有15% CO2的气体时,在7 d的培养后Chorella sp. 的浓度增长了13.8倍;当气体流量为200 mL/min和300 mL/min时,Chorella sp.的浓度增长倍数分别降低了28%和55%。结果表明,除了CO2浓度之外,气体流量对微藻的生长和固碳性能也有着重要的影响。由于生物固定的机制是光合作用,因此固碳效率受其制约影响,通常状况下不会变成CO2的零排放。一般而言,微藻对烟气中CO2的固碳效率与藻种、培养方式、生物条件和烟气条件有关,尤其与CO2浓度密切相关。例如,Chen等[32]培养的Chlorella vulgaris 对0.15%的CO2的脱除率可达到 55.3%。de Morais等[11]筛选获得的Spirulina sp.和Scenedesmus对12%的CO2的脱除率分别只有7%~17%和4%~9%。Chiu等[12]对其培育的对 CO2具有较高脱除率的 Chlorella sp.的研究表明,Chlorella sp.对CO2的脱除率随着CO2浓度的升高而降低,在CO2浓度分别为2%、5%、10%和15%时Chlorella sp.对CO2的脱除率分别为58%、27%、20%和16%。表明低浓度CO2在很大程度上有利于固碳效率的提高。
SOx和NOx是除了高CO2浓度之外抑制藻生长的重要因素。经过脱硫、脱硝处理后,工业排放的烟气中的SOx和NOx通常仍在0.02%以上,而大多数能够耐受高浓度CO2的的藻种仅仅能够在SOx和NOx的含量为0.005%的条件下生长。因此,为了能够直接利用微藻固定烟气中的CO2,国内外对在SOx和NOx影响下微藻的生长情况和固碳效果做了大量研究[13-16]。Maeda等[17]分离出了一种可耐受高浓度CO2的藻种Chlorella sp. T-1,当CO2浓度在50%以下变化时对该藻的生长无明显的影响,当CO2浓度为15%且气体中含有0.002% SOx和0.006% NOx时该藻的生长和气体中不含SOx和NOx时无明显差别。当气体中SOx和NOx的含量分别增加至0.008%和0.024%时,Chlorella sp. T-1无法生长,同时pH值下降至3.0以下;当添加CaCO3以阻止pH下降时则Chlorella sp. T-1可正常生长。Matsumoto[18]的研究指出,SOx本身并不会抑制微藻的生长,但随着SOx浓度的升高所带来的培养液的 pH值降低会降低微藻的生长率。Lee等[19]对分离出的藻种Chlorella sp. KR-1在SOx和NOx的影响下的培养特性进行了研究,当CO2浓度为15%且含有0.006% SO2时Chlorella sp. KR-1的生长率为1.24 g/(L·d),比不含SO2时的1.66 g/(L·d) 减少了约25%,随着SO2含量的增加藻细胞的密度有明显下降,当SO2为0.01%时Chlorella sp. KR-1的生长率为0.78 g/(L·d),当SO2的浓度升高至0.015%时Chlorella sp. KR-1的生长完全被抑制;在 CO2浓度为 15%且含有0.01% NO时Chlorella sp. KR-1的生长情况和不含NO时无明显差别,当 NO的浓度增至 0.03%时则Chlorella sp. KR-1无法生长。但是通过对pH的控制可以提高Chlorella sp. KR-1对SOx和NOx的耐受能力,可在气体中含有0.025% SO2和0.03% NO的条件下表现出良好的生长状况。岳丽宏等[20]在对其分离获得的Chorella sp. ZY-1在SOx和NOx的影响的生长特性的研究中得到了与 Lee相符的结论。本实验室对Chorella sp.在SOx和NOx的影响下的生长和固碳性能进行了研究。结果表明,经过驯化的Chorella sp.可在气体中含有 0.01% SOx和 0.05% NOx的条件下生长;当控制藻液的pH恒定为5.5时,Chorella sp.表现出对SOx更好的耐受性。在进一步研究 Hg+对 Chorella sp.的生长的影响中发现,Hg+的存在对Chorella sp.具有明显的抑制作用,但随着Hg+浓度的增加抑制作用增长缓慢。Chorella sp.的生长虽然会受到燃烧烟气中污染物的抑制,但仍然对污染物有较强的耐受性,可以用于固定烟气中的CO2,对其用于固定真实烟气中的CO2的生长和固碳性能有待于进一步的研究。表1列出了部分适合直接用于固定烟气中CO2的藻种。
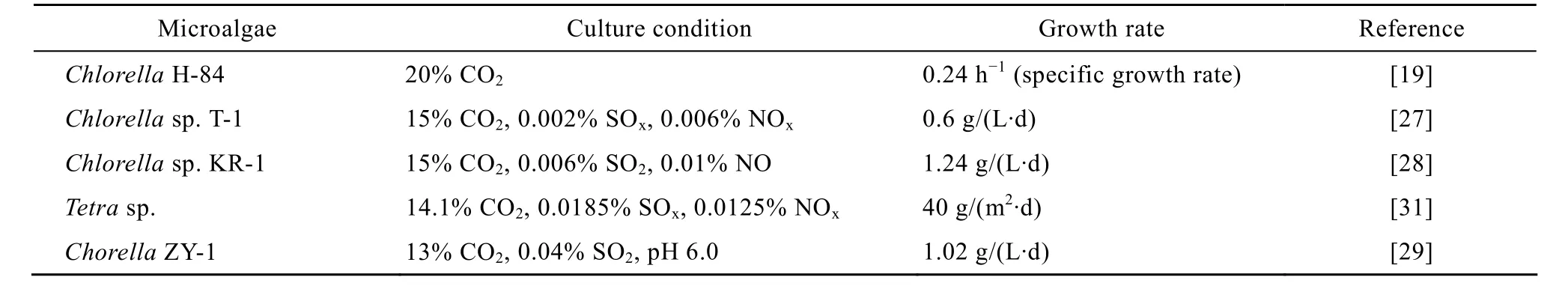
表1 部分可用于固碳的藻种列表Table 1 Several strains of microalgae for flue gas CO2 fixation and theirs growth characteristics
针对燃烧烟气而言,培养和选择耐受高浓度CO2及烟气中 SOx、NOx等污染物的微藻藻种是实现高效固碳的途径之一。此外,也可采用对烟气进行稀释的途径进行微藻固碳。这样可同时降低 CO2浓度 (一般降低至2%左右) 和污染物的浓度,从而有效降低高浓度CO2和污染物对微藻固碳的胁迫作用以提高其固碳性能。但是这种方法需要附加对烟气的检测、稀释和控制系统。因此,选择能够耐受高浓度CO2、SOx和NOx的微藻则可以直接把烟道气用于微藻的培养,可以简化系统、降低造价,具有较好的经济性。
对于利用微藻直接固定真实烟气中CO2的研究也已经取得一定成果[19-26]。Matsumoto等[18]的研究发现藻种Tetra sp.可以被用于固定电站锅炉的烟气,烟气中含有14.1% CO2、1.3% O2、0.0185% SOx、0.0125% NOx。用跑道式反应器对Tetra sp.进行培养,在5−9月期间Tetra sp.的最大生长率为40 g/(m2·d)。Lee等[19]用锅炉烟气对其分离获得的 Chlorella sp. KR-1进行了生长特性试验,燃用天然气的锅炉的烟气含有的 NO低于 0.01%,并且不含 SOx,可用Chlorella sp. KR-1固定烟气中的CO2,其固碳效率和在CO2浓度为10%时相当;用燃用重油的锅炉的烟气进行实验时,因为烟气中含有0.008%的SOx,所以其固碳效率下降了60%;通过提高初始接种密度可提高微藻耐受污染物的能力,当接种密度为0.3 g/L时Chlorella sp. KR-1可在含有0.01% SO2和 0.03% NO的烟气中表现出良好的生长状况。Yoo 等[26]分离出了耐受高浓度 CO2的藻种Scenedesmus sp.和Chlorella vulgaris,在10% CO2时其生长率分别为218 mg/(L·d) 和105 mg/(L·d),在实际烟气条件下其生长率分别为203 mg/(L·d) 和77 mg/(L·d),这两种藻均可较好的适应烟气条件。
不同藻种在相同的培养条件下会表现出不同的生长和固碳特性,这与藻种本身的生物特性有关;同一种藻经过不同的驯化培养后也会表现出不同的生长和固碳特性,这可能与烟气条件下对微藻的诱导变异有关。一些藻种可以很好的适应烟气条件,但关于如何进一步提高其生长率和进行大规模的应用还需要进一步研究。
2.2 高效光生物反应器的开发
虽然在藻种的选育取得了显著的成果,但是要使选育得到的优良藻种在实际应用过程中获得高效的 CO2固定效果,合理的设计光生物反应器是必不可少的。高效光生物反应器是实现微藻高效固定 CO2的重要手段,高效光生物反应器的研究和开发一直是微藻培养和微藻固定 CO2技术的研究热点[27-33]。
高效光生物反应器的开发可分为 2个主要方面:提高光合利用效率;提高CO2在培养液中的汽液传递效率。
提高光合利用效率可从提高光生物反应器的比表面积、和光源设计两方面进行。开放式光生物反应器 (循环池、跑道池等) 和密闭式光生物反应器(主要分为管式、板式和锥式) 相比具有较大的比表面积,也较经济,但容易受到环境影响和污染,且由于 CO2利用率不高而无法实现微藻的高密度培养。Zhang等[29]设计了一种具有较大比表面积的密闭式光生物反应器:板式光生物反应器,该反应器的单板体积为200 L,长200 cm,宽10 cm,高100 cm,气体由均匀分布在反应器底部的直径为1 mm的小孔进入,该反应器实现了对微藻Nannochloropsis sp.的高密度规模化连续培养,最大面积产率为 12 g/(m2·d)。通过光源的优化设计也可以提高光合利用效率。光源的设计不仅要考虑高效光源的选择,还要考虑光源的设置方式,即光线在反应器内的有效分布。太阳光和普通的荧光灯是最常用的光源,也有些光生物反应器选用发光二极管、光导纤维等作为光源。Hiratadeng等[30]设计了带有太阳光收集装置的光生物反应器,利用Chlorella sp.固定CO2获得了很好的效果,充分利用了太阳能,避免了额外的能量消耗。Arnaud Muller−Feuga等[31]设计了一种环形管式光生物反应器,它由 8根环绕着光源的平行管组成,总容积为10 L,受光面积为1.5 m2,用该光生物反应器培养Porphyldium cruentum取得了很好的效果。
提高光生物反应器内CO2在培养液中的汽液传质效率同样有利于微藻在光生物反应器内的生长。常见的具有较高的气液传质效率的光生物反应器可分为鼓泡式、气升式、中空膜式等。鼓泡式光生物反应器可有效提高 CO2在培养液中的汽液传质效率,投资较少,是目前用于大规模密闭式光生物反应器培养微藻投资最低的反应器[32];但鼓泡产生的湍流使得藻液的剪切力增大,容易损伤藻细胞,不适合用于培养无细胞壁的微藻。康瑞娟等[33]构建了一种气升式内环流光生物反应器,在反应器罐体的内部加装气体提升管,提升管底部设有圆形气体分布器,空气和CO2混合后由气体分布器进入反应器,形成均匀、细小的气泡,具有较高的汽液接触面积,可有效提高CO2与藻液汽液传质效率。程丽华等[34]采用在光生物反应器旁串接中空纤维膜组件的方法改善供气效果,不仅使气泡更加细密均一,而且使气泡在藻液中的停留时间从原来的2 s提高到20 s,使得微藻固定CO2的效率提高了5倍。虽然中空纤维膜组件可以提高CO2与藻液的传质效率,但是在使用过程中容易受到污染从而使中空纤维膜的传质系数值降低[35],且中空纤维膜的成本较高,适合用于培养具有高附加值的微藻。光生物反应器的选择应根据应用的场合确定。
2.3 微藻固碳产物的综合利用
微藻固定CO2过程中产生的藻体含有大量有用的物质,对藻体的有效利用可以带来经济效益,有效降低微藻固定CO2的成本。
微藻可作为人类的食物,并且其中的一些成分有利于人类的健康。传统的人类营养供给来自于动植物,并且在市场中占支配地位。在最近三四十年对于有益于人体健康的水生微生物 (例如微藻)的研究的投入不断加大,并且越来越多的得到了认可[36]。微藻的蛋白质含量多于蔬菜少于肉类,比较适中。对Spirulina和Chlorella sp.组成成分和生物活性进行了大量研究,结果表明这两种藻适合食用[37]。Spirulina是人类最经常消费的微藻之一,Spirulina主要用于健康食品的生产,因为其有助于提高人体的免疫力,有助于阻止病毒感染和癌症[36]。含有丰富类胡萝卜素的 Muriellopsis常用于防止和治疗退化性疾病[38]。利用微藻生产具有高附加值的健康食品或药物可以获得可观的经济效益。微藻也可以用于生产动物饲料或添加剂。Chae等[39]在光生物反应器中利用微藻 Euglena gracilis固定烟道气中的CO2,同时生产高蛋白易消化的动物饲料,获得了较好的效果。Lee等[40]成功的利用固定天然气的烟气所产生的微藻作为动物饲料的添加剂,并且没有在添加剂中发现有害物质。
微藻还可用于制取生物燃料。Frenz等[41]通过萃取的方法从微藻 B. braunii中获得了可作为柴油的替代燃料的氢气。缪晓玲等[42]利用正己烷从Chlorella sp.中提取获得了大量油脂,这些油脂在30 ℃、醇油物质的量比为56∶1以及浓硫酸催化的条件下经酯交换反应4 h可生成高质量的生物柴油。所获得的微藻生物柴油的密度为 0.864 kg/L、粘度5.2×10−4(40 ℃)。热值高达41 MJ/kg,这些特征与传统柴油相当,具有很好的应用前景。Sawayama等[43]的研究也证明了利用微藻制取生物柴油技术上的可行性,但过高的经济成本使得微藻制取生物柴油技术无法得到大规模应用。微藻生物柴油是唯一能满足全球需求的可再生的生物柴油,具有热值高、生长速率快、可实现碳的循环利用等诸多优点,有可能取代来自石油液体燃料,但目前生产微藻生物柴油的主要存在的成本问题必须大幅改善,才能产生经济效益。
3 结论与展望
本文从耐受高浓度CO2和污染物的藻种选育、高效光生物反应器的开发和微藻固碳产物的利用方面对微藻固定CO2的进行了回顾和总结。国内外对微藻固定 CO2技术进行了广泛的研究,并取得了一定的进展,但是对于微藻固定CO2的实际应用仍存在很多问题。例如,为了实现高CO2固定率,微藻的生长率必须得到进一步的提高;为了使此技术经济可行,必须降低其成本。如果能将微藻固定 CO2技术和微藻制取生物柴油或高附加值产品相结合,例如所培养的微藻既能高效的固定 CO2,同时藻细胞内的有用物质又可以较容易地富集和获得,则可以有效降低其成本,为解决气候、环境、能源等问题提供一种全新的方案。
REFERENCES
[1] Florides GA, Christodoulides P. Global warming and carbon dioxide through sciences. Environ Int, 2009, 35(2): 390−401.
[2] IPCC. Climate Change 2007: Synthesis Report. Geneva, Switzerland, IPCC, 2007.
[3] Usui N, Ikenouchi M. The biological CO2fixation and utilization project by RITE(1)−highly-effective photobioreactor system −. Energy Convers Manage, 1997, 38(1): S487−S492.
[4] Murakami M, Ikenouchi M. The biological CO2fixation and utilization project by rite (2)−screening and breeding of microalgae with high capability in fixing CO2−. Energy Convers Manage, 1997, 38(1): S493−S497.
[5] Silva HJ, Pirt SJ. Carbon dioxide inhibition of photosynthetic growth of Chlorella. J Gen Microbiol, 1984, 130: 2833−2838.
[6] Lee YK, Tay HS. High CO2partial pressure depresses productivity and bioenergenetic growth yield of Chlorella pyrenoidosa culture. J Apple Phycol, 1991, 3(2): 95−101.
[7] Sakai N, Sakamoto Y, Kishimoto N, et al. Chlorella strains from hot springs tolerant to high temperature and high CO2. Energy Convers Manage, 1995, 36(6/9): 693−696.
[8] Sung KD, Lee JS, Shin CS, et al. CO2fixation by Chlorella sp. KR-1 and its cultural characteristics. Bioresour Technol, 1999, 68(3): 269−273.
[9] de Morais MG, Costa JA. Isolation and selection of microalgae from coal fired thermoelectric power plant for biofixation of carbon dioxide. Energy Convers Manage, 2007, 48(7): 2169−2173.
[10] Hanagata N, Takeuchi T, Fukuju Y, et al. Tolerance of microalgae to high CO2and high temperature. Int J Plant Biochem, 1992, 31(10): 3345−3348.
[11] de Morais MG, Costa JA. Biofixation of carbon dioxide by Spirulina sp. and Scenedesmus obliquus cultivated in a three-stage serial tubular photobioreactor. J Biotechnol, 2007, 129(3): 439−445.
[12] Chiu SY, Kao CY, Chen CH, et al. Reduction of CO2by a high-density culture of Chlorella sp. in a semicontinuous photobioreactor. Bioresour Technol, 2008, 99(9): 3389−3396.
[13] Hauck JT, olson GJ, Scierka SJ, et al. Effect of simulated flue gas on growth of microalgae. Proceeding of 212thACS National Meeting, 1996, 8: 25−30.
[14] Kurano N, Ikemoto H, Miyashita H, et al. Fixation and utilization of carbon dioxide by microalgal photosynthesis. Energy Convers Manage, 1995, 36(6/9): 698−692.
[15] Lee JN, Lee JS, Shin CS, et al. Methods to enhance tolerances of Chlorella KR-1 to toxic compounds in flue gas. Appl Biochem Biotechnol, 2000, 84/86(1/9): 329−342.
[16] Matsumoto H, Hamasakia A, Sioji N, et al. Influence of CO2, SO2and NO in flue gas on microalgae productivity. J Chem Eng Jpn, 1997, 30(4): 620−624.
[17] Maedal K, Owadai M, Kimura N, et al. CO2fixation from the flue gas on coal-fired thermal power plant by microalgae. Energy Convers Manage, 1995, 36(6/9): 717−720.
[18] Negoro M, Ikuta Y, Hamasaki A, et al. Carbon dioxide fixation by microalgae photosynthesis using actual flue gas discharged from a boiler. Appl Biochem Biotechnol, 1995, 39/40(1): 643−653.
[19] Lee JS, Kim DK, Lee JP, et al. Effects of SO2and NO on growth of Chlorella sp. KR-1. Bioresour Technol, 2002, 82(1): 1−4.
[20] Yue LH, Chen WG, Li JG, et al. Chrollera ZY-1 cultivation and its CO2fixation in the environmental condition of flue gases. J Qingdao Technol Univer, 2005, 26(6): 15−9.岳丽宏, 陈为公, 李建国, 等. 烟气环境条件下小球藻的生长及其CO2固定. 青岛理工大学学报, 2005, 26(6): 15−19.
[21] Lee JS, Lee KW, Chio MJ, et al. A highly CO2and SOx tolerant microalgae and its utilization for CO2fixation. Jpn Patent, 2000, 23: 45−50.
[22] Brown LM. Uptake of carbon dioxide from flue gas by microalgae. Energy Convers Manage, 1996, 37(6/8): 1363−1367.
[23] Borowitzka MA. Large-scale algal culture systems: the next generation. Austral Biotechnol, 1994, 4(4): 212−215.
[24] Doucha J, Straka F, Livansky K. Utilization of flue gas for cultivation of microalgae (Chlorella sp.) in an outdoor open thin-layer photobioreactor. J Appl Phycol, 2005, 17(5): 403−412.
[25] Negoro M, Hamsaki A, Ikuta Y, et al. Carbon dioxide fixation by microalgae photosynthesis using actual flue gas discharged from a boiler. Appl Biochem Biotechnol, 1993, 39/40(1): 643−653.
[26] Yoo C, Jun SY, Lee JY, et al. Selection of microalgae for lipid production under high levels carbon dioxide. Bioresour Technol, 2010, 101(1): S71−S74.
[27] Lee YK. Microalgal mass culture systems and methods: their limitation and potential. J Appl Phycol, 2001, 13(4): 307−315.
[28] Pulz O. Photobioreactors: production systems for phototrophic microorganisms. Appl Microbiol Biotechnol, 2001, 57(3): 287−293.
[29] Zhang CW, Zmora O, Kopel R, et al. An industrial-size flat plate glass reactor for mass production of Nannochloropsis sp. (Eustigmatophyceae). Aquaculture, 2001, 195(1/2): 35−49.
[30] Hirata S, Hayashitani M, Taya M, et al. Carbon dioxide fixation in batch culture of Chlorella sp. using a photobioreactor with a sunlight-collection device. J Ferment Bioeng, 1996, 81(5): 470−472.
[31] Amaud-Feuga A, Guédes RL, Pruvost J. Benefits and limitations of modeling for optimization of Porphyridium cruentum cultures in an annular photobioreactor. J Biotechnol, 2003, 103(2): 153−163.
[32] Liu JN, Hu P, Yao L, et al. Advance of photobioteactor on microalgal cultivation. Food Sci, 2006, 27(12): 772−777.
[33] Kang RJ, Cai ZL, Shi DJ. An airlift photobioreactor for microalgae cultivation. Chem React Eng Technol, 2001, 17(1): 153−58.康瑞娟, 蔡昭铃, 施定基. 用于微藻培养的气升式光生物反应器. 化学分应工程与工艺, 2001, 17(1): 153−158.
[34] Cheng LH, Zhang L, Chen HL et al. Carbon dioxide removal from air by microalgae cultured in a membrane-photobioreactor. Sep Purif Technol, 2006, 50(3): 324−329.
[35] Yue LH, Chen BZ, Hu XM, et al. Study on CO2fixation effect of Chlorella ZY-1 when culture was supplied in CO2by the microporous hollow fibre membrane module. J Northeastern Univ: Nat Sci, 2002, 23(9): 487−490.岳丽红, 陈宝智, 胡莜敏, 等. 中空纤维膜供气小球藻固定 CO2的效果研究. 东北大学学报: 自然科学版, 2002, 23(9): 487−490.
[36] Barrow C, Shahidi F. Marine nutraceuticals and functional foods. Seattle: CRC Press, 2008.
[37] Pulz O, Gross W. Valuable products from biotechnology of microalgae. Appl Microbiol Biotechnol, 2004, 65(6): 635−648.
[38] Del Campo JA, García-González M, Guerrero MG. Outdoor cultivation of microalgae for carotenoid production: current state and perspectives. Appl Microbiol Biotechnol, 2007, 74(6): 1163−1174.
[39] Chae SR, Hwang EJ, Shin HS. Single cell protein production of Euglena gracilis and carbon dioxide fixation in an innovative photobioreactor. Bioresour Technol, 2006, 97(2): 322−329.
[40] Lee JS, Kim DK, Lee JP, et al. CO2fixation by Chlorella KR-1 using flue gas and its utilization as a feedstuff for chicks. J Microbiol Biotechnol, 2001, 11: 772−775.
[41] Frenz J, Largeau C, Casadevall E, et al. Hydrocarbon recovery and biocompatibility of solvents for extraction from cultures of Botryococcus braunii. Biotechnol Bioeng, 1989, 34(6): 755−762.
[42] Miao XL, Wu QY. Biodiesel production from heterotrophic microalgal oil. Bioresour Technol, 2006, 97(6): 841−846.
[43] Sawayama S, Inoue S, Dote Y, et al. CO2fixation and oil production through microalga. Energy Convers Manage, 1995, 36(6/9): 729−731.
