构建生物传感器的新材料
——纳米氧化锌
吕法煜,李德有
(焦作市技师学院,河南焦作 454002)
1 引言
生物传感器研究起源于20世纪的60年代,1967年 Updike等[1]把葡萄糖氧化酶 (GOD)固定化膜和氧电极组装在一起,制成了第一种生物传感器,即葡萄糖酶电极。此后,随着生物、化学、物理学、医学、电子技术等的迅速发展,各种类型的生物传感器相继出现;到80年代,生物传感器已成为电化学分析和生物技术研究最为活跃的领域之一。
生物传感器研究经历了三个阶段,第一代传感器以酶的天然介体——氧来作为酶与电极之间的电子通道,直接检测酶反应底物的减少或产物的生成。这类传感器的检测结果受到很多因素的影响,如氧分压、氧溶解浓度、H2O2的过电位过高等。
70年代以后,人们开始用小分子的电子媒介体来代替氧沟通酶活性中心与电极之间的电子通道,通过检测媒介体的电流变化来反映底物浓度的变化,这种传感器被称为第二代生物传感器。常用的电子媒介体有铁氰化钾/亚铁氰化钾、二茂铁及其衍生物、染料分子、Ru、Os的化合物、金属酞菁等。
第二代传感器与第一代传感器相比具有许多优点,但酶与电极间还不能直接进行电子转移。直接电子转移才是生物传感器的发展目标,因为酶与电极之间的直接电子转移与氧和其他电子受体无关,无外加毒性物质。这种利用自身与电极间的直接电子转移来完成信号转换的生物传感器被称为第三代生物传感器。Koopal[2]的一系列工作为这种传感器奠定了一定的基础,他们采用独特的方式将GOD固定在聚吡咯中。许多基于过氧化物酶直接电化学的检测过氧化氢和有机过氧化物的第三代生物传感器相继被制备出来[3-4]。
目前,基于纳米材料的第三代生物传感器己成为一个研究亮点。纳米材料量子尺寸效应和表面效应,可把传感器的性能提高到新水平,使其不仅体积小,而且速度快、精度高、可靠性好,还能实现多功能化和选择性检测。
ZnO是一种ⅡB-ⅥA族直接宽带隙(带隙3.37 eV)半导体材料,由于其具有奇特的光学和电学方面的性能,近年来得到了广泛的研究,如在光电器件[5]、电子器件[6]、化学传感器[7]、太阳能电池等方面的应用[8]。纳米尺度的ZnO具有较好的电子传导能力,具有高等电点(IEP=9.5),与蛋白质或者生物细胞等生物材料有极好的兼容性,安全无毒,很适合用来吸附低等电点的蛋白质,这些优点是其他纳米材料所无法比拟的,完全符合构建生物传感器对载体材料的特殊要求。因此纳米结构 ZnO的优良特性与传感器制备技术的结合,不仅拓宽了纳米半导体材料的应用领域,也促进了生物传感器技术的发展。
2 纳米结构氧化锌合成方法的多样性
在合成ZnO纳米材料方面,已有大量的研究。目前合成ZnO一维纳米材料的方法很多,包括气相传输法[9]、金属有机气相外延生长[10]、水热合成法[11]和电化学沉积法[12]。其中气相传输法和水热法是两种广泛使用的方法,气相传输法在不同条件下可合成多种形貌的纳米结构氧化锌,而水热法更有利于得到形貌均一的一维或零维氧化锌纳米结构。纳米氧化锌合成方法的多样性为生物传感器构建工艺提供了更广阔的选择性,将不同的合成氧化锌纳米方法与生物传感器构建方法有机结合,可有效的优化传感器的构建工艺,更好的保持生物分子的生物活性,提高生物传感器的性能。
3 纳米结构氧化锌的形貌多样性
ZnO是唯一一种表现出半导体性质、电极化性质和热电性质等多重性质的材料。它拥有非常丰富的形貌,使用不同的合成技术,可以在不同条件下合成ZnO纳米梳状结构、纳米环状结构、纳米螺旋结构、纳米弓形结构、纳米带、纳米线和纳米笼等结构[13]。这些独特的纳米结构表明ZnO在结构和特性上是所有材料中纳米结构最富有的家族之一。
多样性的氧化锌纳米结构为其在生物传感器应用方面提供了更大的灵活性,不同的形貌适合于构建不同类型和功能的传感器,选择合适的生物分子与合适形貌的氧化锌纳米结构,可以更高效地构建生物传感器,实现生物传感器的特定传感功能。
4 纳米结构氧化锌晶体结构和光学性质
通常ZnO的稳定相为六角纤锌矿结构,属6 mm点群,其晶格常数 a=0.325 nm,c=0.521 nm,c/a=1.662,比理想的六角紧密堆积的 1.633稍小。在ZnO晶格中,锌原子和氧原子占据层交错排列,其晶体结构模型如图1(a)所示[14]。
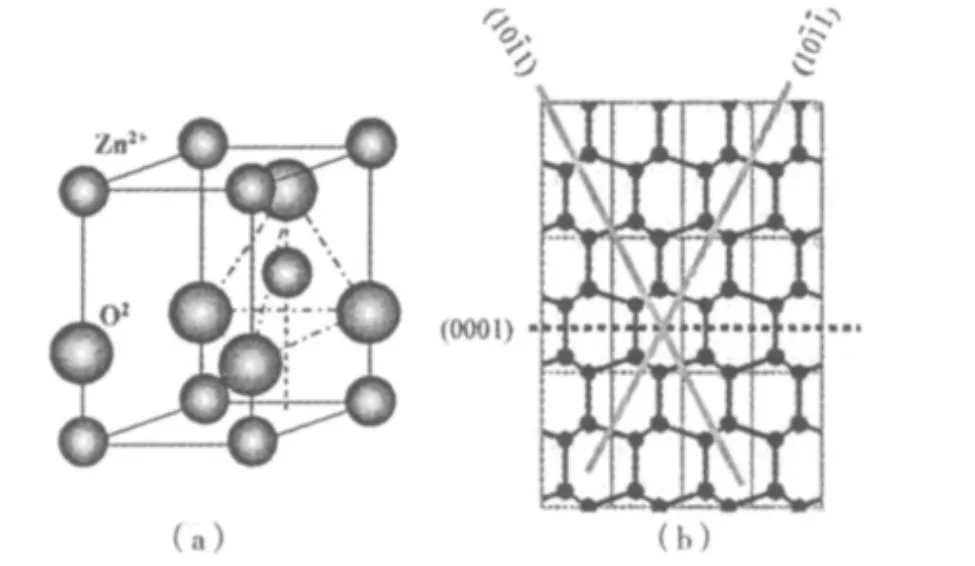
图1 ZnO晶体结构模型
纳米结构氧化锌的光致发光荧光光谱(PL)如图2所示。
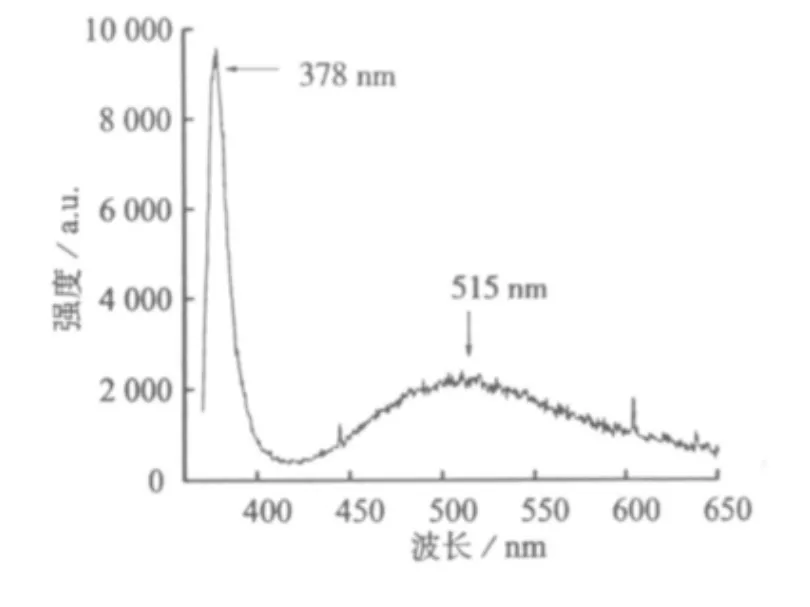
图2 气相传输法制备的氧化锌纳米棒PL谱
从图2中看出,在378 nm处ZnO有一个很强的紫外发射峰,该发射峰来自于ZnO的带边激子复合[15]。另外可以在515 nm处观察到一个稍不明显的、宽泛的可见光峰,该峰来自于电子从单离子氧缺陷态转移至价带的光激发空穴的过程[16]。
氧化锌晶体的极性结构使其具有高等电点,这使氧化锌纳米结构的表面带有较密集的正电荷,为生物分子在其表面组装提供了有利的静电电性条件。纳米结构氧化锌PL谱中,尖锐的紫外发射峰和宽泛的缺陷深能级发射峰易于探测,可方便地对氧化锌纳米结构进行荧光测定,在纳米结构氧化锌标记生物分子进行光学检测方面具有潜力。同时也为氧化锌纳米结构在生物传感器方面的应用开辟了新的途径。
5 纳米氧化锌在生物传感器上的应用研究
1980年,Esser等[17]研究了ZnO单晶表面对过氧化氢的物理吸附规律,成为ZnO生物化学传感器研究的开端。
1993年,Nanto等[18]制作了铝掺杂 ZnO薄膜的气体传感器,用于测定食物的新鲜度。由此,ZnO传感器的应用开始大规模的展开。
2001 年,Enunanuel Topoglidis 等[19]在 TiO2及ZnO膜上修饰了蛋白质并测试了修饰后的电化学特性,出现了一个还原峰,如图3所示。

图3 TiO2及ZnO膜修饰后的电化学特性
2005年,张成林等[20]制作了氧化锌纳米棒修饰的玻碳电极,并研究了在此电极上修饰蛋白质后的电化学行为。其研究表明,血红蛋白和细胞色素c能在被修饰的电极上被氧化,而且氧化电流与所分析的溶液浓度成线性关系,其检测结果如图4所示。
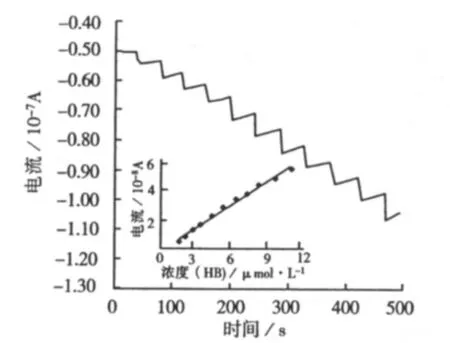
图4 玻碳电极修饰蛋白质后的电化学特性分析
2006年 Nitin Kumar等[21]用氧化锌纳米棒阵列修饰DNA,利用氧化锌的荧光性质进行DNA片断序列检测。传感器的组装和检测示意图见图5。
图5a是同时进行的纳米氧化锌的合成与条状图案化组装示意图,b中左图是组装后的纳米氧化锌条状图案的SEM照片,照片中条纹间隔约为50 μm,插图是条状图案中间的平伏的氧化锌纳米结构。右图是直接合成的条状图案的共焦显微镜照片,照片中没有荧光产生。c是检测示意图,聚二甲基硅烷(polydimethylsiloxane,PDMS)用来把生物分子在同一氧化锌阵列上同时进行特异性结合反应,寡核苷酸探针bce和bas被首先特异性地分别连接到腔体1和腔体2中,荧光素标记的basr片段被同时加到两个腔室中,在相同的条件下使DNA片段间进行特异性连接。用共焦显微镜检测可明显的看到腔室2中有荧光而腔室1中没有,左下角插图是两种腔室经过特异性反应后的日光照片。当DNA交连了bas和basr后腔室2能观察到明显的荧光,由于DNA对bce和basr的交连效果很差,所以在腔室1中几乎不能观察到荧光现象。在腔室2中观察到的荧光的条纹图案与纳米氧化锌构建的条纹图案几何形状完全相同。

图5 传感器组装和检测示意图
同年,Wei[22]报道了基于GOD固定在氧化锌纳米棒阵列上的葡萄糖传感器。施加电压0.8 V(vs Ag/AgCl),传感器表现出很高的灵敏度和重现性,线性范围0.01~0.345 mmol/L,CV曲线如图6。

图6 葡萄糖传感器CV曲线
2008年,Chen L Y 等[23]研制了一种不要中间介体的生物传感器,低等点的酪氨酸酶通过静电作用吸附在高等电点的氧化锌纳米棒上,再通过由Nafion形成的膜固定在玻炭电极上,并且固定的酪氨酸酶很大程度上保持了生物活性,如图7,CV曲线显示固定在纳米氧化锌棒上的酪氨酸酶对苯酚有良好的催化活性。

图7 不要中间介体的生物传感器CV曲线
2009年,徐春祥等[24]制备了金丝电极原位生长的氧化锌纳米棒,并多层修饰辣根过氧化物酶。辣根过氧化物酶在电极上直接进行电子传递,并显示出对过氧化氢具有良好的催化活性,不同层数辣根过氧化物酶对过氧化氢的催化性能如图8的I-t曲线。

图8 不同层数辣根过氧化物酶对过氧化氢的催化性能曲线
6 展望
纳米结构氧化锌在制备方法、结构、形貌、性质等方面具有独特的优点,多种工艺条件的合成方法为生物传感器构建工艺提供了更广阔的选择性;极其丰富的形貌为其在生物传感器应用方面提供了更大的灵活性;极性的结构为生物分子在纳米结构氧化锌表面的组装提供了方便可靠的途径;典型且易于探测的光谱学性质为纳米结构氧化锌作为生物分子标记物提供了方便易得的检测方法。因此,纳米氧化锌电化学生物传感器将是极有前途的生物传感器。
[1]Updike S J,Hicks G P.The enzyme electrode [J].Nature,1967,214(6):986-988.
[2]Koo G J,Fetiers M C,Noetl R J.Glucose sensor utilizing polypyrrole incorporated in tract-etch membranes as the mediator[J].Biosen Bioelectron,1992,7:461-471.
[3]Wollenbegrer U,Wang J,Oszoz M,et al.Bulk modified enzyme electrodes for reagentless detection of peroxides[J].Bioelectrochem Bioenerg,1991,26:287-296.
[4]Jonsson G,Gorton L.An electrochemical sensor for hydrogen peroxide based on peroxidase adsorbed on a spectrographic graphite electrode[J].Elecrtoanalysis,1989,1:465-468.
[5]Aoki T,Hatanaka Y,Look D C.ZnO diode fabricated by exciter-laser doping[J].Appl Phys Lett,2000,76:3257.
[6]Xu C X,Sun X W.Field emission from zinc oxide nanopins[J].Appl Phys Lett,2003,83:3806.
[7]Dayan N J,Sainkar S R,Karekar R N,et al.Formulation and characterization of ZnO:Sb thick-film gas sensors[J].Thin Solid Films,1998,325:254.
[8]Wang P,Wang L D,Li B,et al.Improved voltage and fill factor by using zinc oxide thin film as a barrier layer in dye-sensitized solar cells[J].Chin Phys Lett,2005,22:2708.
[9]Xu C X,Sun X W,Chen B J,et al.Aligned ZnO nanofibre array prepared by vapor transport in air[J].Chin Phys Lett,2003,20:1319.
[10]Li J Y,Chen X L,Wei Z F,et al.Morphologies of ZnO Nanorods[J].Chin Phys Lett,2001,18:1527.
[11]Wen J G,Lao J Y,Wang D Z,et al.Self-assembly of semiconducting oxide nanowires,nanorods,and nanoribbons[J].Chem Phys Lett,2003,372:717.
[12]Zheng M J,Zhang L D,Li G H,et al.Fabrication and optical properties of large-scale uniform zinc oxide nanowire arrays by one-step electrochemical deposition technique[J].Chem Phys Lett,2002,363:123.
[13]Wang Z L.Nanostructures of zinc oxide[J].Material Today,2004.
[14]Wang Z L.ZnO nanowire and nanobelt platform for nanotechnology[J].Mater Sci Eng R,2009,64:33-71.
[15]M Haupt,A Ladenburger,R Sauer,et al.Ultravioletemitting ZnO nanowhiskers prepared by a vapor transport process on prestructured surfaces with self-assembled polymers[J].J Appl Phys,2003,93:6252-6257.
[16]K.Vanheusden,W L Warren,C H Seager,et al.Mechanisms behind green photoluminescence in ZnO phosphor powders[J].J Appl Phys,1996,79:7983-7990.
[17]Esser P W,Gopel.Physical adsorption on single crystal zinc oxide[J].Surface Sci,1980,97:309-318.
[18]Nanto H,Sokooshi H,Usuda T.Smell sensor using aluminium-doped zinc oxide thin film prepared by sputtering technique[J].Sens Actuators B,1993,10:79-83.
[19]Topoglidis E,Cass A E G,O'Regan B,et al.Immobilisation and bioelectrochemistry of proteins on nanoporous TiO2 and ZnO films[J].J Electroanal Chem,2001,517(1-2):20-27.
[20]Zhang C L,Liu M C,Li P,et al.Fabrication of ZnO nanorod modified electrode and its application to the direct electrochemical determination of hemoglobin and cytochrome[J].Chin J Chem,2005,23:144-148.
[21]Kumar N,Dorfman A,Hahm J.Ultrasensitive DNA sequence detection using nanoscale ZnO sensor arrays[J].Nanotechnology,2006,17:2875-2881.
[22]Wei A,Sun X W,Wang J X,et al.Enzymatic glucose biosensor based on ZnO nanorod array grown by hydrothermal decomposition[J].Appl Phys Lett,2006,89:123902.
[23]Chen L Y,Gu B X,Zhu G P,et al.Electron transfer properties and electrocatalytic behavior of tyrosinase on ZnO nanorod[J].J Electroanal Chem,2008,617:7-13.
[24]Gu B X,Xu C X,Zhu G P,et al.Layer by layer immobilized horseradish peroxidase on zinc oxide nanorods for biosensing[J].J Phys Chem B,2009,113:6553-6557.

