Fe3O4@SiO2的表面改性
王 勃,王红霞
(哈尔滨师范大学 功能材料的设计合成与绿色催化黑龙江省高校重点实验室,黑龙江 哈尔滨 150025)
在催化方面,以磁性材料作为催化剂载体,可以有效的帮助解决催化剂分离难的问题[1];在生物医疗领域,其在磁靶向制剂、固定化酶、磁流体热疗等方面具有广泛的应用[2,3]。当磁性材料用于这些相关领域时,常常要求其粒子表面和生物物质之间有良好的“铆接”性能,所以需要对之进行表面改性以得到羧基、氨基、乙二醇基、羟基等功能基团[4]。已有的研究表明,通过改性,可以使Fe3O4@SiO2表面产生更多的生物基团,如在丙酮的气氛中对Fe3O4@SiO2进行加热,利用丙酮分子和水分子在SiO2表面进行反复的吸附解析作用,使粒子表面产生更多的Si-OH[5],通过微波照射和空气等离子处理对多孔SiO2表面进行激活,再将激活了的SiO2表面进行水合,可以产生更多的Si-OH[6]。本实验室最近通过回流活化的方法[7],对Fe3O4@SiO2进行处理,发现表面的Si-OH含量增加促进了纳米TiO2的负载量,但对引起表面Si-OH含量变化的因素没有做进一步的考察。因此,本实验采取三因素三水平的正交试验方法,以Fe3O4@SiO2表面的Si-OH含量为考察指标,以X射线光电子能谱分析为测试手段,利用级差分析方法分析各因素对表面Si-OH含量的影响,得出调控Fe3O4@SiO2表面Si-OH含量的适宜条件。
1 实验部分
1.1 试剂和仪器
NH3·H2O(天津市天大化学试剂厂);TEOS(正硅酸乙酯,百灵威化学);无水C2H5OH(天津市凯通化学试剂有限公司);自制Fe3O4磁流体。
PHI 5700ESCA型X射线光电子能谱仪(美国物理电子公司),以Al靶Ka线为激发源,能量为1486.6eV,以样品表面来自XPS仪器本身的油污染碳C1s 284.6eV作为荷电校正标准。
1.2 样品的制备和改性
取含Fe3O4500mg的Fe3O4磁流体(约30mL),均匀分散在150mL蒸馏水中,加入适量的APS水溶液,静止40min,然后加入100mL异丙醇,用浓NH3·H2O调pH值在11以上,低速搅拌下滴加入2mL正硅酸乙酯(TEOS),反应12h后,将产物磁分,继续使用乙醇在超声中清洗后磁性移柱分离,即得到Fe3O4@SiO2粒子,最后将Fe3O4@SiO2粒子分散在乙醇中备用。
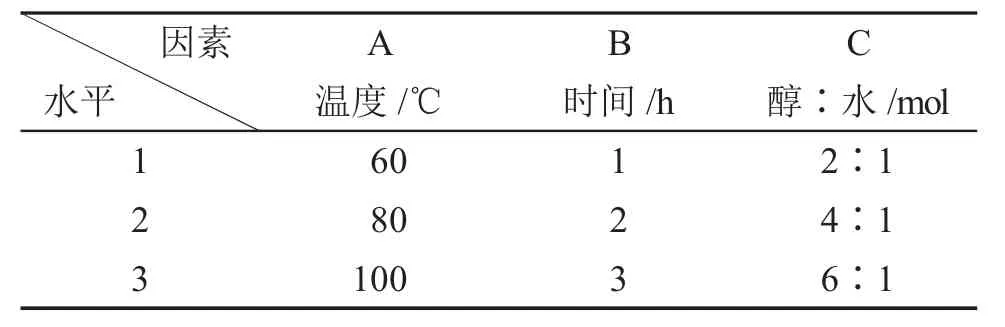
表1 L9(34)正交实验条件Tab.1 L9(34)orthogonal test cordition
1.3 正交试验
选择三个因素,即A-温度、B-时间和C-醇/水,每个因素各有3个水平,进行正交试验,具体因素、水平的实验方案见表1[8],利用正交实验L9(34)标表确定具体的实验方案,实验计划表见表2[9]。取800mg的Fe3O4@SiO2粒子分散在140mL乙醇溶液中,按照一定的醇/水加入适量的蒸馏水,在设定反应的温度下进行机械搅拌,回流相应的时间。反应结束后,冷却至室温。

表2 实验计划表Tab.2 Experiment schedule
2 结果与讨论
2.1 XPS能谱分析
图1是Fe3O4@SiO2的O1s电子的XPS谱图,其中,a、b、c 为 60℃下活化 Fe3O4@SiO2的 XPS 谱图,d、e、f为 80℃下活化 Fe3O4@SiO2的 XPS 谱图,g、h、i为 100℃下活化 Fe3O4@SiO2的 XPS谱图。
由图1可见,O1s分峰均呈不对称分布,这表明样品表面不只有一种结合状态的氧。将O1s的XPS峰进行分峰拟合,得到5个氧物种的谱峰,其结合能分别对应于 530.1、531.6、532.24、532.5 和 533.4eV,分别归属于Fe3O4的晶格氧物种、表面Si-OH氧物种、表面吸附O2的氧物种、SiO2中的氧物种以及吸附水中的氧物种[10-13]。
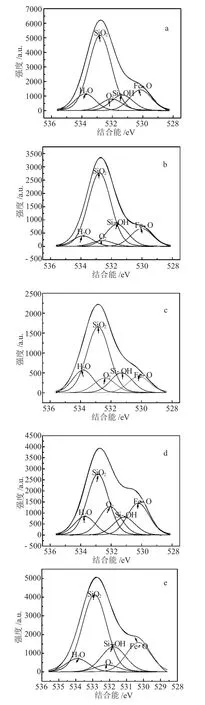

图3 Fe3O4@SiO2的O1s分峰XPS谱图Fig.3 O1s XPSspectrum of Fe3O4·SiO2nanoparticles
根据XPS O1s的分峰结果,对不同氧物种峰下的面积进行积分,可计算出-OH中的氧物种在全部氧物种中所占的比例,正交试验的因素水平表和由XPS测得表面-OH含量的极差计算结果分析见表3。
2.2 正交试验结果分析
由表3中Ⅰ,Ⅱ,Ⅲ所对应的9个数据分别是A1、B1、C1;A2、B2、C2;A3、B3、C3水平参与的 3 个实验所得 Si-OH 含量的加和,K1,K2,K3对应的数据分别是以上数据的平均值,表中A因素对应的Ⅰ,Ⅱ,Ⅲ和K1,K2,K3中的数据,分别反映 A1、A2、A3水平对Si-OH含量的影响。同理,B(C)因素对应的Ⅰ,Ⅱ,Ⅲ和K1,K2,K3中的数据,分别反映 B1、B2、B3(C1、C2、C3)水平对 Si-OH含量的影响。由表3中极差分析结果可知,各因素对Fe3O4@SiO2的表面Si-OH含量影响的主次顺序为:回流温度>回流时间>醇/水比,即影响Fe3O4@SiO2的表面Si-OH含量的主要因素为回流温度,其次为回流时间,醇/水比对Fe3O4@SiO2表面Si-OH的含量影响很小。通过级差分析可得,活化的最佳水平组合为A2B1C3,即活化温度为80℃、活化时间为1h、醇/水比为6∶1,在此条件下Fe3O4@SiO2的表面Si-OH含量相对较高。

表3 活化Fe3O4@SiO2的正交试验结果Tab.3 Orthogonal experiment results of modified Fe3O4@SiO2 nanoparticles
2.3 讨论
由级差分析结果可知,在以上3因素中,温度对Si-OH含量的影响最大,表4是通过XPS分峰拟合不同温度下改性Fe3O4@SiO2后的Si-OH含量。

表4 不同温度下改性Fe3O4@SiO2后的Si-OH含量Tab.4 Si-OH content of modified Fe3O4@SiO2nanoparticles at different dergeer
通过表4中的数据判定,温度控制在80℃时,改性的Fe3O4@SiO2表面羟基含量较高,可能原因是在对Fe3O4@SiO2活化的过程中,Fe3O4@SiO2粒子分散在乙醇和水的混合溶液中,由于氢键的存在,使乙醇分子与水分子之间的缔合比较牢固,Si-O-Si键不易与醇水混合液中的羟基缔合形成Si-OH,根据拉乌尔定律和亨利定律,80℃更接近醇-水二元体系的沸点[14],分子的热运动加快,分子不规则的布朗运动使极性溶剂之间的氢键断裂[15],此时Fe3O4@SiO2粒子在醇-水溶液的蒸气气氛中,使Fe3O4@SiO2粒子能够充分的与乙醇分子中的羟基接触,增加了羟基与Si-O-Si键的碰撞几率,使Si-O-Si键发生断裂形成Si-OH,从而增加了Fe3O4@SiO2粒子表面的羟基数量。
图2是未经活化和在最优水平组合条件下进行的活化处理Fe3O4@SiO2O1s电子的XPS谱图,Fe3O4@SiO2中各氧物种的原子百分含量的计算结果见表5。

图2 Fe3O4@SiO2的O1s分峰XPS谱图Fig.2 O1s XPS spectrum of Fe3O4@SiO2nanoparticles

表5 由XPS分峰拟合得到Fe3O4@SiO2中各氧物种的原子百分含量Tab.5 Atomic ratio of different oxygen spicies of Fe3O4@SiO2 nanoparticles after XPS fitting
由图2和表5中的数据可以看出,同未改性的Fe3O4@SiO2相比,经过回流活化改性后,Fe3O4@SiO2表面的Si-OH中的氧物种含量增多了,而SiO2中的晶格氧物种的含量相应降低了,结果表明在对Fe3O4@SiO2进行回流活化处理时,Fe3O4@SiO2表层的Si-O-Si键与反应体系中的水蒸汽反应,Si-O-Si键断裂生成了Si-OH[16-18],增加了表面的Si-OH数量,同时减少了Si-O-Si建的数量,相应地导致了Si-O-Si中氧物种含量的下降。
在对样品进行XPS测试后得出,改性后Fe3O4@SiO2的Si/Fe比未活化Fe3O4@SiO2的Si/Fe比小,而相应的氧物种的含量有所增加,其结果见表6。

表6 Fe3O4@SiO2改性前后元素含量Tab.6 Element ratio of Fe3O4@SiO2nanoparticles before and after modfidied
由表6中数据可知,Si/Fe比从改性前的5.77降低为改性后的2.79,氧物种的原子百分含量从改性前的73.59%升高为改性后的77.68%,这可能是因为,在对Fe3O4@SiO2改性过程中,使SiO2表面的硅氧烷键(Si-O-Si)发生了断裂,而Si-O-Si能够重新发生羟基化反应(rehydrotylation),生成了更多的硅羟基,其中,有一部分自由的Si-OH相互碰撞,生成游离的SiO2后脱离[19,20],因此,改性后降低了Fe3O4@SiO2的Si/Fe比,同时增加了氧物种的原子百分含量。
3 结论
本文通过正交试验设计,以X射线光电子能谱分析(XPS)为测试手段,以Fe3O4@SiO2的Si-OH含量为测试指标,根据级差分析方法,对各因素对实验结果的影响进行了分析,得出温度对Si-OH含量的影响最大,其次是回流时间和醇/水,最后选定改性Fe3O4@SiO2的适宜条件为:温度为80℃,回流时间1h,醇/水6∶1。
[1]Raffaella Buonsanti,Vincenzo Grillo,Elvio Carlino,Seeded Growth of Asymmetric Binary Nanocrystals Made of a Semiconductor TiO Rodlike Section and a Magneticγ-Fe2O3Spherical Domain[J].Journal ofthe American Chemical Society,2006,128(51):16953-16970.
[2]An-Hui Lu,E L.Salabas,Ferdi Schüth Magnetic Nanoparticles:Synthesis,Protection,Functionalization and Application[J].Angew.Chem.Int Ed.,2007,46:1222-1244.
[3]Q A Pankhurst,J Connolly,S K Jones,et al.Applications of magnetic nanoparticles in biomedicine[J].Phys D:Appl.Phys.,2003,36:R167-R181.
[4]Haibin Li,Xuechen Duan,Guocong Liu,et al.Synthesis and characterization of copper ions surface-doped titanium dioxide nanotubes[J].Science Direct,2008,43:1971-1981.
[5]JIE Chong Yu,CHEN ZhongMing,HUA Wei,Atmospheric heterogeneous re action of acetone:Adsorption and desorption kinetics and mechanisms on SiO2particles[J].Chinese Science Bulletin,2008,53:1004-1010.
[6]闻荻江,李敏.多孔 SiO2表面水合技术研究[J].2001,17(1):79-84.
[7]王丽燕,王红霞,王爱杰,等.磁性SiO2载体的表面改性与纳米 TiO2光催化剂的固载[J].催化学报,2009,30(9):939-944.
[8]许洁,等.正交实验设计优化复方珍珠含片制备工艺[J].时珍国医国药,2008,19(1):87-89.
[9]计红芳,张令文,张远,等,苦瓜保健面条的研究[J].食品工业科技,2009,30:201-204.
[10]赵尹,李春忠,刘秀红,等.气相火焰燃烧合成锌掺杂TiO2纳米晶的光催化性能[J].过程工程学报,2007,7(6):1254-1258.
[11]Clarence S,Tang,Mathieu Antoni.Electrically-Assisted Formation and Desorption of Dodecyl Phosphate Self-assembled Monolayers on Indium Tin Oxide(ITO) Surfaces[J].ESC Transactions(208th ECS Meeting)1,2005,28:29-43.
[12]He,G.Zhang,L.D.Fang,Q.Silicat layer formation at HfO2/SiO2/Si intefacr detemined by x-ray photoelectron spectroscopy and infrared spectrooscopy[J].Journal of Applied Physics,2006,100:083517(1-5).
[13]Liqiang Jing,Baifu Xin,Fulong Yuan.Effects of Surface Oxygen Vacancies on Photophysical and Photochemical Processes of Zn-Doped TiO2Nanoparticles and Their Relationships[J].J.Phys.Chem.B.,2006,110:17860-17865.
[14]李肖华,李卫坤,宋旭东,等.乙醇-水-离子液体伪二元体系常压汽液平衡数据的测定与关联[J].浙江工业大学学报,2008,36:399-402.
[15]Donghai Mei,Roger Rousseau,Shawn M.Kathmann.Ethanol synthesis from syngas over RH-based/SiO2catalysts:A combined experimental and theoretical modeling study[J].Journal of catalysis,2010,217:325-342.
[16]毋伟,陈建峰,屈一新.硅烷偶联剂的种类与结构对二氧化硅表面聚合物接枝改性的影响[J].硅酸盐学报,2004,32(5):570-575.
[17]T.Takei,K.Kato,A.Meguro.Infrared spectra of geminal and novel triple hydroxyl groups on silica surface[J].J.of Colloids and Surfaces,1999,150:77-84.
[18]Ofer Sneh,Steven M.George.Thermal Stability of Hydroxyl Groups on a Well-Defined Silica Surfaced[J].J.Phys.Chem.,1995,99(13):4639-4647.
[19]Shioji,S.Hanada,M.Hayashi,Y.Kinetic study of alkoxylation and rehydroxylation reactions on silica surfaces[J].Advanced Powder Technology,2007,18(4):467-483.
[20]Y.Du,X.Du,S.M.George.Mechanism of pyridine-catalyzed SiO2atomic layer deposition studied by Fourier infrared spectroscopy[J].J.Phys.Chem.C.,2007,111(1):219-226.

