用于“治疗性克隆”人胚胎干细胞研究面临的问题与可能的解决办法
戴甲培,宋文强,肖爱武,罗 艺,孙 燕
(1中南民族大学武汉神经科学和神经工程研究所,武汉430074;2中国人脑库中心,武汉430074)
胚胎干细胞(Embryonic stem cell,ESC)尤其是人胚胎干细胞(hESC)的建立、研究和应用,被认为是继“人类基因组计划”之后,在医学和生命科学史上的又一革命性进展.目前,有关干细胞的研究进展表明,开展个性化干细胞治疗是临床应用的最终目标,而利用“治疗性克隆”技术获取人胚胎干细胞是实现这一目标的重要手段.本文就人胚胎干细胞的“治疗性克隆”的研究进展、研究面临的困难以及有望解决的措施进行简要的综述.
1 人胚胎干细胞的研究意义及应用前景
人胚胎干细胞(hESC)一般来自由体外受精卵发育成的囊胚期胚胎的内细胞团,具有保持未分化状态及多向分化潜能的无限增殖能力.hESC可在体外定向诱导分化为多种细胞类型,因而在研究人胚胎发育和疾病发生、器官和细胞移植治疗、基因治疗、药物筛选与新药开发方面,hESC具有广阔的应用前景.例如:诱导人胚胎干细胞向胰岛细胞方向分化而产生胰岛内胚层细胞,通过移植这些细胞可用于治疗糖尿病[1];将人胚胎干细胞经血管内或直接注射到病变的心脏部位,可再生为心肌细胞,用于治疗严重缺血引起的心肌坏死(心肌梗死),动物实验的研究结果也证实了这种方法的有效性[2].20世纪90年代,将人胚胎干细胞用于治疗一些神经系统退行性疾病如帕金森病等已取得一定疗效,然而人胚胎干细胞的来源有限,加之在个性化治疗方面存在的技术问题(如免疫排斥),使之尚无法广泛应用,但人胚胎干细胞的利用仍不失为治疗神经系统退行性疾病的重要手段.此外,人胚胎干细胞还可用于治疗组织损伤(如脊髓损伤)和新药开发.从患者身上获取体细胞并诱导形成疾病特异的多能干细胞,对了解疾病发生机理、药物筛选和毒性研究有着重要意义[3,4].由此可见,干细胞技术的不断发展实现了在细胞和分子水平对人类疾病发病机制的研究,而以细胞为模型寻找新的药物作用靶标或进行新药临床实验将比传统方法更为精准和有效[5].目前,有关干细胞的研究进展表明,开展个性化干细胞治疗是临床应用的最终目标,而利用“治疗性克隆”技术获取人胚胎干细胞是实现这一目标的重要手段.
2 获得人胚胎干细胞的主要途径及存在的问题
目前获得人类干细胞进行研究和临床治疗的方法主要有3种(如图1A-C):(1)使用受精卵发育成胚胎时所产生的胚胎干细胞(Embryonic stem cell,ESC),主要来源于流产和进行体外受精(In vitro fertilization,IVF)等人工辅助生殖(试管婴儿)过程中的多余胚胎.2010年底,美国食品和药物管理局已批准美国Geron公司和先进细胞技术公司使用人胚胎干细胞(hESC)治疗脊髓损伤和斯特格氏症(又称少年黄斑变性)的人体临床实验(www.geron.com或 www.advancedcell.com),其使用的胚胎干细胞系即来源于体外受精生殖过程中的多余胚胎.然而,由于胚胎来源非常有限,利用这样的胚胎干细胞进行广泛而大量的研究以及个性化临床应用仍存在着诸多困难.此外,病人和获得的胚胎干细胞的基因非同源性还可引起免疫排斥等问题[6].(2)使用化学和生物分子(如特定的细胞转录因子)诱导的方法使人类体细胞(如皮肤细胞)重编程而得到的类似胚胎干细胞的一种细胞类型,称之为诱导性多能干细胞(Induced pluripotent stem cells,iPS cells).iPS 细胞是目前干细胞研究领域的热点,然而,通过这种方法获得的干细胞在用于人类临床治疗之前还面临着转化效率低、安全性不佳等问题.动物实验表明,iPS细胞植入体内有导致癌症的可能性[7-12].(3)使用体细胞核转移技术(Somatic cell nuclear transfer,SCNT)或细胞融合技术(Cell fusion)克隆人类早期胚胎并提取干细胞,即所谓的“治疗性克隆”(Therapeutic cloning)技术.体细胞核转移技术提取的胚胎干细胞具有发育成各种细胞类型的可能性,然后将它们植入病人的受损组织(如胰腺、心脏、脊髓、角膜、脑组织等)中,可能起到修补的作用.若使用病人自己的体细胞,还可以消除免疫排斥问题[12,13].2008年,美国纽约Sloan-Kettering研究中心的研究人员在帕金森病模型鼠身上利用治疗性克隆技术获得了成功,为该技术用于临床治疗揭开了新的篇章.
3 治疗性克隆人胚胎干细胞面临的困难及解决办法
利用体细胞核转移技术和病人的体细胞(如皮肤细胞)克隆出了早期胚胎,并提取出新的胚胎干细胞系是目前进行干细胞个性化治疗的重要手段,具有广泛的临床应用前景.然而,该技术的研究和最终临床应用需要大量的成熟卵细胞,通过女性捐献卵细胞来开展这方面的工作仍有许多难点[13].为解决这一难题,目前有科学家使用动物卵细胞替代人卵细胞进行异种混合胚胎(Hybrid embryos)实验[14].异种混合胚胎可分为3种:第1种是将某种动物的精子与另一种动物的卵子结合为受精卵,这类研究在伦理学上是不允许的,而且存在多种技术障碍,第2种称之为“嵌合体”,就是将某种动物的胚胎干细胞注入另一种正在发育的动物胚胎中,令其发育为2种动物细胞混杂的胚胎,国际上对此类研究基本上不允许的;第3种则是运用体细胞核转移技术将一种动物或人的体细胞核注入去核的牛、兔、羊或猪的成熟卵母细胞,以培养早期胚胎(囊胚),并从中提取胚胎干细胞.到目前为止,“人-牛嵌合体”、“人-羊嵌合体”、“人-兔嵌合体”和“人-猪嵌合体”等初步实验已获得成功[14].2008年,英国人类受精与胚胎学管理局(HFEA)批准了这一类人兽混合胚胎的实验(www.hfea.gov.uk).2009 年,美国明尼苏达大学Schulze糖尿病研究所(University of Minnesota's Schulze Diabetes Institute in Minneapolis)的研究人员在美国“科学”杂志上叙文声称,他们将使用世界上最干净的猪来进行这方面的研究,以探讨利用“人-猪嵌合体”胚胎干细胞移植来治疗糖尿病的可能性[15].新西兰和俄罗斯等国家也在开展类似的研究.
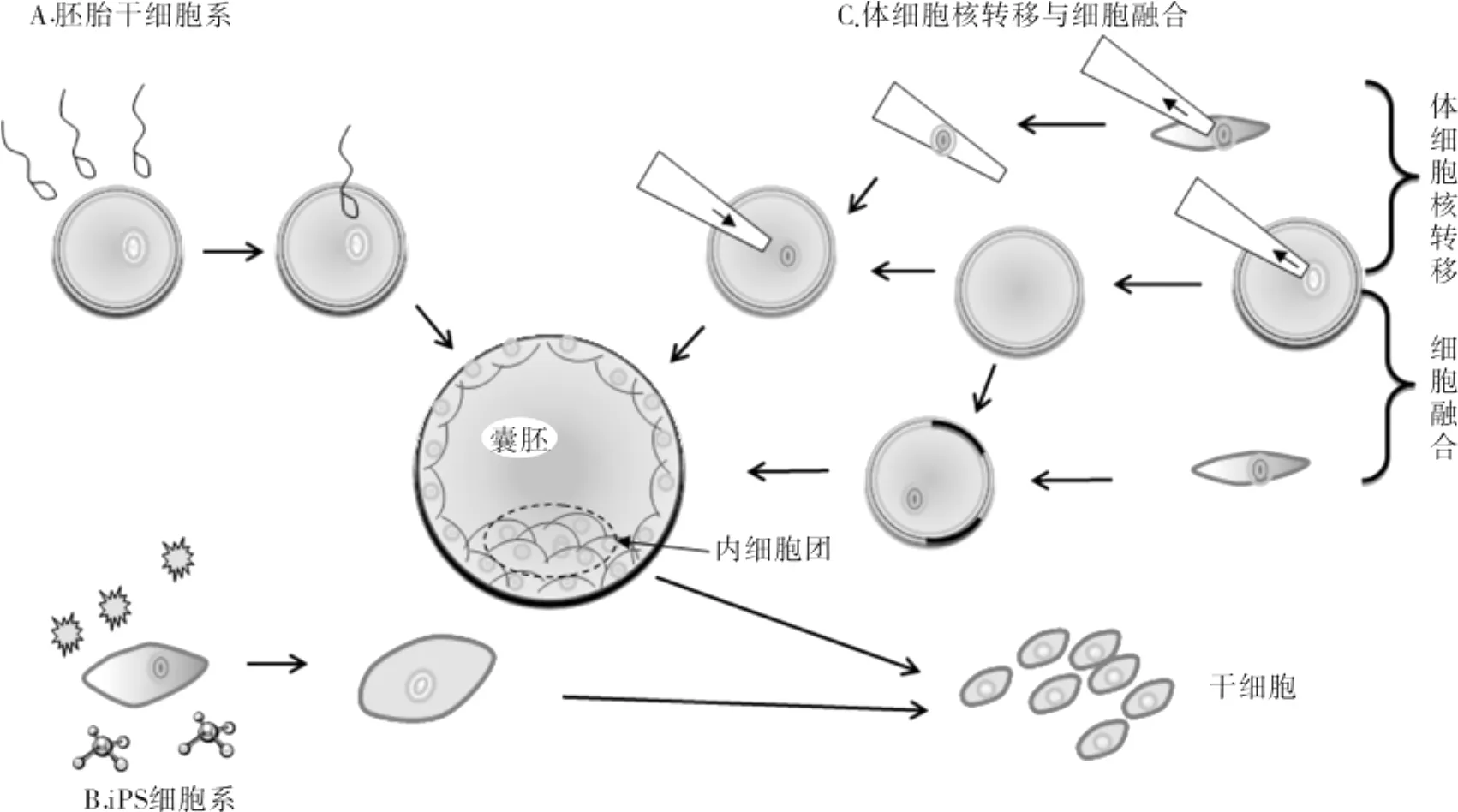
图1 胚胎干细胞的3个主要来源Fig.1 Threemain sources for embryonic stem cells
然而,将异种混合胚胎应用到人身上必定会遇到伦理和其它方面的问题.虽然DNA主要存在于细胞核中,但细胞质中也有少量的遗传物质即线粒体DNA(mtDNA),它负责编码与线粒体功能相关的13个基因,主要是为生命活动提供能量.比起细胞核中的几万个人类基因,这13个线粒体基因似乎显得“微不足道”,然而这样的研究最终用于临床还是存在很大的风险,如动物的线粒体是否会与人的线粒体或其它成分发生相互作用.而更大的风险在于病毒,有的病毒对动物无害却对人有害.人兽胚胎的研究难度很大,加之触及了人类伦理观念,在社会各界仍存在不少争议.由此可见,人胚胎干细胞的“治疗性克隆”研究仍面临着许多困难,离临床应用还有相当长的路要走,而获取人成熟卵细胞所面临的种种困难是进行人类“治疗性克隆”研究和临床应用的主要障碍.
4 获得人成熟卵细胞的改良方法及需要注意的问题
克服获取人成熟卵细胞所面临的困难对于进行人类“治疗性克隆”的研究和临床应用将具有重要意义.戴甲培(Dai Jiapei)等在早期的研究工作中发现,从死亡后人脑组织获得的神经细胞经复苏后能恢复功能[16-19],随后其它的研究人员也发现利用死亡后的人脑组织能培养神经细胞和神经干细胞进行功能研究[20-23].这些研究启发:能否从人死亡后的卵巢中取出未成熟的腔前卵泡(包括原始和初级卵母细胞)进行体外培养来获得成熟的人卵细胞?如果这种设想能成功,将获得大量的人成熟卵细胞,因为一个新生儿两侧卵巢有100~200万个原始卵泡(Primordial follicles),青春期也约有4万个腔前卵泡可供利用,克服了人类“治疗性克隆”研究和临床应用面临的主要难题.我们在前期的动物实验中发现,从死亡后24 h或48 h的昆明小鼠(16~20 d)卵巢中分离出的腔前卵泡在进行细胞复苏和体外培养后,能获得成熟的卵细胞(待发表的资料).这一结果为我们利用人死亡后卵巢培育可供“治疗性克隆”研究和临床应用的人成熟卵细胞带来了希望.此外,利用这种方法获得的成熟卵细胞在很大程度上能够避开法律和伦理学方面的问题.目前,国内有关遗体捐献用于科学研究的法律法规已日臻成熟,为利用人体组织进行科学研究提供了有力保障(www.cbbcnet.org.cn)[24].
然而,利用人死亡后卵巢体外培育成熟卵母细胞供“治疗性克隆”的研究和临床应用仍存在一些亟待解决的问题.首先,是如何克服细胞复苏和培养过程中的细胞凋亡.器官移植的研究表明,导致各种组织器官坏死的主要原因是缺血再灌注而并非缺血、缺氧本身.如单纯冻存肝组织16 h并不会出现细胞凋亡,若在冻存8 h或16 h后再灌注1 h,肝窦内凋亡细胞数会显著增加[25];大鼠肺组织冻存20 min、6 h及12 h后细胞死亡率均很小,若在冻存6 h或12 h后再灌注处理2h,细胞凋亡率将明显增高[26];用器官保存液或生理盐水分别灌注已冻存6 h及18 h的胰腺组织2 h,结果显示,生理盐水灌注组的细胞凋亡数要多于器官保存液灌注组,且冻存18 h的胰腺组织凋亡率更高.由此推测,缺血再灌注可引起胰腺腺泡细胞凋亡,且细胞凋亡程度与冻存时间相关[27];另有研究也证实,缺血再灌注与心脏移植术后的细胞凋亡有关[28].其次,是如何有效地将腔前卵泡体外培养为成熟卵细胞.腔前卵泡的培养,即原始卵泡向初级卵泡的转化过程,是该技术成功用于治疗性克隆的一个关键技术环节.将腔前卵泡培养为成熟卵泡与将次级卵泡培养到成熟卵泡有很大不同,前者需要启动腔前卵泡发育程序,即通常所说的细胞重编程过程 (Cell reprogramming).只有启动了腔前卵泡发育程序,才能实现从初级卵泡经次级卵泡发育到成熟卵泡,这一过程涉及许多细胞重编程的基因和分子机制,是目前卵泡发育研究的重点和难点[29-36].此外,通过这种方法获得的人成熟卵细胞最终用于临床还需考虑以下问题:(1)如何长期保存培养成熟的人卵细胞;(2)如何结合体细胞核转移技术克隆人类早期胚胎;(3)如何从克隆的人类早期胚胎(囊胚期)提取并培养干细胞.因此,解决人成熟卵细胞的来源问题对于加快“治疗性克隆”的临床应用将提供重要的基础.
5 结语
目前,利用体细胞核转移技术克隆人类早期胚胎和提取干细胞的研究在国内已取得初步成功,但都是通过女性捐献卵细胞来开展研究工作.由于卵细胞来源困难,除了克服技术上的问题,如何获得一定数量以及高质量的人成熟卵细胞是成功的关键.若能利用人死亡后卵巢组织大量培育人成熟卵细胞,那将为开展克隆人早期胚胎和胚胎干细胞的研究带来足够资源,并为最终用于临床治疗带来新的希望.
[1]Shim JH,Kim SE,Woo D H,et al.Directed differentiation of human embryonic stem cells towards a pancreatic cell fate[J].Diabetologia,2007,50:1228-1238.
[2]Passier R,van Laake L W,Mummery C L.Stem-cellbased therapy and lessons from the heart[J].Nature,2008,453:322-329.
[3]Schwarz SC,Schwarz J.Translation of stem cell therapy for neurological diseases[J].Transl Res,2010,156:155-60.
[4]Shihabuddin L S,Aubert I.Stem cell transplantation for neurometabolic and neurodegenerative diseases [J].Neuropharmacology,2010,58:845-54.
[5]Rubin1 L L.Stem cells and drug discovery:the beginning of a new era? [J].Cell,2008,132:549-552.
[6]Chidgey A P,Layton D,Trounson1 A,et al.Tolerance strategies for stem-cell-based therapies [J].Nature,2008,453:330-337.
[7]Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126:663-676.
[8]Xu Y,Shi Y,Ding S.A chemical approach to stem-cell biology and regenerative medicine[J].Nature,2008,453:338-344.
[9]Rolletschek A,Wobus A M.Induced human pluripotent stem cells:promises and open questions[J].Biol Chem,2009,390:845-849.
[10]Yamanaka S,Blau H M.Nuclear reprogramming to a pluripotent state by three approaches[J].Nature,2010,465:704-712.
[11]Lutolf M P,Gilbert PM,Blau H M.Designingmateri-als to direct stem-cell fate[J].Nature,2009,462:433-441.
[12]Hao J,Zhu W,Sheng C,et al.Human parthenogenetic embryonic stem cells:one potential resource for cell therapy[J].Sci China C Life Sci,2009,52:599-602.
[13]Chang C,Sung L,Amano T,etal.Nuclear transfer and oocyte cryopreservation [J].Reprod Fertil and Dev,2009,21:37-44.
[14]Beyhan Z,Iager A E,Cibelli JB.Interspecies nuclear transfer:implications for embryonic stem cell biology[J].Cell Stem Cell,2007,1:502-512.
[15]Holden C.Cell therapies,clean pigs offer alternative to stem cell transplants[J].Science,2009,326:1049.
[16]Dai J,Swaab D F,Buijs R M.Recovery of axonal transport in"dead neurons" [J].Lancet,1998,351:499-500.
[17]Dai J,Swaab D F,Van der Vliet J,et al.Postmortem tracing reveals the organization of hypothalamic projections of the suprachiasmatic nucleus in the human brain[J].JComp Neurol,1998,400:87-102.
[18]Dai J,Buijs R M,Kamphorst W,et al.Impaired axonal transport of cortical neurons in Alzheimer's disease is associated with neuropathological changes[J].Brain Res,2002,948:138-144.
[19]Dai J,Buijs R M,Swaab D F.Glucocorticoid hormone(cortisol)affects axonal transport in human cortex neurons but shows resistance in Alzheimer's disease[J].Br JPharmacol,2004,143:606-610.
[20]Palmer TD,Schwartz PH,Taupin P,et al.Cell culture:Progenitor cells from human brain after death[J].Nature,2001,411:42-43.
[21]Verwer RW,HermensW T,Dijkhuizen P,etal.Cells in human postmortem brain tissue slices remain alive for several weeks in culture [J].FASEB J,2002,16:54-60.
[22]Verwer RW,Dubelaar E J,HermensW T,et al.Tissue cultures from adult human postmortem subcortical brain areas[J].JCell Mol Med,2002,6:429-32.
[23]Verwer RW,Baker R E,Boiten E F,et al.Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease[J].Exp Gerontol,2003,38:167-172.
[24]孙 燕,周亦武,戴甲培.人脑库的建立和应用[J].中南民族大学学报 :自然科学版,2009,28(4):73-81.
[25]Gao Y,Xu X P,Hu H Z,et al.Cultivation of human liver cell lines with micro carriers acting as biological materials of bio artificial liver[J].World JGastroenterology,1999,5:221-224.
[26]Fischer S,Cassivi SD,Xavier A,et al.Cell death in human lung transplantation:apoptosis induction in human lungs during ischemia and after transplantation[J].Ann Surg,2000,231:424-431.
[27]Drognitz O,Obermaier R,Liu X,et al.Effect s of organ preservation,ischemia time and caspase inhibition on apoptosis and microcirculation in rat pancreas transplantation [J].Am JTransplant,2004,4:1042-1050.
[28]Panizo-Santos A,Lozano M D,Distefano S,et al.Clinico-pathologic,immunohistochemical,and TUNEL study in early cardiac allograft failure[J].Cardiovasc Pathol,2000,9:153-159.
[29]Eppig J J,Schroeder A C.Capacity ofmouse oocytes from preantral follicles to undergo embryo genesismaturation,and fertilization in vitro [J].Biol Reprod,1989,41:268-276.
[30]Eppig JJ,O Brien M J.Development in vitro ofmouse oocytes from primordial follicles[J].Biol Reprod,1996,54:179-207.
[31]Wandji S A,Srsen V,Nathanielsz PW,et al.Initiation ofgrowth ofbaboon primordial follicles in vitro[J].Hum Rrprod,1997,12:1993-2001.
[32]Fabbri R,Pasquinelli G,Keane D,et al.Culture of cryopreserved ovarian tissue:state of the art in 2008[J].Fertil Steril,2009,91:1619-1629.
[33]Sui X X,Luo L L,Xu J J,et al.Evidence that FOXO3a is involved in oocyte apoptosis in the neonatal rat ovary[J].Biochem Cell Biol,2010,88:621-628.
[34]Xu A X,Zheng L P,Tang D F,et al.Role of MAPK and PKC signaling pathways in the regulation of c-erbB(2)in the primordial follicles onset[J].Sheng Li Xue Bao,2009,61:439-444.
[35]Meng Q,Bai C,Liu Y,etal.In vitro developmentand chromosomal configuration of bovine somatic cloned embryos with non-enucleated metaphase II oocytes[J].Cellular Reprogramming,2010,12:481-490.
[36]Roy SK,Albee L.Requirement for follicle-stimulationg hormone action in the formation of primordial follicles during perinatal ovarian development in the hamster[J].Endocrinology,2000,141:4449-4456.

