聚乙二醇修饰物混合曲拉通X100-硫酸盐-液-固萃取体系分离纯化基因重组蛋白的可行性研究
沈静茹,韦 康,余学红,茶永军
(1中南民族大学化学与材料科学学院分析化学国家民委重点实验室,武汉430074;2中南民族大学校医院,武汉430074)
绿色荧光蛋白(GFP)是由238个氨基酸残基组成的单链.基于其具有易于检测[1]、荧光稳定、无毒害、易于构建载体等优点[2],作为备受青睐的标记分子,GFP得以广泛应用.目前分离纯化基因重组蛋白和多肽常用技术为层析.YuChen[3]等用阴离子交换层析浓缩纯化α-胎蛋白,纯度达到95%;Ceccaroli P[4]等采用疏水作用色谱成功分离出了具有生物活性的己糖激酶,所用柱型为Phenyl-Sepharose,回收率达到90%.Sohel Dalal[5]等用Ni2+螯合金属层析法纯化在大肠杆菌中过度表达的绿色荧光基因重组融合蛋白,回收率达到91%.虽纯度较理想,但步骤繁琐、耗时、目标蛋白所得量有限等也是层析法局限性所在.液-固萃取体系分相操作无需特殊技术处理,费用低廉,且成相聚合物及盐对生物活性物质有稳定和保护作用,能应用于萃取酶、蛋白质等生物活性物质[6,7].本文采用聚乙二醇天冬氨酸修饰物[PEG6000-ASP-Cu(Ⅱ)]混合曲拉通X-100-硫酸盐-水液-固体系分离纯化含绿色荧光蛋白的基因重组蛋白,利用修饰物PEG6000-ASP-Cu(Ⅱ)增强萃取体系对目标蛋白的选择性,探究了该融合蛋白在体系中最适用的荧光检测方法,并得到一次正萃固相收得率达100%和一次反萃取率达68%的结果.
1 主要试剂与仪器
1.1 试剂
天门冬氨酸(国药集团化学试剂公司);蛋白胨及酵母浸粉(北京双旋微生物培养基制品厂);异丙基-β-D-硫代半乳糖苷(IPTG,sigma公司);氨苄青霉素(Amp,Amresco分装);聚乙二醇天冬氨酸修饰物(自制);蛋白质溶液(取自工程菌培养);超纯水;其他试剂均为分析纯.
1.2 仪器
78-1型磁力加热搅拌器(杭州仪表电机厂);NEXUS 470型智能傅立叶红外光谱仪(美国Thermo Nicolet公司);手提式不锈钢蒸汽消毒器(上海三申医疗器械有限公司);TOMY AutoCLAVE SS-325自动蒸汽消毒柜(日本);高速冷冻离心机(CR22G型,日立公司);HQL150C恒温摇床(武汉中科科仪技术发展有限责任公司);新苗净化工作台(上海新苗医疗器械制造有限公司);MSE Soniprep150超声波细胞破碎仪;101-A型电热鼓风干燥箱(天津泰斯特仪器有限公司);LS-55型荧光/磷光/发光光度计(PE公司).
1.3 聚乙二醇天冬氨酸修饰物的合成及菌液培养
1.3.1 修饰物的合成
聚乙二醇6000酰氯化,得氯化聚乙二醇;将氯化聚乙二醇与L-天门冬氨酸反应,将氨基酸引入PEG中;将已引入氨基酸的产物加至含过量硫酸铜的水溶液中,搅拌24 h,得最终产物 PEG-Asp-Cu(Ⅱ)[8].反应过程见图 1.
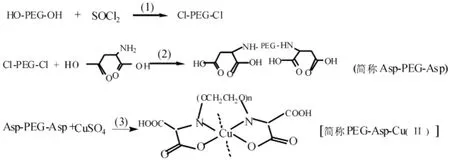
图1 PEG-Asp-Cu(Ⅱ)反应历程Fig.1 Mechanism reaction of PEG-Asp-Cu(Ⅱ)
1.3.2 含融合蛋白的菌原液培养
称取适量酵母浸粉、蛋白胨、氯化钠溶于蒸馏水,调节pH至7.0制成LB培养基,分装至小试管与锥形瓶中,密封,高温高压灭菌,烘干备用.取PQE-31-GFP单菌落接种至含氨苄青霉素(Amp)的LB培养基中,37℃恒温摇床振摇过夜,从活化过夜的菌液中吸取少量转接至含Amp的LB培养基,置于37℃恒温摇床扩大培养,至菌液OD600达到0.6~0.8,加入IPTG诱导,振摇培养4 h.高速离心除去培养基,蒸馏水悬浮菌体,超声波破碎,高速离心,取上清液,即为所需菌原液[9].
2 结果与讨论
2.1 PEG6000-ASP-Cu(Ⅱ)修饰物的表征
图2为聚乙二醇修饰物及其合成成分的紫外可见吸收谱图.由图2可知,PEG6000、Asp、Cu2+混合物紫外吸收光谱图(曲线a)与Asp、Cu2+混合物的紫外吸收谱图(曲线b)相似,而与修饰物的紫外吸收光谱图(曲线c)不同,由曲线c可知,有新的吸收峰产生,说明有不同于混合物成分的其他物质生成.
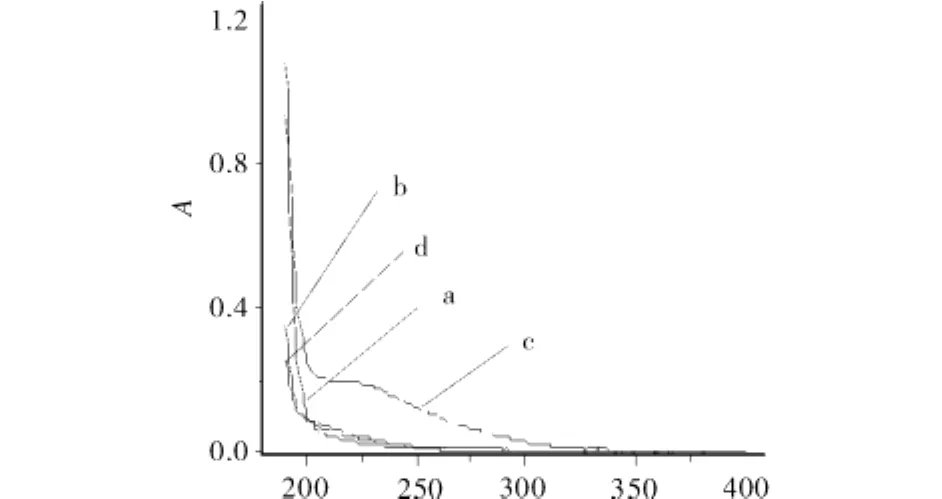
图2 聚乙二醇修饰物及其合成成分的紫外可见吸收谱图Fig.2 UV spectra of the synthetic raw material and modification
图3为聚乙二醇(曲线a)及其修饰物(曲线b)红外谱图.由图3知,曲线 b在3430 cm-1处的υ-OH吸收峰透过率较曲线a增大,即吸收峰减弱明显,说明羟基数目减少,证实了PEG的羟基被取代,形成最终产物PEG6000-ASP-Cu(Ⅱ).
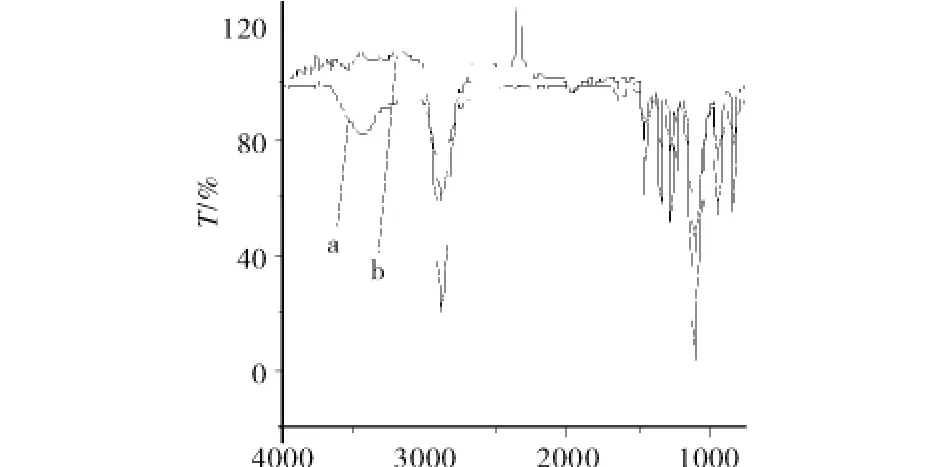
图3 聚乙二醇及修饰物IR谱图Fig.3 IR spectra of polyethylene glycol and modification
2.2 萃取体系中表征目标蛋白荧光方法的选择
2.2.1 目标蛋白最佳荧光激发、发射波长的探究
将菌蛋白原液稀释250倍,进行荧光扫描,预扫描确定激发光谱及发射光谱的光谱范围,记录最佳激发及发射波长.得到目标蛋白激发及发射光谱(见图4).由图4可知,目标蛋白最佳测定条件为:最佳激发波长220 nm,最佳发射波长334 nm,激发波长和发射波长的狭缝宽度均为12.5 nm.
2.2.2 液-固萃取体系各因素对目标蛋白荧光光谱的影响
配制浓度为1.6 mol/L的硫酸铵溶液,体积分数为12.8%的曲拉通X-100溶液,质量浓度为0.8 g/mL PEG-ASP-Cu(Ⅱ)溶液,稀释250倍的目标蛋

图4 融合蛋白液的荧光光谱图Fig.4 Fluorescence spectra of the recombinant fusion protein
白溶液.在固定激发波长为220 nm,调节激发波长及发射波长的狭缝宽度均为12.5 nm,扫描上述溶液的荧光发射光谱,结果见图5.此荧光条件下,目标蛋白在最佳吸收波长334 nm处,硫酸铵溶液以及聚乙二醇修饰物溶液无荧光响应,而12.8% 曲拉通X-100溶液则有很强的荧光吸收.实际萃取体系中,曲拉通X-100体积分数约定为12.8%,因此,选用曲拉通X-100、硫酸铵液固萃取体系分离纯化目标蛋白时,采用常规荧光法检测目标蛋白将受到曲拉通X-100溶液的干扰.
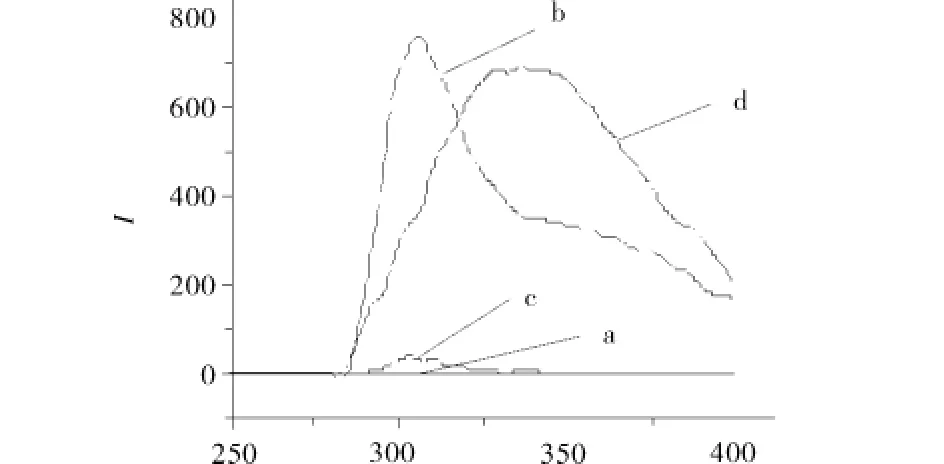
图5 硫酸铵、曲拉通X-100、PEG6000-ASP-Cu(Ⅱ)修饰物及目标蛋白液的荧光发射谱图Fig.5 Em spectra ofmodifier,ammonium sulfate,Triton X-100 and protein
2.2.3 恒波长同步荧光法在液-固萃取体系中测定目标蛋白的可行性研究
对目标蛋白进行恒波长同步荧光扫描,变换波长差值(10~150 nm),调整合适的激发波长及发射波长的狭缝宽度,确定恒波长同步荧光法测定目标蛋白质的最佳条件为:波长差20 nm,激发波长狭缝宽度10 nm,发射波长狭缝宽度15 nm.按上述条件,对含有绿色荧光蛋白的菌(PQE-31-GFP)蛋白液以及提取于对照菌(pGEM)中的蛋白液进行恒波长同步荧光扫描,结果见图6.对萃取体系中各因素及目标蛋白溶液进行恒波长同步荧光扫描,结果见图7.
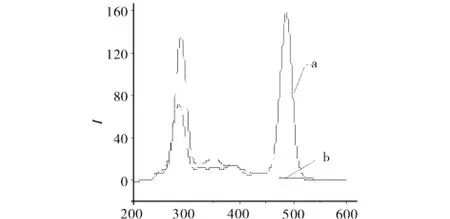
图6 2种融合蛋白恒波长同步荧光扫描图Fig.6 Constant-wavelength synchronous fluorescence spectra of two kinds of protein
由图6可知,曲线a,目标蛋白的荧光光谱在287.50、487.19 nm 各有一个谱峰,曲线 b为提取于对照菌中的蛋白质,仅在287.50 nm有谱峰,在487.19 nm无荧光响应峰,因此可确定487.19 nm的峰为含绿色荧光蛋白的目标蛋白特征光谱峰.由图7可知,采用恒波长同步荧光法测定目标蛋白,在目标蛋白的特征吸收峰487.19 nm处,萃取体系中PEG-ASP-Cu(Ⅱ)修饰物和硫酸铵的荧光响应值均较小,曲拉通X-100虽有响应,但对目标蛋白的测定影响也较小.因此,选用恒波长同步荧光法测定PEG-ASP-Cu(Ⅱ)混合曲拉通X-100-硫酸铵液-固萃取体系中含绿色荧光蛋白的目标蛋白是可行的.
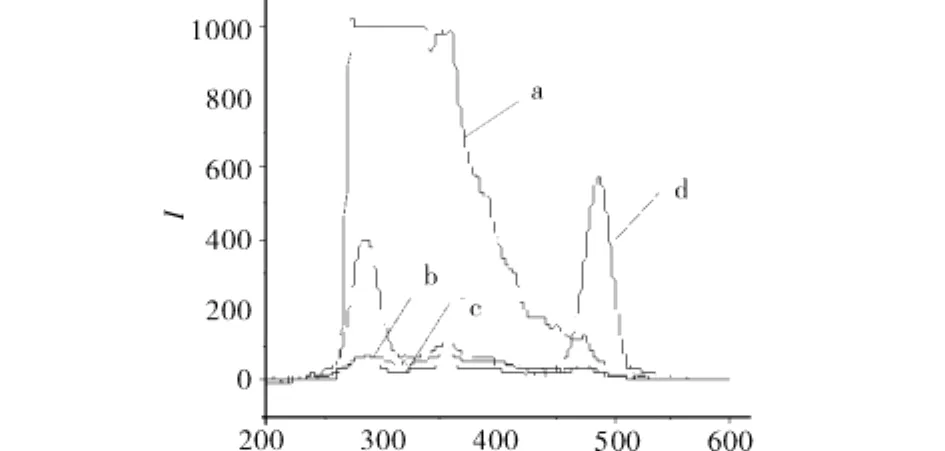
图7 体系中各成分的恒波长同步荧光光谱扫描图Fig.7 Constant-wavelength synchronous fluorescence spectra of all part of System
2.3 萃取条件实验
2.3.1 萃取方法
依次取硫酸铵储备液,曲拉通X-100储备液,PEG-ASP-Cu(Ⅱ)修饰物溶液以及等量目标蛋白溶液于25 mL比色管中,加水定容至10 mL并于振荡器上振荡15 min,之后冰水浴静置20 min.体系分为固、液两相.将液相(盐水相)倾至另一比色管中,用超纯水定容至25 mL,固相溶解后定容至25 mL.采用上述最佳恒波长同步荧光法分别扫描定容完毕的固、液两相,读取487.19 nm处荧光强度值并计算固相收得率.
2.3.2 正萃取条件实验
探究了未加修饰物与加入修饰物后萃取体系对目标蛋白收得率的影响(见图8和图9).由图8可知,未加入修饰物(聚合物曲拉通X-100浓度由0.08 mL/mL增至0.14 mL/mL)的单纯萃取体系,对目标蛋白的萃取率为50% ~89%;图9中加入修饰物PEG-ASP-Cu(Ⅱ)(浓度由0.7 g/mL增至1.1 g/mL)的萃取体系,可将收得率提升并稳定至97%以上,最高可达100%.
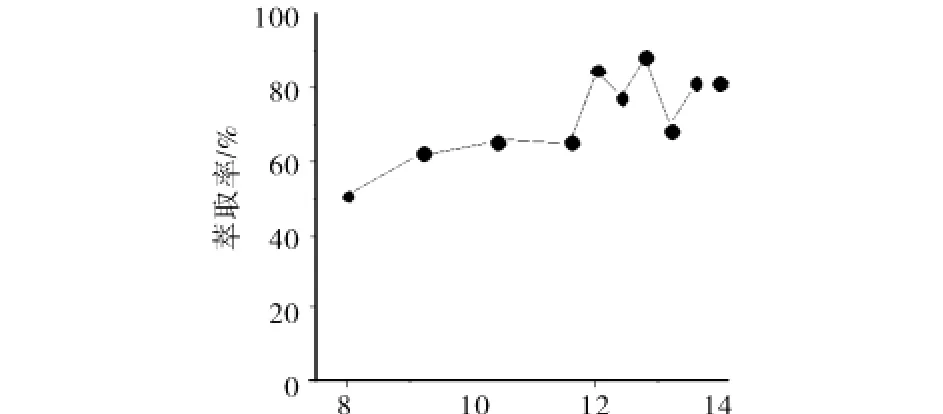
图8 未加入修饰物萃取体系中两相配比变化对萃取率的影响Fig.8 Influence of extraction ratio by change the two phase ratio ofwithoutmodifications in extraction system
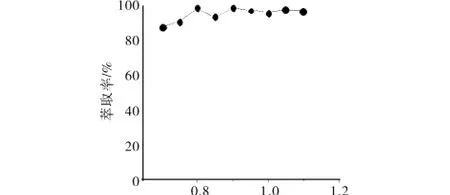
图9 萃取体系中加入修饰物的量对目标蛋白质萃取率的影响Fig.9 Influence of extraction ratio by change the Amount of join modifications in extraction system
2.3.3 反萃取条件实验
于正萃后的固相中,加入一定浓度的EDTA溶液及硫酸铵溶液,反萃目标蛋白.同样采用恒波长同步荧光法,读取487.19 nm处荧光强度值并计算液相收得率即为反萃取率.探究了酸度(pH 5.0~8.0)对反萃取率的影响(见图10).由图10可知,通过改变酸度优化反萃条件,最高反萃取率可达68%.
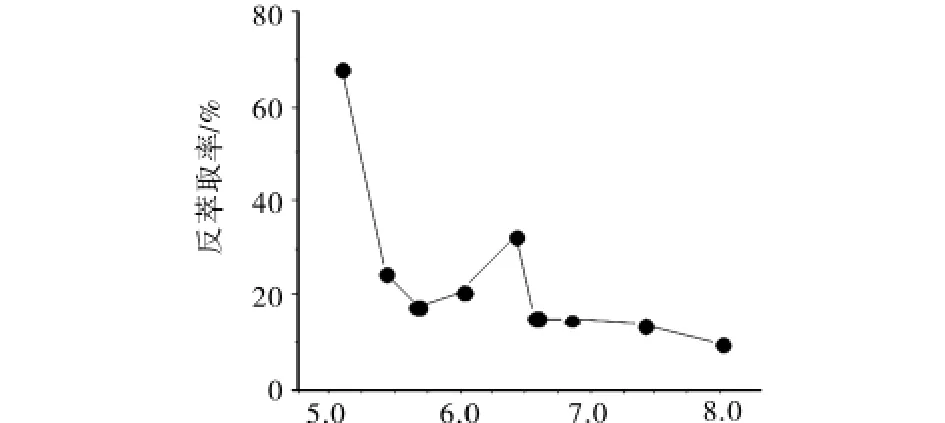
图10 酸度对反萃取率的影响Fig.10 Influence of pH for reversed extraction ratio
3 结语
以工程菌中被绿色荧光蛋白修饰的基因重组融合蛋白为对象,构建了聚乙二醇天冬氨酸修饰物PEG-ASP-Cu(Ⅱ)混合曲拉通 X-100-硫酸盐-水液-固萃取体系纯化该蛋白.探讨了在体系中适用的表征目标蛋白的荧光方法,通过实验确定了采用恒波长同步荧光法测定目标蛋白质,可排除萃取体系中其他因素如曲拉通 X-100、硫酸铵、PEG-ASP-Cu(Ⅱ)修饰物等对目标蛋白的测定影响,得出最佳测定条件:波长差Δλ=20 nm,发射狭缝宽度ExSlit=10.0 nm,激发狭缝宽度 EmSlit=15.0 nm.通过验证可知该萃取体系对目标蛋白正萃分离条件及反萃条件.实验证明:未加入修饰物的单纯萃取体系对目标蛋白一次萃取固相收得率最高可达89%;加入修饰物后,体系对目标蛋白的一次萃取固相收得率可提升并稳定至97%以上,最高可达100%,一次反萃取率达68%,该萃取体系应能实现分离纯化目标基因重组蛋白的目的.
[1]黄国存,朱生伟,董越梅,等.绿色荧光蛋白及其在植物研究中的应用[J].植物学通报,1998,15:24-30.
[2]徐飞虎,龚兴国.绿色荧光蛋白应用研究进展[J].细胞生物学杂志,2002,24(6):332-334.
[3]Chen Yu,Leong Susanna Su Jan.Adsorptive refolding of a highly disulfide-bonded inclusion body protein using anion-exchange chromatography[J].Journal of Chromatography A,2009,1216:4877-4886.
[4]Ceccaroli P,Cardoni C.Separation of hexokinase activity using different hydrophobic interaction chromatography support[J].Chromatogr B,1997,702:275-284.
[5]Sohel Dalala,Smita Raghavaa,Gupta M N.Single-step purification of recombinant green fluorescent protein on expanded beds of immobilized metal affinity chromatographymedia[J].Biochemical Engineering Journal,2008,12(1):301-307.
[6]李逢雨,孙小梅,李步海,等.修饰聚合物-盐水液-固亲和萃取体系分离纯化大豆中的氨基酸[J].中南民族大学学报:自然科学版,2003,22(4):6-7,15.
[7]邹 群,邹干朋.吐温80-硫酸钠液-固萃取分离头孢拉定[J].武汉工业学院学报 ,2004,23(2):60-62.
[8]尤 伟,沈静茹.聚乙二醇修饰物PEG-Asp-Cu(Ⅱ)的合成及应用[J].中南民族大学学报:自然科学版,2005,24(24):12-14.
[9]沈静茹,靳光才,韦 康,等,恒波长同步荧光法测定吐温80-硫酸铵液固萃取体系中绿色荧光蛋白标记的融合蛋白[J].中南民族大学学报:自然科学版,2010,29(1):22-27.

