β-防御素-1,2在实验性大鼠牙龈炎牙周炎模型牙龈上皮组织中的表达
徐 莉,董福生,许丽华,蒋强国,李 彬,段立立
(河北医科大学口腔医学院,河北石家庄 050017)
β-防御素-1,2在实验性大鼠牙龈炎牙周炎模型牙龈上皮组织中的表达
徐 莉,董福生,许丽华,蒋强国,李 彬,段立立
(河北医科大学口腔医学院,河北石家庄 050017)
目的:通过建立大鼠牙龈炎、牙周炎模型并检测大鼠β-防御素-1,2(RBD-1,RBD-2)在其牙龈上皮三个区域的分布,探讨RBD-1、RBD-2在大鼠牙龈炎牙周炎发生、发展过程中的变化。方法:用正畸结扎丝结扎大鼠双侧上颌第一磨牙,经临床和HE组织学染色确认结扎后2周、6周大鼠牙龈炎、牙周炎模型建立成功后,取大鼠上颌骨连同牙和牙周组织,制备切片,SP免疫组化染色法检测正常组、牙龈炎组、牙周炎组大鼠牙龈上皮中RBD-1、RBD-2的表达。结果:RBD-1、RBD-2在三组的牙龈上皮中都有表达,主要表达于口腔龈上皮棘细胞层和颗粒层细胞胞浆,在沟内上皮棘细胞层呈微弱表达,结合上皮、结缔组织、骨组织无表达;RBD-1在口腔龈上皮的表达强度各组无明显差异(P>0.05);RBD-2则在牙龈炎组表达强度显著升高,在牙周炎组表达强度显著降低(P<0.05);RBD-1、RBD-2在沟内上皮的表达则为牙龈炎组和牙周炎组显著低于正常组(P<0.05)。结论:RBD-1在大鼠牙龈上皮中呈组成性表达,而RBD-2的表达随炎症发展而改变;提示防御素在牙周组织的健康维护和牙周炎症进展中均起重要作用。
牙龈炎;牙周炎;牙龈上皮;大鼠β-防御素-1,2;免疫组化
[牙体牙髓牙周病学杂志,2011,21(1):6]
[Chinese Journal of Conservativedentistry,2011,21(1):6]
口腔上皮系统的天然免疫防御作用对牙周组织的健康维持非常重要。其中围绕牙周组织并与牙体颈部紧密相连的牙龈上皮是外来刺激进入牙周组织深部的入口,由口腔龈上皮(oral epithelium,OE)、沟内上皮(sulcular epithelium,SE)和结合上皮(junctional epithelium,JE)3个区域共同组成抵御外来刺激的第一道防线,但其组织学结构各不相同,功能复杂,除机械屏障、微生物屏障等作用外,还具有由防御素、溶菌酶和趋化因子等组成的化学屏障。其中β-防御素(beta-defensins,BDs)是上皮分泌的一类小分子抗微生物多肽,对病原体尤其是G-菌和真菌,如大肠杆菌、绿脓杆菌、牙龈卟啉单胞菌、具核梭杆菌及伴放线放线菌等有直接杀伤作用,还与其他蛋白酶有协同作用,是其化学屏障的重要组成部分。BD-1、BD-2是β-防御素家族中两个代表性的多肽,BD-1一般为固有性表达,而BD-2的表达则随外来刺激或炎症程度的变化而改变,但两者在牙龈上皮3个不同区域的表达方式及其与炎症程度的关系尚不明确。本研究通过结扎大鼠双侧第一磨牙建立牙龈炎和牙周炎模型,检测各炎症阶段BD-1、BD-2在不同区域的表达变化,从分子水平探讨BD-1、BD-2在牙周炎症发展过程中的作用。
1 材料和方法
1.1 主要材料和仪器
纯种6月龄雄性Wistar大鼠(河北医科大学实验动物中心);超薄石蜡切片机(莱卡RM2015,德国);电热恒温水箱(上海医疗器械七厂);光学显微镜(奥林巴斯,日本);多功能照相显微镜(奥林巴斯 BX51T-PHD-J11,日本);水合氯醛、EDTA(分析纯,天津市永大化学试剂开发中心),兔抗RBD-1多克隆抗体、兔抗RBD-2多克隆抗体、兔SP试剂盒(北京博奥森生物技术有限公司);DAB显色剂(北京中杉金桥有限公司)。
1.2 方法
1.2.1 牙龈炎和牙周炎动物模型的建立
取体质量300g左右6月龄雄性Wistar大鼠30只,随机分为正常对照组、牙龈炎组、牙周炎组,每组10只。牙龈炎和牙周炎组大鼠用100 mL/L水合氯醛(350 mg/kg)麻醉后,以直径0.2 mm的正畸结扎丝结扎每只大鼠双侧上颌第一磨牙颈部,并置于龈下,在腭侧打结。从实验当天起饲以软食和高糖水(100g/L)。正常对照组除施以同样的麻醉外,不作任何处理,与两实验组相同环境下饲以常规饲料和水。每日观察记录各组大鼠的活动状态、体质量、饮食、粪便等变化,同时检查结扎丝的稳固情况及牙周状况。
1.2.2 牙龈炎、牙周炎成模标准和确定
牙龈炎组于结扎后第2周,牙周炎组于结扎后第6周检查建模牙的牙周各指标,并于各组中随机抽取一只大鼠股动脉放血处死,取上颌骨(连同建模牙及其牙周组织)进行常规组织病理学观察,按以下标准确定建模是否成功。
牙龈炎成模标准:牙龈红肿、光亮,牙龈指数为1~2,牙龈出血指数为2~3,探诊出血阳性,无牙周袋形成和附着丧失;镜下可见牙龈上皮无明显糜烂或溃疡,结合上皮附着位置正常,组织中可见明显中性粒细胞浸润,毛细血管增生、扩张、充血,牙周膜纤维排列正常。
牙周炎成模标准:牙龈红肿增生、有菌斑堆积,牙龈指数为2~3,牙龈出血指数为3~4,探诊出血阳性位点增多,可探及牙周袋,附着丧失1~2 mm以上;镜下可见牙龈组织炎症明显,沟内上皮有糜烂或溃疡,结合上皮与牙体结合不紧密并向根方增殖,固有层大量淋巴细胞、中性粒细胞浸润,牙周膜内血管扩张,牙周膜纤维排列紊乱;牙槽骨边缘可见到明显的破骨细胞和骨吸收陷窝。
1.2.3 免疫组化染色观察
牙龈炎组于结扎后2周,正常组、牙周炎组于结扎6周后分别通过股动脉放血处死各组大鼠,取连同建模牙及其牙周组织的上颌骨组织块,置100 mL/L甲醛液中4℃固定1周,蒸馏水彻底冲洗后,置100g/L EDTA溶液中脱钙40d。0.01 moL/L PBS(pH7.4)漂洗12 h,乙醇梯度脱水,石蜡包埋,沿牙体长轴制作颊舌向组织切片,片厚4 μm。切片脱蜡至水,30 mL/L过氧化氢液封闭内源性酶30 min,0.01 mol/L PBS洗,羊血清封闭非特异结合位点,滴加1∶200稀释的兔抗RBD-1或RBD-2,4℃过夜,PBS洗,SP法标记相应特异性抗原,DAB显色,苏木素复染,常规脱水,透明,封片。阴性对照和空白对照分别用一抗同种血清和PBS代替一抗。
结果判定:细胞浆中出现淡黄色至棕黄色颗粒,且着色高于背景底色者为阳性,细胞胞浆内不着色或呈浅棕色背景颜色者为阴性。400倍显微镜下连续拍照,每个标本随机取5个不同视野应用图像分析系统进行阳性细胞计数,取均值。
1.3 统计学处理
所得数据应用SPSS13.0统计软件进行单因素方差分析,用SNK法进行两两比较,检验水准α=0.05。
2 结果
2.1 大鼠上颌第一磨牙牙龈炎、牙周炎建模结果
正常对照组大鼠上颌第一磨牙牙龈呈粉红色,质韧,边缘锐,探诊不出血,无牙周袋形成。组织学观察沟内上皮完整,有角化,结合上皮位置正常,无明显炎症细胞浸润,牙龈、牙周膜纤维排列有序、规律,牙槽骨边缘整齐,未见破骨细胞(图1a)。牙龈炎组大鼠(结扎2周后)上颌第一磨牙牙龈呈暗红色,龈乳头龈缘红肿,探诊出血,但未探及明显的牙周袋。组织学观察可见沟内上皮完整,结合上皮位置正常,牙龈结缔组织水肿明显,有中性粒细胞浸润,毛细血管数目增多。上皮钉突数目增多,伸长,牙周膜纤维排列正常,牙槽骨边缘整齐,未见破骨细胞(图1b);牙周炎组大鼠(结扎6周后),除牙龈红肿、菌斑堆积增多、探诊出血加重外,还有附着丧失,可探及牙周袋。组织学观察可见牙龈组织增生,沟内上皮溃疡、坏死,结合上皮向根方增殖,上皮和固有层内有大量淋巴细胞浸润,牙周膜纤维排列紊乱,毛细血管数目增多、管腔扩大,牙槽骨边缘可见破骨细胞(图1c)。

图1 大鼠上颌第一磨牙结扎后不同时间的牙龈上皮HE染色(×200)
2.2 RBD-1、RBD-2 免疫组化染色结果(图2~3,表1~2)
RBD-1、RBD-2在正常、牙龈炎、牙周炎组的牙龈组织中均有表达,主要表达于口腔龈上皮棘层和颗粒层,在沟内上皮棘层有微弱表达,结合上皮、结缔组织、骨组织无表达。阳性染色位于细胞胞浆和胞膜,以棘层细胞着色最强,基底细胞未见明显着色。
表1 RBD-1在口腔龈上皮和沟内上皮的表达(±s)

表1 RBD-1在口腔龈上皮和沟内上皮的表达(±s)
▲口腔龈上皮与沟内上皮相比P<0.05,★牙龈炎组、牙周炎组与正常组相比P<0.05
分组 龈上皮 沟内上皮正常组 38.73 ± 6.81▲25.30 ±4.95牙龈炎组 37.34±3.73▲ 18.78±3.31★牙周炎组 37.02±5.82▲ 17.00±6.53★
表2 RBD-2在口腔龈上皮和沟内上皮的表达(±s)
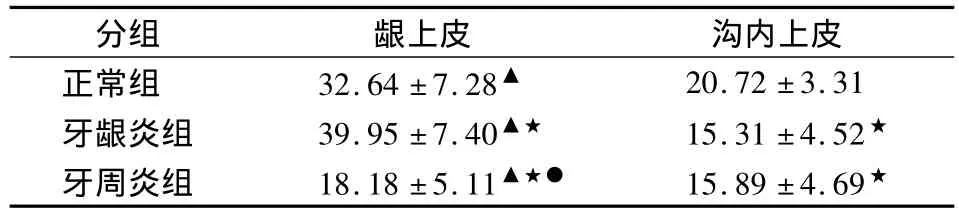
表2 RBD-2在口腔龈上皮和沟内上皮的表达(±s)
▲口腔龈上皮与沟内上皮相比P<0.05,★牙龈炎组、牙周炎组与正常组相比P<0.05,●牙周炎组与牙龈炎组相比P<0.05
分组 龈上皮 沟内上皮正常组 32.64 ±7.28▲20.72 ±3.31牙龈炎组 39.95±7.40▲★ 15.31±4.52★牙周炎组 18.18±5.11▲★● 15.89±4.69★

图2 大鼠上颌第一磨牙结扎后不同时间的牙龈上皮RBD-1免疫组化染色

图3 大鼠上颌第一磨牙结扎后不同时间的牙龈上皮RBD-2免疫组化染色(×200)
3 讨论
在有关β防御素与牙周炎关系的研究,由于人牙龈上皮取材较难,只能取得口腔龈上皮和部分沟内上皮,很难取到结合上皮;也不易观察同一个体不同炎症阶段的发展变化,因而受到许多限制。大鼠磨牙牙周组织的解剖生理结构与人类相似,主要区别是沟内上皮为角化上皮,而且牙周炎时其牙周组织的破坏也与人类极为相似。本研究选用大鼠为模型,观察RBD-1,RBD-2在正常和炎症状态下牙龈上皮三个区域的表达情况,为阐明β-防御素在牙周炎发生发展中的作用提供实验室依据。结果发现:各组RBD-1、RBD-2在口腔龈上皮的表达均显著高于相应沟内上皮,而在结合上皮中无表达,且二者在沟内上皮的表达均为牙龈炎组和牙周炎组明显低于正常组,这可能与不同部位的角化程度有关,因为BD-1和BD-2在过角化上皮中的表达水平显著高于角化和非角化上皮,大鼠沟内上皮虽有角化,但角化程度不如口腔龈上皮,且牙龈发生炎症时,会出现沟内上皮的溃疡、糜烂、变性,使棘层细胞破坏或消失。因此RBD-1、RBD-2在口腔龈上皮和沟内上皮、结合上皮的表达差异,可能与其角化程度不同、沟内上皮的完整性在炎症时被破坏有关。
β-防御素-1(BD-1)是Bensch(1995)首次从肾衰病人血液透析中分离获得[1]。多数研究发现BD-1在正常及炎症状态下的表达在统计学上无显著差异,本结果也显示,RBD-1在正常组、牙龈炎组、牙周炎组口腔龈上皮组织中的表达无明显区别,进一步证明了RBD-1呈组成性表达,不受炎症状态的影响。提示RBD-1在维持正常口腔内的微生态平衡,保持牙龈组织健康的先天性免疫中起重要作用。而冯云等在有关人肺上皮细胞的研究中,则发现微生物或炎性因子可引起BD-1 mRNA的表达增强,但增强强度较BD-2低,可能是BD-1的表达有组织特异性,受不同部位上皮的组织特异性调控因子调节;也可能是基因与蛋白的表达不均衡性所致[2-3]。
有研究者利用原位杂交及RT-PCR技术检测,发现在呼吸道、包皮、胃肠道、口腔上皮等组织中BD-2呈少量表达,而当这些部位受到炎性刺激时,HBD-2则会大量表达,认为BD-2是诱导型防御素[4-5]。本研究结果显示:RBD-2 在正常组、牙龈炎组和牙周炎组的口腔龈上皮组织中均有表达,在牙龈炎组呈高表达,与其他研究的诱导性表达一致。但在正常组也有中等强度的表达,而牙周炎组的表达则低于正常组,其原因可能是在健康口腔环境下,也有诱导RBD-2表达的因素存在。据报道:RBD-2可在感染状态、细菌毒性产物(如脂多糖)、炎症因子 TNF-α、IL-1β、IL-8、具核梭杆菌(Fn)等的刺激下表达上调[6],其中 Fn为口腔常见共生菌,在正常口腔状态下也可多量存在。体外实验也表明:培养的牙龈上皮细胞中加入Fn的细胞壁提取物,能上调上皮细胞RBD-2的表达,因此,在口腔共生菌大量存在的情况下,健康牙龈上皮亦可表达较强的BD-2,而牙龈炎状态下表达量进一步增加可能是因为炎症时细菌及其产物和炎性细胞因子等诱导因子大量增多的缘故。本研究结果提示RBD-2在牙龈口腔上皮的表达可能具有组成性和诱导性表达两种方式存在。而RBD-2在牙周炎组表达量降低,与李雅灵等的研究结果一致[7],可能与长期慢性炎症状态下牙周局部各种诱导因子和牙龈上皮细胞本身的生物学特性改变等多种因素有关,与RBD-2的诱导性防御素特点可能并不矛盾。具体原因可能有以下几种:①在牙周炎症的不同阶段,局部存在的微生物种类不同,对RBD-2的调控作用可能有所不同。体外细胞培养的实验中除发现牙周共生菌具核梭杆菌Fn能在短时间内(2~4 h)上调牙龈上皮细胞表达BD-2 mRNA外,还发现牙周致病菌牙龈卟啉单胞菌(Pg)不能上调BD-2 mRNA的表达,且Pg的脂多糖(LPS)亦不能引起BD-2 mRNA的上调,随着炎症发展,局部Pg增多而Fn减少,对BD-2的诱导作用减弱[8],同时牙周炎时龈下菌斑致病菌群数量的增加导致了RBD-2的消耗,致使其表达减弱;应对牙周炎不同发展阶段的龈下菌群的种类和数量变化,各种细菌对防御素的诱导能力以及实验性大鼠牙周炎与人类牙周炎的区别作进一步研究。②RBD-2在炎症状态下被组织蛋白酶降解。Taggart等研究表明,在炎症状态下宿主半胱氨酸组织蛋白酶呈现过度表达可导致HBD-2的降解甚至失活[9]。③各种致炎因子在牙周炎不同阶段亦有复杂变化。虽然致炎因子(如 TNF-α、IL-1β 等)可诱导 RBD-2 表达上调,IL-4和IL-13却可抑制BD-2 mRNA在角化细胞的表达。④牙周长期处在炎症的状态下,牙龈上皮细胞会发生水肿、变形,使细胞活性发生改变,从而导致自身的分泌功能降低。⑤β-防御素还受环境的盐浓度、pH值、离子强度的影响,其确切机制有待于进一步的研究证明。
[1]Bensch KW,Raida M,Magert HG,et al.hBD-1:A novel beta-defensin from human plasma[J].Febs Lett,1995,368(2):331-336.
[2]冯云,黄宁,吴琦,等.卡介苗诱导人肺腺上皮细胞hBD-1mNRA的增强表达[J].华西医科大学学报,2000,31:28-32.
[3]Zhao CQ,Nguyen T,Liu LD,et al.Differential expression of caprine β-defensins indigestive and respiratory tissues[J].Infect Immun,1999,67(11):6221-6224.
[4]Abiko Y,Mitamura J,Nishimura M,et al.Pattern of expression of beta-defensins in oral squamous cell carcinoma[J].Cancer Lett,1999,143(1):37 -43.
[5]Bissll J,Joly S,JohnsongK,et al.Expression of beta-defensins ingingiva1 health and in Periodonta1disease[J].J Oral Pathol Med,2004.33(5):278- 285.
[6]Krisanaprakornkit S,Kimball JR,Weinberg A,et al.Inducible expression of human beta-defensin 2 by Fusobacterium nucleatum in oral epithelial cells:multiple signaling pathways and role of commensal bacteria in innate immunity and the epithelial barrier[J].Infect Immun,2000,68(5):2907 - 2915 .
[7]李雅灵.龈沟液HBD-2及IL-lβ水平与慢性牙周炎关系初步研究[D].中国优秀硕士学位论文全文数据库,2007,(10).
[8]Weinberg A,Krisanaprakornkit S,DaleB A.Epithelia antimicrobial peptides:review and significance for oral applications[J].Crit Rev Oral Biol Med,1998,9(4):399-414.
[9]Taggart CC,Greene CM,Smith SG,et al.Inativation of human beta-defendsin 2 and 3 elastolytic cathepsins[J].J Immunol,2003,171(2):931
The expression of β-defensin-1 and-2 ingingival epithelium in the ratgiginvitis and periodontitis model
XU Li,DONG Fu-sheng,XU Li-hua,JIANG Qiang-guo,LI Bin,DUAN Li-li
(College of Stomatology,Hebei Medical University,Shijiazhuang 050017,China)
AIM:To examine thedistribution of β-defensin-1(RBD -1)and β-defensin-2(RBD-2)in thegingival epithelial cells of rat models ofgingivitis and periodontitis,so as to further understand the role of RBD-1 and RBD-2 in the initiation anddevelopment of rat periodontal inflammation.METHODS:The bilateral maxillary first molars of rats were ligated for 2 and 6 weeks,gingivitis and periodontitis were confirmed by clinical observation and HE histological staining.The expression of RBD-1 and RBD-2 in thegingival tissues in the normal and testedgroups was examined by SP immunohistochemical staining.RESULTS:RBD-1 and RBD-2 expression could bedetected in thegingival epithelium of threegroups.RBD-1 and RBD-2 were primarilydetected in the oralgingival epithelium,weaklydetected in sulcular epithelium,but was notdetected in junctional epithelium,connective tissue and bone tissues.No significantdifference of RBD-1 expression in oral epithelium was found among the threegroups.However,RBD-2 expression was significantly higher ingingivitisgroup,and it was significantly lower in periodontitisgroup as compared with normalgroup.RBD-1 and RBD-2 expression in the sulcular epithelium ofgingivitis and periodontitisgroups was significantly lower than that in normal controlgroup.CONCLUSION:RBD-1 showed a constitutive expression pattern ingingival epithelium,while RBD-2 expression was changed with thedegree of periodontal inflammation,indicating that β-defensins have an important role in both healthy and inflammatory conditions of periodontal tissues.
book=7,ebook=482
gingivitis;periodontitis;gingival epithelium;RBD-1,RBD-2;immunohistochemistry
R780.2
A
1005-2593(2011)01-0006-05
2010-07-07;
2010-09-13
徐莉(1983-),女,汉族,山东德州人。硕士
许丽华,E -mail:xulh@hebmu.edu.cn

