不同粒径的人参总皂苷脂质体的制备
陈新梅
(山东中医药大学药学院,山东济南 250355)
粒径是评价脂质体质量的关键指标之一,粒径的大小能影响脂质体的吸收[1]、体内分布[2]、组织靶向性[3]、稳定性[4]、疗效及毒性[5]。本研究以人参总皂苷 (TSPG)为模型药制备脂质体,采用超声、加入吐温 -80、泊洛沙姆、PEG-4000、PEG-6000等方法来制备不同粒径的人参总皂苷脂质体。
1 材料
1.1 仪器 旋转蒸发仪 (上海亚荣生化仪器厂);UV-3010紫外分光光度计 (日本岛津);SB 2200型超声仪 (上海必能信超有限公司);AWM 2000型激光粒度散射仪 (英国马尔文公司)。
1.2 试药 蛋黄卵磷脂 (上海太伟药业有限公司);胆固醇(南京奥多福尼生物科技有限公司,进口分装);人参总皂苷(吉林省宏久生物科技股份有限公司)。
2 方法
2.1 UV法测定 TSPG的含量 具体测定方法参考文献[6]。
2.2 薄膜分散法制备不同粒径的 TSPG脂质体 精密称取处方量的蛋黄卵磷脂、胆固醇、TSPG溶解于 10 mL无水乙醇,40℃减压蒸发成膜,10 mL PBS缓冲液水化薄膜,形成乳白色的乳状液。
2.2.1 超声法 (编号 1) 按照 2.2项下的制备工艺制备TSPG脂质体,将其置于超声仪中超声 10 min,即得。
2.2.2 加入 Tween-80(编号 2) 称取处方量蛋黄卵磷脂、胆固醇、TSPG,按照所制得的脂质体乳状液体积的 1%量取Tween-80加入。然后按照 2.2项下的制备工艺制备 TSPG脂质体,即得。
2.2.3 加入 PEG-4000(编号 3) 称取处方量蛋黄卵磷脂、胆固醇、TSPG,按照所用蛋黄卵磷脂的 5%量取 PEG-4000加入。然后按照 2.2项下的制备工艺制备 TSPG脂质体,即得。
2.2.4 加入 PEG-6000(编号 4) 称取处方量蛋黄卵磷脂、胆固醇、TSPG,按照所用蛋黄卵磷脂的 5%量取 PEG-6000加入。然后按照 2.2项下的制备工艺制备 TSPG脂质体,即得。
2.2.5 加入泊洛沙姆 (编号 5) 称取处方量蛋黄卵磷脂、胆固醇、TSPG,按照 2.2项下的制备工艺,使用含 5%泊洛沙姆的 PBS缓冲液制备 TSPG脂质体,即得。
2.2.6 加入泊洛沙姆、Tween-80(编号 6) 称取处方量蛋黄卵磷脂、胆固醇、TSPG,按照所制得的脂质体乳状液体积的1%量取 Tween-80加入。按照 2.2项下的制备工艺,使用含 5%泊洛沙姆的 PBS缓冲液制备 TSPG脂质体,即得。
2.2.7 加入泊洛沙姆、Tween-80,并进行超声 (编号 7)按照 2.2.6项的制备工艺制备 TSPG脂质体,将其置于超声仪中超声 10 min,即得。
2.3 不同粒径的 TSPG脂质体包封率、载药量 取 TSPG脂质体 1 mL置于透析袋内,透析袋外为 PBS缓冲液 100 mL。在 37℃、300 r·min-1条件下进行动态透析试验。分别于 0、1、2、3、4、5、6 h吸取透析袋外液 10 mL,并补加等量新鲜 PBS缓冲溶液。采用UV法测定透析液中的 TSPG浓度。根据下式计算包封率、载药量:
包封率%=(1-透析液中 TSPG的含量/脂质体中 TSPG的含量)×100%
载药量%=(脂质体中 TSPG的含量/固体膜材的总投入量)×100%
2.4 粒径的测定 将制备的 TSPG脂质体乳状液充分振摇后,分别取适量用AWM 2000型激光粒径测定仪测其粒径及分布。
3 结果与分析
3.1 辅料对 TSPG含量测定的影响 TSPG的最大吸收波长见图 1。泊洛沙姆、PEG-4000、PEG-6000、吐温 -80溶液在 200~400 nm的 UV扫描图见图 2~5,TSPG在 202 nm处呈现最大吸收,泊洛沙姆、PEG-4000、PEG-6000、Tween -80在此处无吸收,对 TSPG的含量测定无影响。
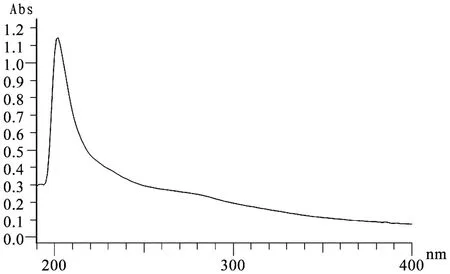
图1 100μg·mL-1人参总皂苷溶液在200~400 nm的紫外扫描图

图 2 5%泊洛沙姆溶液 200~400 nm的紫外扫描图

图 3 2.5%PEG-4000溶液 200~400 nm的紫外扫描图

图 4 2.5%PEG-6000溶液 400~200 nm的紫外扫描图

图 5 1%吐温 -80溶液 400~200 nm的紫外扫描图
3.2 不同粒径的 TSPG脂质体的包封率与载药量见表 1。
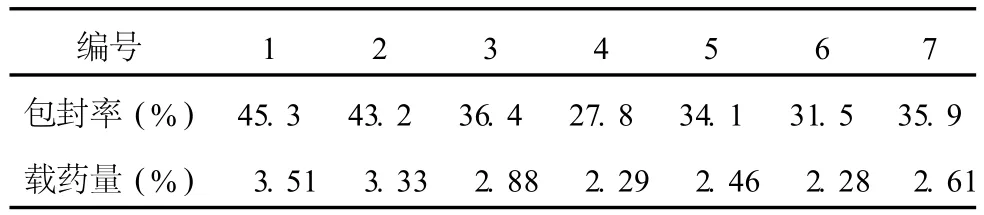
表 1 不同粒径 TSPG脂质体的包封率与载药量
3.3 TSPG脂质体的粒径 TSPG脂质体的粒径结果见表 2,脂质体粒径分布见图 6~11。
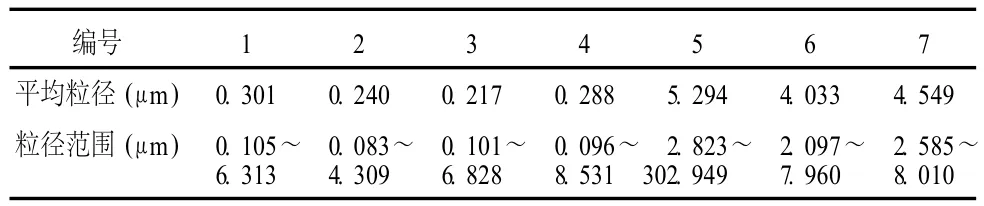
表 2 不同方法制备的人参总皂苷脂质体的粒径

图 6 粒径分布图(编号 1)
图 7 粒径分布图(编号 2)
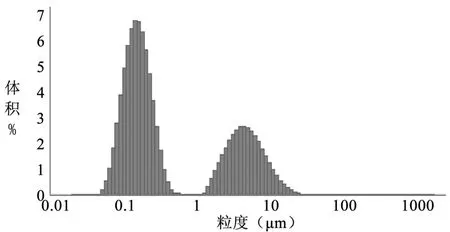
图 8 粒径分布图(编号 3)

图 9 粒径分布图(编号 4)
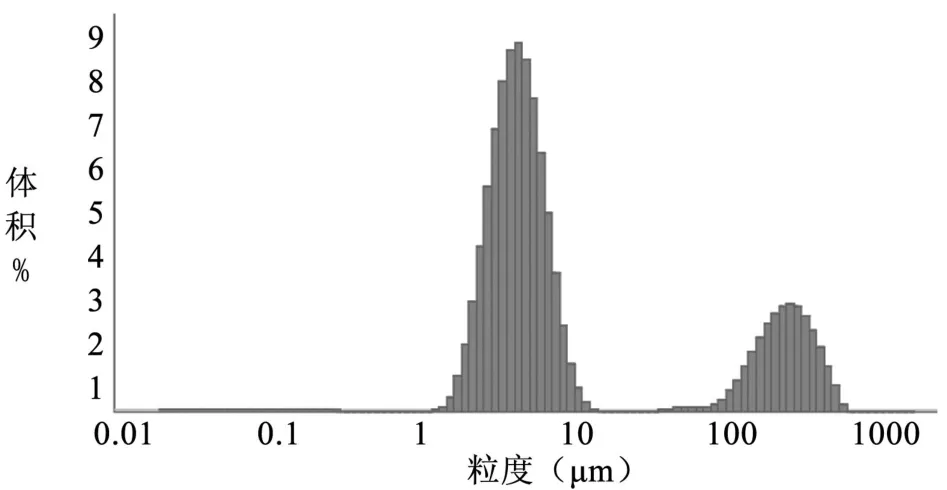
图 10 粒径分布图(编号 5)
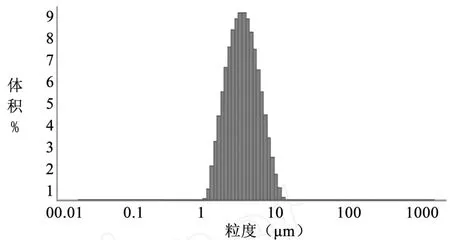
图 11 粒径分布图(编号 6)
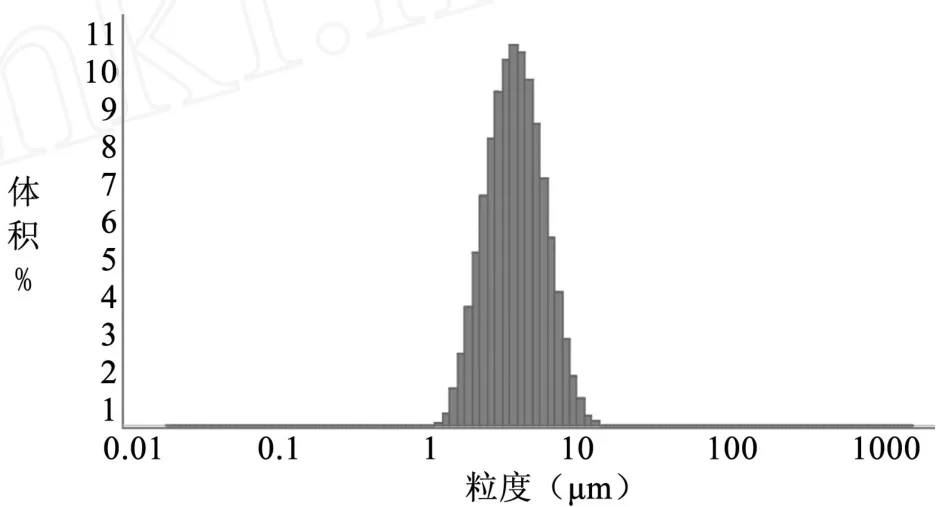
图 12 粒径分布图(编号 7)
4 讨论
本研究采用超声法、加入吐温 -80、泊洛沙姆、PEG-4000、PEG-6000等的方法制备了不同粒径的 TSPG脂质体。超声法利用超声波在液体中的分散效应,使液体产生空化的作用,达到减小粒径的目的;吐温 -80、泊洛沙姆属于表面活性剂,能降低脂质体的粒径;PEG-4000和 PEG-6000常作为长循环脂质体的修饰材料,因此本研究也考察了其对粒径的影响。不同粒径的脂质体,其包封率和载药量亦有差别,因此在考察脂质体的粒径时,必须同时结合包封率和载药量同时判定才具有意义。
[1] 孙维彤,邹伟伟,李爱国,等.脂质体粒径对促进托氟啶口服吸收的影响 [J].山东大学学报 (医学版),2007, 45(6):639-643.
[2] 周卫,平其能,王丽杰.羟喜树碱脂质体的粒径对组织分布的影响[J].中国药科大学学报,2005,36(2):125 -128.
[3] 杨莉斌,胡荣.抗肿瘤药物脂质体粒径对肿瘤靶向性的影响[J].国外医学 (药学分册),2007,34(3):174-177.
[4] 邹佳,于彬,宋阳,等.粒径和质量浓度对辅酶 Q10脂质体光解动力学的影响[J].沈阳药科大学学报,2010,27 (1):24-28.
[5] 王金戌,李春雷,张兰,等.粒径对米托蒽醌脂质体疗效及毒性的影响 [J].河北医科大学学报,2008,29(4): 555-556.
[6] 陈新梅.人参总皂苷脂质体的制备及质量评价[J].齐鲁药事,2001,30(2):63-64.
- 药学研究的其它文章
- 丁基胶塞对大输液不溶性微粒的影响及解决办法

