紫杉醇长效PLGA微球的制备、性质及其在体内抗H22型肝癌的疗效
吕 伟 裴 瑾 王 斓 张海锋 柳怀玉 韩 冰 (吉林大学药学院生物药学系,吉林 长春 300)
紫杉醇长效PLGA微球的制备、性质及其在体内抗H22型肝癌的疗效
吕 伟 裴 瑾 王 斓1张海锋 柳怀玉2韩 冰 (吉林大学药学院生物药学系,吉林 长春 130021)
目的 制备长效紫杉醇聚乳酸-羟基乙酸共聚物(PLGA)微球,对微球的常规理化特性、体外释放特性进行考察并对该微球的抗肝癌疗效进行鼠体内评估。方法 采用单乳溶剂挥发法制备紫杉醇PLGA微球成功后利用激光粒度分析仪测定其平均粒径,利用扫描电镜观测微球表面形貌,对3批微球样品进行载药量及体外释放检测,构建小鼠H22肝癌模型,以瘤内方式给药,给药15 d后观测肿瘤病理切片,评估疗效。结果 微球表观平整,形态圆滑,平均粒径为36.4μm,3批样品平均载药量为7.42%,可维持30 d左右的体外释放,体内实验显示微球具备良好抗H22型肝癌疗效。结论 所制备的紫杉醇PLGA缓释微球具备良好的理化特性、体外释放特点并具备良好的抗肿瘤疗效。
紫杉醇;PLGA;微球;H22型肝癌
紫杉醇是从植物紫杉中提取的一种化合物,是近些年来发现的一种高效抗肿瘤药物〔1〕,其高效的抗肿瘤特性已在包括卵巢癌、乳腺癌、非小细胞肺癌等肿瘤的治疗方面得到了验证〔2~4〕。作为细胞微观的特异性稳定剂,紫杉醇可促进微管蛋白聚合,抑制解聚,从而抑制细胞的有丝分裂,使肿瘤细胞周期中止,由此起到抗肿瘤功效〔5〕。有研究将紫杉醇用于肝癌治疗,发现紫杉醇可影响肝癌细胞的细胞外信号转导,从而引起细胞凋亡,并且可抑制肝肿瘤组织血管形成及肝癌细胞转移〔6〕。对紫杉醇进行剂型改造,保护药物,延长其体内存留时间是近年来研究热点。本研究在紫杉醇具备良好的抗肝癌疗效的基础上,进一步将其制备成了紫杉醇PLGA缓释微球剂型,延长了紫杉醇发挥抗肿瘤作用的时间,提高其生物利用度。对制备得到的微球进行了表观形貌、粒径、载药量、体外释放等特性的分析,并以H22肝癌模型小鼠为实验对象研究了紫杉醇微球的动物体内抗肿瘤药效。
1 材料与方法
1.1 材料 紫杉醇购于Sigma公司;PLGA购于美国Lakeshore公司;二氯甲烷、乙腈等常规试剂购于北京化工;BS124S型电子天平(德国Sartorious公司);JY88-IIN型超声细胞破碎仪(宁波新芝);高速匀浆器(德国IKA公司);马尔文2000激光粒度分析仪(英国Malvern公司);日立S-2700扫描电镜(日本Hitachi公司);高效液相色谱仪(德国Agilent公司)。
1.2 紫杉醇PLGA微球的制备 取一定量的PLGA,加入二氯甲烷溶液中,制备成乳状溶液,向其中加入一定量的紫杉醇和PLGA的二氯甲烷溶液共同溶解,超声处理。将此溶液逐滴加入到30 ml聚乙烯醇(PVA)水溶液中,高速搅拌,之后加水稀释,将PVA浓度控制在2%,500 r/min低速搅拌2 h。将外水相滤出,对剩余溶液进行反复离心、洗涤。最后向其中加入2.5%的甘露醇进行冻干。
1.3 微球的表面形貌观测及粒径测定 取一定量的微球样品经过包埋并进行镀金处理后利用扫描电镜进行表面形貌的观测。利用激光粒度分析仪对微球的粒径进行测定。
1.4 微球的载药量测定 取5 mg微球样品,将之置于10 m l离心管底部,向其中加入2 ml二氯甲烷溶液,静置2 min,将微球溶解后加入5 ml50%的乙腈溶液,涡旋振荡处理,通入氮气挥发二氯甲烷,之后利用高效液相对紫杉醇进行检测,利用上述方法对3批制备得到的微球分别进行载药量测定。
1.5 微球的体外释放检测 取20 mg微球样品,置于10 m l离心管底部,加入5 m l pH7.0 PBS缓冲液,封口膜封口,将离心管置于37℃的摇床中,120 r/min进行摇动,固定时间点离心,取出4 m l上清液,其中20 ml用于液相检测,其余弃掉,同时向离心管中补充4 ml新鲜PBS缓冲液,使释放继续进行。每到相应检测时间点重复上述检测。共对3批制备得到的微球样品进行体外释放检测,绘制3批样品的平均释放曲线。
1.6 微球抗肝癌疗效试验 利用H22腹水型肝癌小鼠的腹水,对昆明小鼠进行腹腔接种,连续接种5代,得到稳定的H22肝癌腹水瘤小鼠后再次抽取其腹水,细胞计数,调整肿瘤细胞浓度至5×106m l-1,接种于昆明小鼠前肢足垫,待肿瘤体积增长至1 cm3时造模成功。选取30只模型鼠,随机分为3组,每组10只。包括阴性对照组(瘤内注射生理盐水,首次给药作为实验第1天,之后每隔5 d注射一次,共注射5次);阳性对照组(瘤内注射9 mg/kg常规紫杉醇,首次给药作为实验第1天,之后每隔5 d注射一次,共注射5次);微球给药组(一次性瘤内注射45 mg/kg紫杉醇微球,按紫杉醇计)。以28 d为一个给药周期,首次给药28 d后处死所有动物,取肿瘤组织制片,镜检。
2 结果
2.1 微球的表面形貌及粒径 所得到的微球表观平整,形态圆滑(图1)。微球的平均粒径为36.4μm。
2.2 微球的载药量 3批微球载药量分别为7.34%、7.52%、7.41%,平均7.42%,各批次制备的微球载药量无显著差异(P<0.05),证明微球制备的工艺重现性良好。
2.3 微球的体外释放 3批微球的体外释放曲线见图2,微球的体外药物释放均匀,释放周期可维持30 d左右,在整个释放周期内可实现接近90%的药物积累释放。

图1 紫杉醇PLGA微球表观形貌
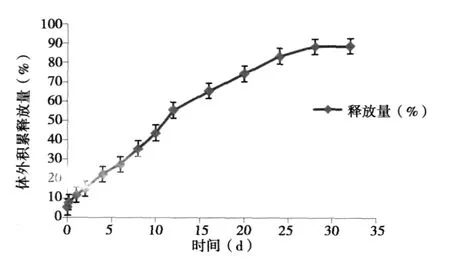
图2 紫杉醇PLGA微球的药物体外释放曲线
2.4 微球抗肝癌疗效 首次给药28 d后对不同实验分组小鼠的肝癌实体瘤进行病理切片检测,阴性对照组瘤组织肿瘤细胞散在分布,结节不清,绝大部分细胞核巨大,呈低分化状态;阳性对照组瘤组织脂肪为散在部分,多数肝细胞呈低分化状态;微球给药组瘤组织发生部分脂肪变,肝细胞呈条索状分布,边界较为清晰,切面较均匀(图3)。紫杉醇微球制剂可明显抑制肿瘤的恶性分化,并且比常规紫杉醇制剂具备更好的抑瘤疗效。到了广泛应用。与脂质体等包埋辅料相比,利用PLGA作为缓释材料可使药物在体内存留的时间更长,发挥药效时间更持久,本研究所制备的微球在体外可持续释放30 d左右,有利于肝癌的长期治疗。已上市微球制剂的给药方式多采取皮下给药或肌肉给药〔10,11〕,两种给药方式均属于组织局部给药,微球给药方式的选择与微球药物体内药代动力学相适应,随着PLGA生物相容性材料在体内的缓慢降解,药物可实现在微球植入靶点的逐渐释放。本研究制备得到的微球采取瘤内直接注射的给药方式,实现了针对肿瘤靶点的治疗。从首次给药28 d后的肿瘤病理切片的观测上也充分印证了所制备的紫杉醇微球具备良好的抗肿瘤疗效。

图3 不同实验分组肝癌病理切片对比(×40)
3 讨论
已有研究将紫杉醇装载于脂质体、明胶、PLA〔7~9〕等材料中实现药物缓释。所选择的缓释材料既要具备良好的生物相容性又要求其降解特性满足预期药物发挥作用的时间。PLGA作为新型的药物包埋辅料,以其无毒、生物相容性良好的特点得
1 Hájek R,Vorlicek J,Slavik M.Paclitaxel(Taxol):a review of its antitumor activity in clinical studiesminireview〔J〕.Neoplasma,1996;43(3):141-54.
2 Bishop JF,Dewar J,Toner GC,et al.Paclitaxel as first-line treatment for metastatic breast cancer.The Taxol Investigational Trials Group,Australia and New Zealand〔J〕.Oncology(Williston Park),1997;11(4):19-23.
3 Markman M,Kennedy A,Webster K,et al.Phase Ⅰ trial of paclitaxel plusmegestrol acetate in patientswith paclitaxel-refractory ovarian cancer〔J〕.Clin Cancer Res,2000;6(11):4201-4.
4 Fidias P,Supko JG,Martins R,etal.A phaseⅡ study ofweekly paclitaxel in elderly patients with advanced non-small cell lung cancer〔J〕.Clin Cancer Res,2001;7(12):3942-9.
5 Hsiao JR,Leu SF,Huang BM.Apoptoticmechanism of paclitaxel-induced cell death in human head and neck tumor cell lines〔J〕.JOral Pathol Med,2009;38(2):188-97.
6 LuiWY,Chang YF,Li LL,etal.Differential paclitaxel-induced cytotoxicity in rodent and human hepatoma cell lines〔J〕.Anticancer Res,1998;18(5A):3339-45.
7 Zhang Q,Huang XE,Gao LL.A clinical study on the premedication of paclitaxel liposome in the treatment of solid tumors〔J〕.Biomed Pharmacother,2009;63(8):603-10.
8 Liu J,Meisner D,Kwong E,et al.Translymphatic chemotherapy by intrapleural placement of gelatin sponge containing biodegradable Paclitaxel colloids controls lymphatic metastasis in lung cancer〔J〕.Cancer Res,2009;69(3):1174-81.
9 Yin H,Chow GM.Effectsof oleic acid surface coating on the propertiesof nickel ferrite nanoparticles/PLA composites〔J〕.JBiomed Mater Res A,2009;91(2):331-41.
10 Murty SB,Thanoo BC,WeiQ,etal.Impurity formation studieswith peptide-loaded polymericmicrospheres Part I.In vivo evaluation〔J〕.Int J Pharm,2005;297(1-2):62-72.
11 Kim H,Park H,Lee J,et al.Highly porous large poly(lactic-co-glycolic acid)microspheres adsorbed with palmityl-acylated exendin-4 as a longacting inhalation system for treating diabetes〔J〕.Biomaterials,2011;32(6):1685-93.
R735.7
A
1005-9202(2011)12-2284-02
1 沈阳药科大学制药工程学院化学实验中心
2 吉林大学动物实验中心
韩 冰(1980-),男,讲师,博士,主要从事药物制剂研究。
吕 伟(1984-),男,硕士,主要从事药物制剂研究。
〔2010-11-10收稿 2011-03-07修回〕
(编辑 张 慧)

