WIP1对小鼠B细胞及T细胞发育的影响
陈陟阳,张俊伶,马小茗,易微微,陈显达,石桂英,鞠振宇
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
W IP1(wild-type p53-induced phosphatase)是一种核蛋白,为丝氨酸/苏氨酸特异蛋白磷酸酶2C型家族(serine/threonine specific protein phosphatase type 2C,PP2C)中的一员,由 PPM1D (protein phosphatase magnesium-dependent 1 delta)基因编码,介导众多DNA损伤应急信号通路[1]。W IP1表达非常广泛,通过 RT-PCR证实在小鼠胚胎和成体几乎各个脏器组织均有 W IP1 mRNA的表达,包括乳腺、子宫、卵巢、肾上腺、皮肤、肝脏和睾丸等组织均检测到该基因的表达,特别在睾丸中表达量明显增高。缺失WIP1的小鼠能够正常生产,但是却显示出一系列的产后缺陷,主要体现在雄性小鼠发育不全,生殖器官萎缩,W IP1-/-雄性小鼠的睾丸发育不全,生育力下降及生命期限缩短。缺失 WIP1小鼠表现出对病原体易感性增强[2]。WIP1基因在许多人类癌症,特别是乳腺癌中过表达,而敲除PPM1D基因的小鼠能够抵抗乳腺癌的发生,暗示W IP1可能是一个致癌基因[3,4]。在 APCmin肠癌小鼠模型中,W IP1基因缺失通过促进小肠干细胞的凋亡,调控小肠干细胞稳态,有效抑制肿瘤生成[5]。在小鼠胸腺发育中,由于W IP1基因缺失导致 P53的持续激活,致使T细胞发育障碍[6]。.在神经系统中,WIP1通过P53依赖途径调控神经干祖细胞的自我更新[7]。此外在对衰老的研究中WIP1基因同样引起关注,伴随着衰老的进行W IP1基因的表达降低,导致胰岛 β细胞自我更新及增值能力下降[8]。综合前期结果提示,W IP1基因参与细胞增殖、凋亡等众多信号通路,对DNA损伤修复[9]、癌症的发生、细胞稳态的调控[10]及抗衰老起重要的作用。然而,目前还没有研究报道过W IP1基因对骨髓B细胞发育的影响。为了研究W IP1基因是否直接参与调控成年小鼠B细胞及T细胞的发育,我们利用基因敲除小鼠及流式细胞术为工具研究W IP1基因对成年小鼠B细胞及T细胞发育的影响。
1 材料和方法
1.1 PCR方法鉴定W IP1-/-小鼠基因型
小鼠在出生10 d用剪趾法标记,收集剪下的组织,裂解组织提取基因组DNA,PCR鉴定基因型,反应条件:94℃预变性3 min;变性94℃ 30 s,退火61℃30 s,延伸72℃ 30 s,40个循环;72℃延伸10 min。鉴定 引 物 为 Wip1 WT primer1: 5'-GACAGTCCTGTGCCAAAATGCT-3';Wip1 WT primer2:5'-GGTGACTTGATTGGTGGTGTAGA-3';Wip1 KO primer A: 5'-GCAGGGCTGTTTGTGGTGCT-3';Wip1 KO primer B:5'-GCATGCTCCAGACTGCCTT-3',W IP1 -/-产物长度176 bp,WT产物长度236 bp,PCR试剂购自上海生工生物技术有限公司,中国(图1)。
1.2 流式细胞术分析
1.2.1 骨髓单细胞悬液制备:实验使用成年3月龄129小鼠,颈椎脱臼牺牲小鼠,取双腿胫骨、股骨用预冷的PBS冲出骨髓腔的骨髓细胞,吹打成单细胞悬液,过滤、计数,调整浓度至1×108cell/m L。本实验使用小鼠均来自北京协和医学院比较医学中心,动物生产许可证号:SCXK(京)2009-0007,动物使用许可证号:SYXK(京)2005-0001。
1.2.2 骨髓B细胞及粒细胞染色方案 取10 uL全骨髓细胞悬液置于96孔板一孔中,加入 B220/ PE-cy7(Biolegend)、CD11b/APC-cy7(Biolegend)抗体,冰上避光孵育 30 min,加入 200 uL staining medium(PBS+1%BSA),400 g/m in,离心5 m in,弃上清后用200 uLstaining medium重新悬浮细胞,200目滤网过滤至流式管中准备流式分析,每只小鼠收集1 ×105细胞,计算 B220/PE-cy7阳性细胞及CD11b-APC-cy7阳性细胞所占的比例。
1.2.3 骨髓B细胞发育染色方案 取10 uL全骨髓细胞悬液至于 96孔板一孔中,加入 IgD/FITC (Biolegend)、CD43/Percp-cy5.5(Biolegend)、B220/ PE-cy7(Biolegend)、IgM/APC(Biolegend)抗体,冰上避光孵育30 min,加入200 uL staining medium(PBS +1%BSA),400 g/m in离心 5 m in,弃上清后用200 uL staining medium重新悬浮细胞,200目滤网过滤至流式管中准备流式分析,每只小鼠收集1× 105细胞,计算B220+CD43-IgM-IgD-(Pre-B);B220+CD43-IgM+IgD-(immature-B);B220+CD43-IgM+IgD+(mature-B)细胞所占的比例。
1.2.4 胸腺单细胞悬液制备 颈椎脱臼牺牲小鼠,完整摘取胸腺,使用两片载玻片研磨,200目滤网过滤置离心管中,计数、调整浓度至 1×108cell/m L。取10 uL细胞悬液置于96孔板一孔中,加入CD8/ FITC、CD45/Percp-cy5.5、CD4/APC-cy7抗体,冰上避光孵育30 min,加入200 uLstaining medium(PBS +1%BSA),400 g/m in离心5 m in,弃上清后用200 uLstaining medium重新悬浮细胞,200目滤网过滤至流式管中准备流式分析,每只小鼠收集1×105细胞,计算 CD45阳性细胞、CD8单阳性细胞、CD4/ CD8双阳细胞、CD4/CD8双阴性细胞及 CD4单阳性细胞所占的比例。
1.3 统计学分析
2 结果
2.1 PCR鉴定结果及 W IP1基因缺失小鼠形态差异

图1 PCR鉴定WIP1基因敲除小鼠的凝胶电泳分析及W IP1缺失小鼠形态差异图1A:Marker为DL2000 marker,H20为空白对照,WT为野生型对照,KO为基因敲除对照,HET为杂合对照; 1316/1317/1318/1319为样品;1B为3月龄W IP1缺失雄性小鼠与同窝野生型对照体型对比Fig.1 PCR genotyping of the W IP1-/-mice and the Morphological alterations in Wip1 nullmales 1A:The marker is the DNA molecular weightmarker;H2O indicates the negative control;WT:wild-type control; KO:WIP1 gene knockout control;HET:heterozygosity control;Lane 1316—1319:stands for DNA samples of W IP1 mice;1B:The smaller animal on the right is W IP1-/-male littermate along with a wild-type male littermate at 3 months of age
基因型鉴定结果如图1A所示。W IP1基因在小鼠全身众多脏器组织中表达,由于W IP1基因在睾丸中表达最为明显,因此该基因缺失致使雄性小鼠发育不全,生育力下降,雄性缺失小鼠在3月龄时体型较同窝野生型对照小鼠明显变小(如图1B)。有研究报道W IP1缺失的雄性小鼠生命期限明显缩短,而W IP1+/-雄性小鼠及W IP1-/-雌性小鼠生命期限较野生型差异不明显。
2.2 骨髓中B细胞比例流式分析
为研究W IP1基因缺失对成年小鼠骨髓B细胞发育的影响,我们分析了3月龄W IP1-/-小鼠和野生型对照小鼠的骨髓B细胞和M细胞的比例。(如图2A 2B)。结果显示W IP1缺失的小鼠骨髓B细胞比例下降(如图2C)。而M细胞比例无明显差异。为了进一步研究B细胞在发育过程中哪一阶段出现问题,我们依据骨髓B细胞发育过程中特异性表面标记的表达顺序进行了染色(如图2D 2E 2F 2G),结果显示 W IP1基因缺失的骨髓 B细胞各发育阶段比较野生对照均为正常,提示骨髓B细胞比例下降可能是由于Pre-B之前更前体的祖细胞发育障碍导致。
2.3 胸腺中T细胞比例流式分析
为研究W IP1基因对成年小鼠胸腺发育的影响,我们分析了三月龄W IP1-/-及野生型对照小鼠的胸腺形态差异(如图3D),发现WIP1缺失小鼠的胸腺明显较野生型对照小,进一步对胸腺白细胞表面标记CD45染色发现,W IP1缺失小鼠胸腺白细胞比例明显较野生型低(如图3A、3B及3C)。
为进一步明确胸腺T细胞在发育阶段哪一步出现问题,我们对胸腺细胞进行CD8及CD4染色。结果显示,W IP1缺失小鼠胸腺CD8/CD4双阴性细胞比例明显升高,而CD8/CD4双阳性比例降低,由CD8/CD4双阳性细胞进一步分化的CD8单阳性细胞比例升高,而CD4单阳性细胞变化不大。
3 讨论

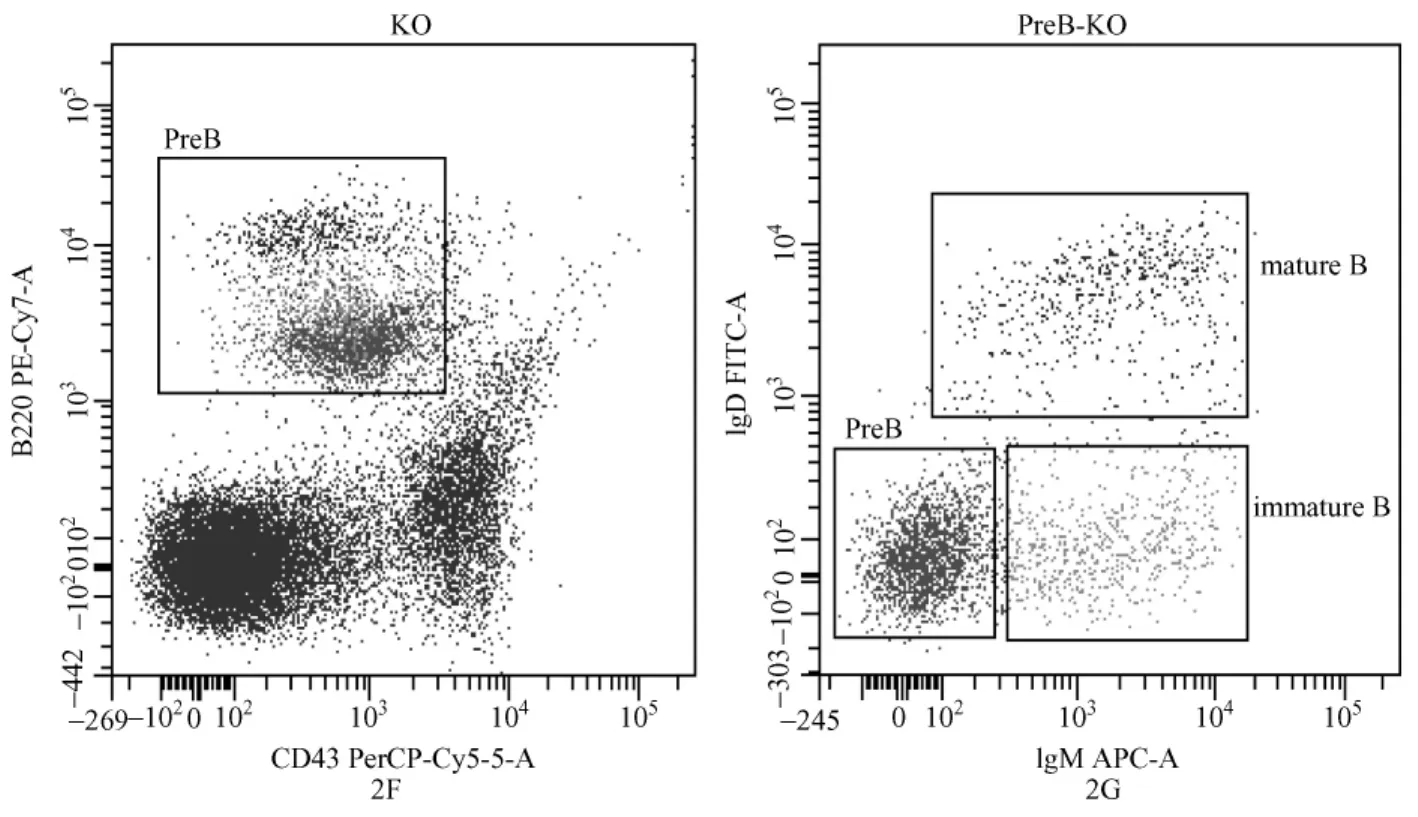
图2 骨髓B细胞比例流式分析2A:野生型小鼠骨髓中B细胞、M细胞比例;2B:WIP1敲除小鼠骨髓中B细胞、M细胞比例;2C:WIP1缺失骨髓B细胞比例与野生型对照比较明显降低;2D-2E:野生型骨髓B细胞发育流式图;2F-2G:WIP1缺失小鼠骨髓B细胞发育流式图Fig.2 Flow cytometric analysis of the proportion of B cell in bonemarrow2A:The ratio of B cells and M cells in wild-type mice bone marrow;2B:The ratio of B cells and M cells in WIP1-/-mice bonemarrow;2C:Histogram showing the lower percentage of B cells in W IP1-/-mice than WTmice;2D-2E:FACS plots show the development of B cell in WT bone marrow; 2F-2G:FACS plots show the development of B cell in W IP1-/-bone marrow
已有的研究表明W IP1蛋白作为一种磷酸酶,参与众多细胞信号通路调控,对DNA损伤修复、癌症的发生、细胞稳态的调控及抗衰老起重要的作用。而鲜有研究W IP1在B细胞T细胞发育过程中是否起到重要作用。我们对W IP1缺失小鼠的骨髓B细胞及胸腺 T细胞进行流式细胞术分析,发现WIP1缺失导致骨髓 B细胞比例降低,在胸腺中 T细胞发育障碍。骨髓和胸腺分别是B细胞和T细胞分化发育成熟的场所。在成熟小鼠的骨髓中,B细胞所占比例为20~30%左右,而W IP1缺失小鼠的骨髓B细胞仅为10%左右,为了弄清楚B细胞在发育过程的哪一阶段遇到障碍,我们进而依据B细胞发育阶段所表达的特异性表面标记进行染色,流式分析发现,在Pre-B之后的B细胞发育各阶段细胞比例均正常,从而猜想骨髓中B细胞比例整体降低可能是由于更前体的祖细胞发育障碍。W IP1缺失小鼠的胸腺中T细胞数目整体降低,在WIP1敲除小鼠模型中,CD8/CD4双阴性T细胞比例高于野生型对照小鼠,而CD8/CD4双阳性细胞比例低于对照组(差异不显著,但具有统计学差异),与已有报道一致,而CD8单阳性T细胞比例升高,不同于已有报道的CD8单阳T细胞比例降低,此外CD4单阳T细胞比例变化不明显而非已有报道的CD4单阳T细胞比例降低。
已有的报道发现衰老小鼠会产生淋系发育障碍,同时伴随着髓系细胞过度增殖[11],这与人类衰老时免疫能力下降及髓系白血病发病率升高相吻合。我们的研究表明W IP1基因参与调控B细胞及T细胞的发育,W IP1基因缺失导致骨髓B细胞及胸腺T细胞比例下降,影响小鼠免疫系统正常发育,暗示W IP1基因可能直接参与调控个体衰老。作为重要的衰老相关调控基因,P53、P38等在衰老过程中发生明显变化,端粒缩短导致的复制性衰老直接引起P53的高表达;在小鼠胰岛β细胞中随着衰老的进行,WIP1表达逐渐下降,同时 P38表达升高[8]。而W IP1做为P38/P53信号通路的负反馈调节基因[1],W IP1的缺失直接导致 p38/p53的升高,尤其在放射线照射、衰老等应激条件下,p38/p53持续的高表达使受损伤的细胞在修复之后无法正常的返回细胞周期,从而走向衰老或凋亡。可见W IP1对抗衰老尤其是调节免疫衰老具有重要的应用前景,然而W IP1的过表达极易导致癌症的发生,因此如何调控W IP1在衰老进程中的表达仍是限制其临床应用的重要障碍,对W IP1调控B细胞T细胞的具体分子机制及调控免疫衰老的机制仍须进一步研究。

图3 胸腺形态学分析注:3A:野生型小鼠胸腺白细胞比例;3B:W IP1缺失小鼠胸腺白细胞比例;3C:W IP1缺失小鼠胸腺白细胞比例较野生型对照组明显低;3D:野生型小鼠胸腺与W IP1缺失小鼠胸腺形态比较Fig.3 Morphological alteration about thymus in W IP1-/-nullmiceNote:3A:The ratio of white blood cells in 3 months old wild-type mice thymus;3B:The ratio of white blood cells in 3 months old W IP1deletion mice thymus;3C:Histogram showing the lower percentage of white blood cells in WIP1-/-mice compare with WTmice;3D:Thesize of W IP1-/-mice thymus is much smaller than WT

图4 胸腺T细胞流式分析4A:WIP1缺失小鼠胸腺CD8单阳性T细胞比例较野生型高;4B:W IP1缺失小鼠胸腺CD8/CD4双阴性T细胞比例较野生型明显高;4C:WIP1缺失小鼠胸腺CD8CD4双阳性T细胞比例较野生型低;4D:W IP1缺失小鼠胸腺CD4单阳性T细胞比例与野生型相比无明显差异;4E:野生型小鼠胸腺T细胞各亚群比例;4F:WIP1缺失小鼠胸腺T细胞亚群比例Fig.4 Flow cytometric analysis of the proportion of T cell in thymus 4A:The ratio of CD8 single positive cells in WIP1 deletion mice is higher than WT;4B: The ratio of CD8/CD4 double negative cells in W IP1 deletion mice is significantly higher than WT;4C:The ratio of CD8/CD4 double positive cells in W IP1 deletion mice is lower than WT;4D:The ratio of CD4 single positive cells do not have different between WIP-/-and WT;4E-4F:FACS plots of different subsets T cells from WT and WIP1-/-m ice thymus
[1]Lu X,Nguyen TA,Moon SH,et al.The type 2C phosphatase W ip1:an oncogenic regulator of tumor suppressor and DNA damage response pathways[J].Cancer Metastasis Rev2008,27 (2):123-135.
[2]Choi J,Nannenga B,Demidov ON,et al.Mice deficient for the wild-type p53-induced phosphatase gene(Wip1)exhibit defects in reproductive organs,immune function,and cell cycle control[J].Mol Cell Biol2002,22(4):1094-1105.
[3]Yu E,Ahn YS,Jang SJ,et al.Overexpression of the wip1 gene abrogates the p38 MAPK/p53/W ip1 pathway and silences p16 expression in human breast cancers[J].Breast Cancer Res Treat 2007,101(3):269-278.
[4]Harrison M,Li J,Degenhardt Y,et al.W ip1-deficientmice are resistant to common cancer genes[J].Trends Mol Med 2004,10 (8):359-361.
[5]Demidov ON,Timofeev O,Lwin HN,et al.W ip1 phosphatase regulates p53-dependent apoptosis of stem cells and tumorigenesis in the mouse intestine[J].Cell Stem Cell 2007,1(2):180 -190.
[6]Schito ML,Demidov ON,Saito S,et al.W ip1 phosphatasedeficientmice exhibit defective T cellmaturation due to sustained p53 activation[J].J Immunol2006,176(8):4818-4825.
[7]Zhu YH,Zhang CW,Lu L,et al.Wip1 regulates the generation of new neural cells in the adult olfactory bulb through p53-dependent cell cycle control[J].Stem Cells2009,27(6):1433 -1442.
[8]Le Guezennec X,Bulavin DV,et al.W IP1 phosphatase at the crossroads of cancer and aging[J].Trends Biochem Sci2010,35 (2):109-114.
[9]Cha H,Lowe JM,Li H,et al.W ip1 directly dephosphorylates gamma-H2AX and attenuates the DNA damage response[J].Cancer Res2010,70(10):4112-4122.
[10]Moon SH,Nguyen TA,Darlington Y,et al.Dephosphorylation of gammaH2AX by WIP1:An important homeostatic regulatory event in DNA repair and cell cycle control[J].Cell Cycle2010,9(11).
[11]Ju Z,Jiang H,Jaworski M,et al.Telomere dysfunction induces environmental alterations limiting hematopoietic stem cell function and engraftment[J].Nat Med 2007,13(6):742-747.

