HPLC-ICP-MS法分析太湖沉积物中砷的形态及分布特征
刘 锋,石志芳,2,姜 霞,李烔源,陈玉红
(1.中国环境科学研究院,北京 100012;2.郑州牧业工程高等专科学校,河南郑州 450000;3.安捷伦科技有限公司(中国),北京 100102)
除天然源外,工业排放和农药化肥是环境中砷的主要来源,地壳岩石圈上部砷的平均含量为5 mg/kg,而我国一些地区自然土壤含砷量的算术平均值为(11.5±8.41)mg/kg[1]。在天然水体中,砷主要以砷酸盐(水体溶解氧饱和的状态下)和亚砷酸盐(中等还原条件下)存在。在水与沉积物的交换界面,水中的几种砷酸根会被水合氧化铁吸附或生成共沉淀,也可以被氢氧化铝和粘土所吸附,还可通过同晶置换而富集于磷酸盐沉淀中;亚砷酸在行为上类似于砷酸,也可以被氧化铁吸附或共沉淀,还易被金属硫化物吸附或共沉淀。在还原环境中,砷酸可以被还原为亚砷酸,在微生物的作用下,逐级被甲基化为甲基砷、二甲基砷或三甲基砷[2],从而被释放回水体或大气,或通过鱼和浮游生物被富集。
砷及其化合物是剧毒污染物,不同形态砷的生物毒性差异很大,总体来说,无机砷化合物的毒性远高于有机砷化合物,三价砷化合物的毒性远高于五价砷化合物[3]。因此,砷总量的测定已经不能够充分反映砷化合物的环境健康效应,砷形态分析研究对砷的环境毒理学和生物地球化学循环研究具有重要意义[4]。
高效液相色谱(HPLC)法具有较高的分离性能,其联用技术在砷的形态分析中已得到广泛应用,从技术的发展趋势来看,HPLC和电感耦合等离子体质谱(ICP-MS)联用是发展较为完善的技术之一[5]。在应用上,样品中砷化物的提取技术是关键,提取方法有微波萃取、超声提取、振荡提取和液液提取等[6-7],对于沉积物样品,通常以非氧化性的磷酸盐为提取剂[8-9]。对提取技术的要求是样品中各种砷形态应有较高的提取效率,且不会造成砷形态的转化。本研究利用高效液相色谱-电感耦合等离子体质谱(HPLC-ICPMS)建立包括 As(Ⅲ)、As(Ⅴ)、MMA 和 DMA的在线分析方法,并借助于该方法详细考察太湖湖区沉积物中砷的形态及其分布特征。
1 实验部分
1.1 仪器
Agilent 1200高效液相色谱仪:美国Aglent公司产品,配有在线真空脱气机、梯度四元泵、手动进样器、PEEK定量环 (20μL)、保护柱(G3154-65002)、离子交换柱(4.6 mm×150 mm i.d.,G3154-65001);Agilent 7500a电感耦合等离子体质谱仪:美国 Aglent公司产品,配有PFA(100μl)同轴雾化器;Millipore超纯水机(Milli-q g);CEM微波消解仪(Mars Xpress);Chirst冻干机(Alpha2-4/LD plus)。
1.2 试剂和标样
砷标准物质:亚砷酸根 (AsO33-,GBW08666)、砷酸根 (AsO43-,GBW08667)、一甲基砷(CH3AsO32-,GBW08668)、二甲基砷(C2H7AsO2,GBW08669);将4种单标配制成2 mg/L(以砷计)的储备液,4℃避光保存;分析时用超纯水稀释为5、10、20μg/L混合标准系列。
水系沉积物成分分析标准物质(G BW07307):用于确定总砷的消解方法。
流动相:2.0 mmol/L NaH2PO4/0.2 mmol/L EDTA(p H 6.0)。
调谐液:10μg/L7Li、89Y、140Ce、205Tl,购于Agilent公司。
超纯水(电阻率18.2 MΩ·cm)。
1.3 HPLC及ICP-MS工作条件
测试前用调谐液对 ICP-MS进行调谐,使89Y的灵敏度达到最优,从而使75As有较高的灵敏度和较低的检出限。
由于40Ar和35Cl易形成75ArCl多原子离子,干扰75As。因此,在总砷的测定中,使用干扰方程校正75ArCl对75As的干扰;干扰校正公式推导如下:
75As=75M-75ArCl=75M-{77ArCl(35Cl丰度/37Cl丰度)}

但是,质荷比为77的离子除了40Ar37Cl还有77Se,77ArCl=77M-{82Se(77Se丰度/82Se丰度)}
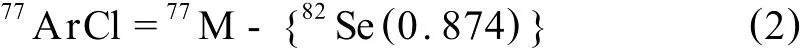
联立方程(1)和(2),得式(3):

但质荷比为82的离子还有82Kr,
82Se=82M-{83Kr(82Kr丰度/83Kr丰度)}
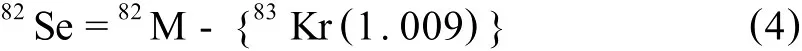
联立方程(3)、(4),得到干扰方程如下:
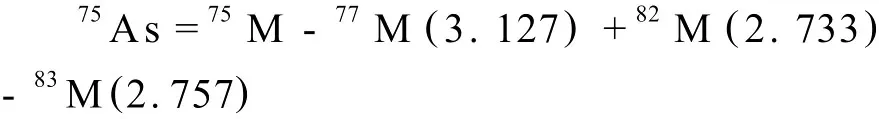
在砷的形态分析中,采用时间分辨分析模式,仪器同时监测75As和35Cl的信号,在色谱条件优化时,避免Cl的出峰时间与各种目标砷形态重叠,用以排除75ClAr+干扰峰[10],详见2.1.1。总砷和砷形态分析的主要仪器参数列于表1。
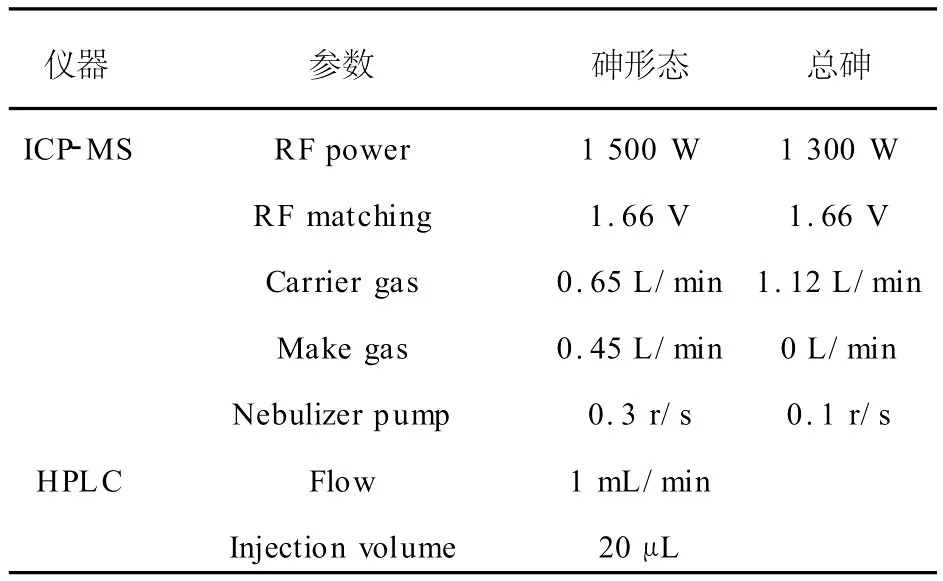
表1 总砷和砷形态分析的仪器参数Table 1 Instrumental parameters for total As determination and As speciation analysis
1.4 总砷的消解方法
准确称取0.1 g沉积物样品,加入10 mL优级纯硝酸,用微波消解仪进行消解。以GBW07307为标准样品,参照EPA方法3051[11]对升温程序做适当调整,列于表2。消解完毕,用去离子水将样品转移到50 mL容量瓶中定容,过0.45μm滤膜,4℃下保存。
1.5 砷形态的萃取方法
准确称取0.2 g沉积物样品,加入10 mL 0.3 mol/L磷酸和1 mL 0.1 mol/L抗坏血酸进行微波萃取。萃取程序参考文献[7],设置10 min由室温升至95℃,保持20 min,待冷却至室温后,将萃取液转移并定容至25 mL,静默后取上清液过0.22μm醋酸纤维滤膜,于4℃下保存 ,备用。
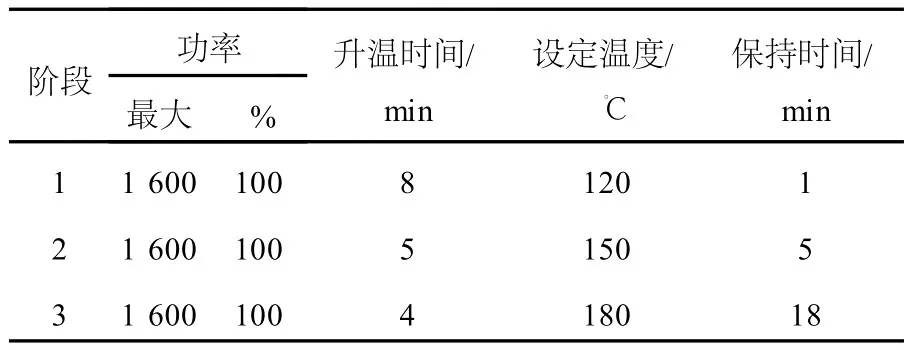
表2 微波消解的升温程序Table 2 The temperature protocol for microwave digestion
1.6 样品采集和保存
2009年10月至11月对太湖竺山湾(R1、R2、X1)、梅粱湾(R3、R4、X2)、贡湖(R5、X3)、胥湖(R6、R7、X4)、东太湖(R8、R9、X5)和开阔区(R10、R11、R12、R13、X6、X7)共计 20 个样点进行采样研究,采样点示于图1,其中R为河流入湖河口,X为湖心。

图1 太湖采样点示意图Fig.1 Diagram of sampling sites in Taihu Lake
1.6.1 柱状沉积物样品的采集和保存使用彼得森柱状采样器(内径为60 mm、长度为100 cm的可分离PVC管),采到的柱状沉积物弃去上覆水,按流泥层、污染层、过渡层A、过渡层B和健康层分为5层,分别装入封口袋内,排出袋内空气,密封,带回实验室进行冷冻干燥,除去植物和贝类等杂物,用玛瑙研钵研磨后,过100目筛,低温避光保存。
1.6.2 表层沉积物样品的采集和保存使用彼得森柱状采样器准确采集表层10 cm沉积物样品,按1.6.1方法进行处理和保存。
2 结果与讨论
2.1 沉积物中不同形态砷的分析方法验证
2.1.1 色谱体系的选择 基于砷在环境中可能的存在形态,初步确定 As(Ⅲ)、As(Ⅴ)、MMA和DMA 4种砷形态作为主要考察目标。这4种砷形态主要以阴离子形式存在,其分离多采用离子交换机理,而磷酸盐通常作为阴离子分离的淋洗液,因此选择阴离子交换柱,磷酸二氢钠作为基础淋洗液。
由于实际样品中可能含有氯,在提取过程中含氯的物种会进入提取液中。而在ICP-MS测定时,等离子体中的Ar易与样品基质中大量的Cl结合形成75ArCl分子离子,若 Cl的含量过高,则可能会严重干扰75As的测定。但样品中的Cl是以离子形式存在的(例如:Cl-或ClO4-等),当样品进入阴离子交换柱内进行色谱分离时,样品中的所有离子都可能与色谱柱作用,但不同离子的保留时间可能不同。这意味着,如果使Cl离子的出峰时间与4种目标As形态的出峰时间错开,即使样品中Cl的含量很高,也只可能仅造成其出峰的这一小段时间内As的基线变化,但4种As形态的色谱峰并不会受到ArCl干扰,因此不会影响砷形态的定量。对于离子交换色谱而言,淋洗液的浓度、p H值等因素对各种离子的保留时间影响较大,因此,通过优化色谱条件,最终选择淋洗液为 2.0 mmol/L NaH2PO4/0.2 mmol/L EDTA(p H 6.0)。在此条件下,含氯物种与4种As形态的保留时间不同,有效避免了ArCl对As形态测定的影响。
2.1.2 标准溶液色谱图 按照所建立的HPLC-ICP-MS分析方法 ,用 5、10、20μg/L(以砷计)的 As(Ⅲ)、As(Ⅴ)、MMA 和 DMA 混合标准溶液进样,得到不同砷形态标准溶液的色谱谱图,示于图2。在10 min内,4种形态砷的色谱峰可以完全分离,标准曲线线性良好,r2>0.99。表明实验所采用的流动相和色谱条件可以满足分析的需要。
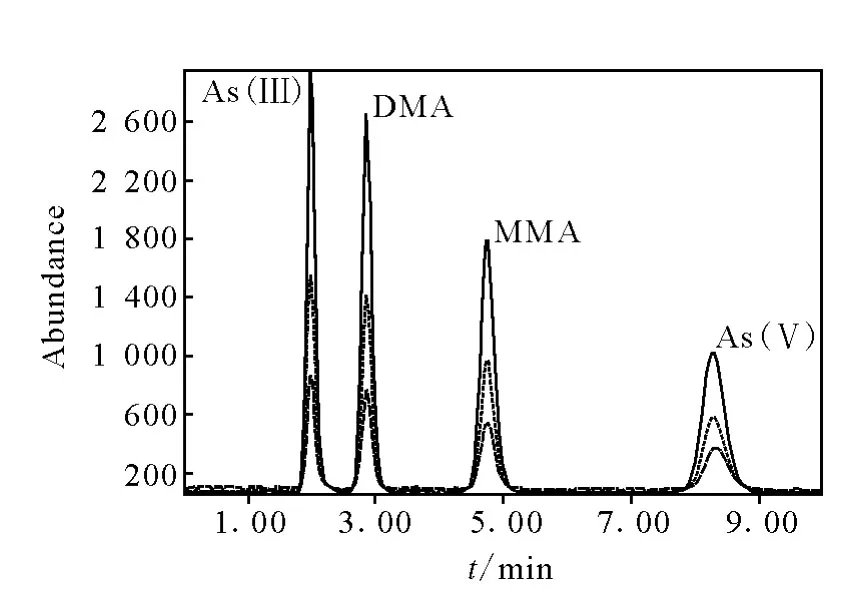
图2 不同砷形态的标准溶液色谱图Fig.2 The standard chromatogram of arsenic speciations
2.1.3 检出限与重现性 在 HPLC-ICP-MS应用中,ICP-MS仅作为色谱的检测器,因此检测限定义为信噪比(S/N)为3∶1时所对应的浓度。计算进样量为20μL时,本方法对As(III)、DMA、MMA、As(V)的检出限分别为0.49、0.81、0.93、1.4μg/L。对20.0μg/L 的 4种砷形态混合标准溶液连续测定6次(进样量为20 μL),峰面积相对标准偏差分别为 As(III)2.8%、DMA3.3%、MMA2.2%、As(V)2.4%。
2.1.4 加标回收率 取3份沉积物样品,按照每种组分5 mg/kg的加入量,分别加入到 As(Ⅲ)、As(Ⅴ)、MMA 和 DMA 标准溶液中 ,对加标样进行微波萃取后,计算样品的加标回收率,结果列于表3。样品的加标回收率为94.2%~110%,平均加标回收率为103%,表明该方法具有较高的准确性和可靠性。

表3 4种砷形态的加标回收率(%)Table 3 Standard recoveries of 4 arsenic speciations(%)
2.1.5 样品的提取效率 将本方法测定的样品中不同砷形态的量相加,与采用微波消解法测定的总砷含量进行比较,计算样品中砷形态的提取效率,结果列于表4。样品中砷形态的提取效率为80.4%~98.7%,平均提取效率为91.0%。由此可见,采用本方法对沉积物中不同砷形态进行提取,其提取效率是较高的。
2.2 太湖表层沉积物中砷的污染现状
对5个湖湾及开阔区域共20个采样点的样品检测结果表明,太湖沉积物中总砷的含量范围介于6.51~13.46 mg/kg之间,平均为10.39 mg/kg,低于《土壤环境质量标准》(GB15618-1995)一级标准(15 mg/kg)。由于太湖水体交换较充分,没有出现沉积物中砷严重聚集的区域,全湖砷的最高含量出现在竺山湾河流入湖口处,最低值出现在东太湖湖心处。竺山湾湖心和入湖口含量差别明显,梅粱湾和胥湖的湖心和入湖口处含量相当,且总体含量较高,贡湖和开阔区含量相当;东太湖相对砷的含量最低,无论是湖心处还是河流入湖口处的含量均低于全湖平均值,示于图3。
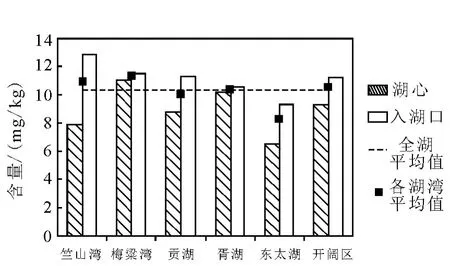
图3 各湖区表层沉积物中砷的污染状况Fig.3 The arsenic pollution of sediment in different regions of Taihu Lake

图4 太湖表层沉积物中不同砷形态的分布特征Fig.4 The distribution of the arsenic speciations in sediment of Taihu Lake
2.3 太湖表层沉积物中不同砷形态的分布特征
对样品中 As(Ⅲ)、As(Ⅴ)、MMA 和 DMA的检测结果示于图4。结果表明,太湖湖区表层沉积物中的砷主要为无机形态,未检出有机砷形态。在无机砷中,As(Ⅲ)形态与As(Ⅴ)形态的比例约为1∶3,这一比例关系在各湖区的表层沉积物中没有显著差异,表明太湖表层沉积物基本上处于氧化性沉积环境中。
2.4 沉积剖面沉积物中不同砷形态的分布
对在竺山湾湖区采集的1个沉积剖面中4个沉积物样本进行分析,结果示于图5。有研究表明[13],太湖不同湖区湖底沉积物的平均沉积速率为0.28~0.41 cm/a。因此对照采样深度可以看出,近20年来,太湖湖底沉积物中砷的含量有显著增加。4个沉积剖面沉积物中砷的形态均为无机形态,As(Ⅴ)的含量高于As(Ⅲ)的含量,各沉积剖面沉积物中砷形态的相对比例无显著差异。但As(Ⅲ)形态与As(Ⅴ)形态的比例与表层沉积物相比有所提高,该现象有待更多样品分析结果的验证。

图5 沉积剖面沉积物中不同砷形态的分布Fig.5 The section distribution of the arsenic speciations in sediment
3 结论
从不同砷形态标准溶液的色谱图可以看出,4种砷形态的色谱峰在10 min内可以得到完全分离,且标准曲线线性良好。样品的加标回收率为94.2%~110%,样品中砷形态的提取效率为80.4%~98.7%,表明该方法对沉积物中不同砷形态有较高的提取效率,具有较高的准确性与可靠性。
按照所建立的 HPLC-ICP-MS方法考察了太湖湖区沉积物中砷的形态分布特征。结果表明,太湖沉积物中总砷的含量低于《土壤环境质量标准》(GB15618-1995)一级标准,总体来说,未出现砷的污染情况。表层沉积物中的砷主要为无机形态,未检出有机砷形态。As(Ⅴ)形态的含量高于As(Ⅲ),表明太湖表层沉积物基本上处于氧化性沉积环境。近20年来,太湖湖底沉积物中砷的含量有显著增加。检测的沉积剖面沉积物中砷的形态亦为无机形态,各沉积剖面沉积物中砷形态的相对比例无显著差异。
[1]陈怀满.土壤中化学物质的行为与环境质量[M].北京:科学出版社,2002:79-95.
[2]OREMLAND R S,STOLZ J F.The ecology of arsenic[J].Science,2003,300(5 621):939-944.
[3]陈保卫,那仁满都拉,吕美玲,等.砷的代谢机制、毒性和生物监测[J].化学进展,2009,21(2/3):474-482.
[4]苑春刚,CHRIS L X.砷形态分析[J].化学进展,2009,21(2/3):467-473.
[5]张 华,王英锋,施燕支,等.高效液相色谱及联用技术在砷形态分析中的应用[J].光谱学与光谱分析,2007,27(12):386-390.
[6]方 宇,江桂斌,何 滨,等.砷形态分析中的样品前处理方法[J].环境污染治理技术与设备,2002,3(2):46-52.
[7]黄清辉,马志玮,李建华,等.2006年春季长江口砷形态分析及其生物有效性[J].环境科学,2008,29(8):2 131-2 136.
[8]VERGARA M G,BOHARI Y,ASTRUC A,et al.Speciation analysis of arsenic in environmental solids reference materials by high-performance liquid chromatography-hydride generation-atomic fluorescence spectrometry following orthophosphoric acid extraction[J].Analytica Chimica Acta,2001,441(2):257-268.
[9]彭 岚,谈明光,李玉兰,等.微波辅助萃取-液质联用技术测底泥砷、硒的化学形态[J].分析试验室,2006,25(5):10-14.
[10]RONKART S N,LAURENT V,CARBONNELL E P,et al.Speciation of five arsenic species(arsenite,arsenate,MMAAV,DMAAVand As-Bet)in different kind of water by HPLC-ICP-MS[J].Chemosphere,2007,66:738-745.
[11]USEPA.Method 3051—Microwave assisted acid digestion of sediments,sludges,soils,and oils[S].2007.
[12]王 海,王春霞,王子健.太湖表层沉积物中重金属的形态分析[J].环境化学,2002,21(5):430-435.
[13]成杭新,赵传冬,庄广民,等.太湖流域土壤重金属元素污染历史的重建:以 Pb、Cd为例[J].地学前缘:中国地质大学(北京);北京大学,2008,15(5):167-178.

