星点设计-效应面法优化人参皂苷Rg1脂质体的制备工艺
周洪伟,周曼,侯德岩,王玉蓉
(1.北京中医药大学,北京 100102;2.沈阳药科大学,辽宁 沈阳 110016)
人参皂苷Rg1(Ginsenoside Rg1,以下简称Rg1)为四环三萜类衍生物,现代药理研究表明,Rg1具有保护神经元作用[1],可改善老年动物衰退的行为活动功能[2],增强阿尔茨海默病动物的学习记忆能力[3]。但Rg1易被肠道细菌所产生的酶降解,且在血液中消除快,直接口服生物利用度仅为1% ~20%[4]。脂质体作为新型药物载体,包封药物后可防止药物在肠道内被酶降解,且脂质体结构与细胞膜结构类似,可增强药物的跨膜吸收效果。效应面优化法(Response surface methodology,RSM)系通过描绘效应对考察因素的效应面,从效应面选择较佳的效应区,从而回推自变量取值范围即最佳实验条件,实验设计可采用星点设计(Central composite design,CCD),该方法适用于非线性模型拟合,且具有良好的预测性[5]。因此,本文拟采用CCD-RSM法优化Rg1脂质体的制备工艺。
1 仪器与试药
HPLC系统:LC-20AT四元泵、DGU-20A5脱气机、CTO-10ASVP柱温箱、SPD-20A紫外检测器、SIL-20A自动进样器、色谱工作站(日本岛津公司)、Agilent eclipse XDB -C18柱(4.6mm ×250mm,5μm);XL-90型超高速离心机(美国BeckMan);JEM-1230型透射电镜(日本JEOL公司);RE-2000A型旋转蒸发仪(上海亚荣);KQ3200DE型数控超声波清洗器(昆山市超声仪器有限公司);BSII0S型电子分析天平(北京赛多利斯仪器系统有限公司)。
人参皂苷Rg1对照品(中国食品药品检定研究院,批号 110703-200726,纯度:97.7%);人参皂苷Rg1药品(购自上海源叶生物科技有限公司,纯度>98%);二棕榈酰磷脂酰胆碱DPPC(Avanti公司,纯度>99%);胆固醇CH(Sigma公司,纯度>99%);豆固醇ST(MP公司,纯度>99%);甲醇、乙腈(色谱纯)。
2 方法与结果
2.1 脂质体的制备
采用薄膜分散法制备Rg1脂质体:精确称取处方量磷脂、固醇(M∶M=2∶1)共溶于甲醇-氯仿混合溶剂中(V∶V=1∶9),置250ml梨形瓶内,于 40℃水浴减压旋转蒸发除去溶剂,待形成均匀的脂质薄膜后,加入Rg1药品水溶液,50℃水浴常压旋转水化60min,使脂质薄膜充分溶胀,水化完全后超声,即得Rg1脂质体。
2.2 包封率的测定
2.2.1 色谱条件
色谱柱:Agilent eclipse XDB-C18柱(4.6mm ×250mm,5μm);流动相:乙腈:水 =20∶80;流速:
作者简介:周洪伟(1982-),男,北京中医药大学2009级中药制药学专业博士研究生,主要研究方向:中药复方新型释药系统研究。
通讯作者:王玉蓉(1951-),女,教授,博士研究生导师,主要研究方向:中药复方新型释药系统研究。
收稿日期:2011-05-17
修回日期:2011-06-12
0.8mL/min;柱温:25℃;检测波长:203nm;进样体积:10μL。结果表明,该色谱条件下,辅料对人参皂苷Rg1的检测无干扰,如图1~3所示。

图1 DPPC/CH空白脂质体HPLC色谱图

图2 DPPC/ST空白脂质体HPLC色谱图

图3 人参皂苷Rg1 HPLC色谱图
2.2.2 标准曲线制作
精密称取经五氧化二磷减压干燥36h的Rg1对照品2.53mg,置10mL量瓶中,精密加入甲醇至刻度,摇匀,定容,即得 Rg1对照品溶液 A。取 Rg1溶液A 1 000μL和100μL,分别置 10mL 量瓶中,精密加入甲醇至刻度,摇匀,定容,即得Rg1对照品溶液B和Rg1对照品溶液C。精密吸取Rg1对照品溶液A 1、2、4、6、8、10、12μL,对照品溶液 B 2、4、6、8、10μL,对照品溶液 C 3、6、18、21μL,分别注入色谱仪,以峰面积(Y)对进样量(X)进行线性回归,得Rg1回归方程:Y=455 220X-4 275.7(R2=1)。结果表明 Rg1在7.415~2 996.172ng范围内线性关系良好。
2.2.3 精密度试验
取Rg1对照品溶液A,考察其日内、日间精密度。结果Rg1日内RSD为0.35%(n=5);日间RSD为2.99%(n=5),精密度符合要求。
2.2.4 回收率测定
按2.1项下方法制备空白脂质体。分别精密加入45.2、22.6、11.3μg/mL 的 Rg1对照品溶液,制成高、中、低浓度的Rg1脂质体混悬液,甲醇破乳后定容至2mL,按2.2.1项下方法测定Rg1含量,计算回收率。结果DPPC/CH脂质体高、中、低浓度的回收率分别为(98.74±3.00)%、(95.72±3.20)%和(103.78±2.16)%,RSD分别为3.04%、3.34%、2.08%(n=3);DPPC/ST脂质体高、中、低浓度的回收率分别为(96.19±0.95)%、(103.79±3.69)%和(100.74±5.75)%,RSD分别为0.99%、3.56%、5.70%(n=3),回收率良好。
2.2.5 药物纯度测定
依2.1.1项下方法测定所购药品 Rg1纯度,得Rg1纯度为99.15%,RSD=0.62%(n=3),药物满足实验要求。
2.2.6 包封率(EF%)测定方法
采用高速离心法测定Rg1脂质体的包封率。精密量取 Rg1脂质体适量,置超高速离心机中,4℃,130 000×g离心60min,取上清液5mL,置10mL量瓶中,加甲醇至刻度,定容,超声,依2.1.1项下方法测定上清液中Rg1的含量(W1)。另精密量取Rg1脂质体5mL,置10mL量瓶中,加甲醇至刻度,定容,超声,依2.1.1项下方法测定 Rg1的含量(W2),按公式(1)计算包封率。

2.3 脂质体制备工艺优化
在预实验基础上,选择Rg1药物百分含量(%)X1、水化时间(min)X2和水化温度(℃)X3为考察因素,以脂质体包封率(Y)为指标进行CCD-RSM法优化,X1范围为1~10%,X2范围为20~120min,X3范围为30~70℃。实验结果见表1~2。
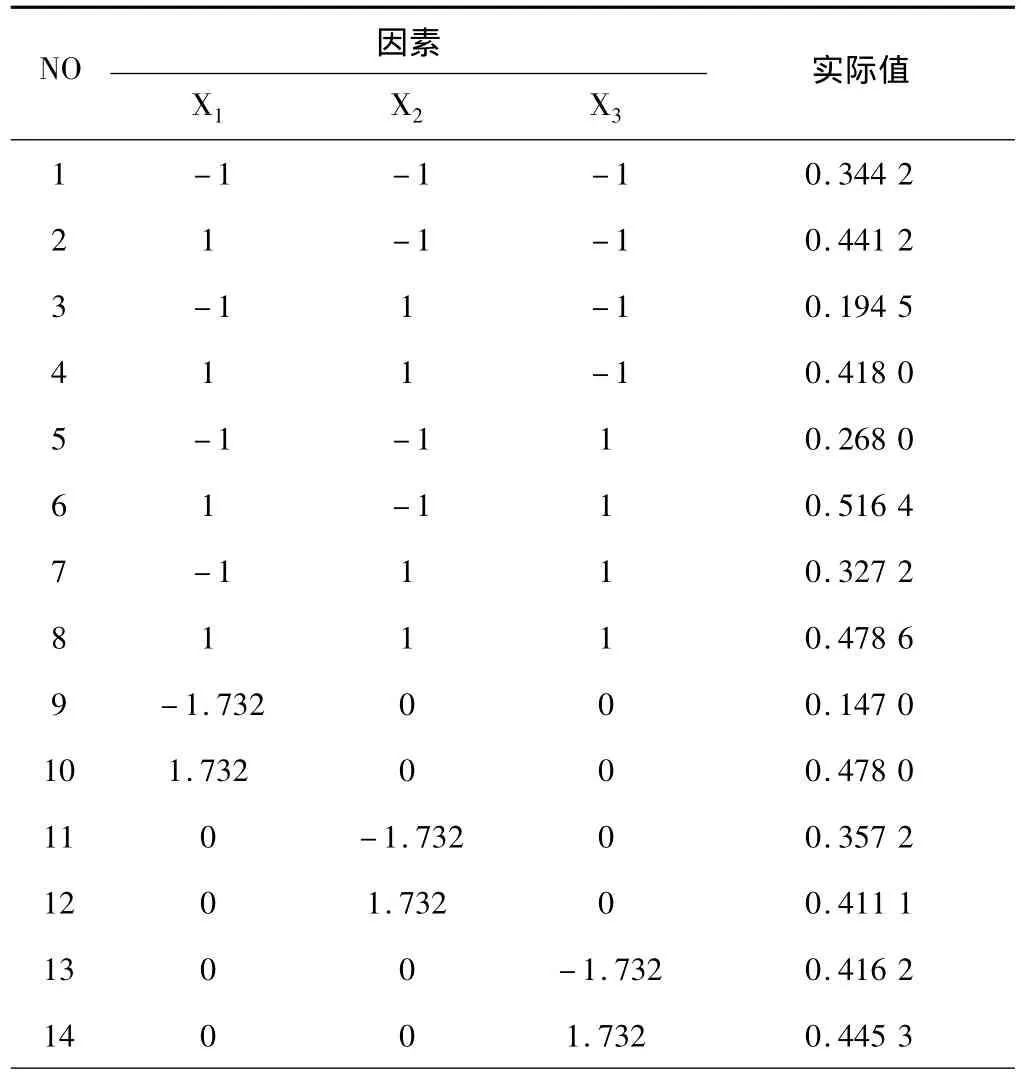
表1 Rg1/DPPC/CH脂质体CCD-RSM法优化试验结果表

续表1

表2 Rg1/DPPC/ST脂质体CCD-RSM法优化试验结果表
采用Design-Expert 7.0软件处理数据,对Rg1/DPPC/CH脂质体,有:
直线回归方程为:Y=0.13078+0.035565X1-0.000143865X2+0.0150133X3(R2=0.6670,P<0.01)
二次回归方程为:Y=0.25400+0.080565X1-0.0137274X2- 0.0508121X3+0.0000491667X1X2+0.000330417
X1X3+0.0000728625X1X3- 0.00590570X21-0.0000191762X22- 0.00000335119X23(R2=0.8452,P<0.05)
多元回归方程为:
Y=0.99929 - 0.069587X1- 0.016878X2-0.012206X3+0.00396612X1X2+0.000381720X1X3+0.000250289X2X3-0.00354414X21-0.00000516883X22-0.00000335119X23-0.0000322594X1X2X3-0.000177039X21X2+0.000200623X21X3-0.00000254679X1X22(R2=0.9058,P<0.05)
由以上方程可知,多元回归方程的拟合效果最好。采用OriginPro 8.0软件绘制三维效应面图,考察X1、X2、X3三个因素对Y的影响,如图4所示。

图4 Rg1/DPPC/CH脂质体效应面图
对Rg1/DPPC/ST脂质体,有:
直线回归方程为:Y=0.19373+0.028975X1+0.000496758X2+0.000789704X3(R2=0.6462,P<0.01)
二次回归方程为:
Y=0.55264+0.043245X1- 0.00258731X2-0.010223X3+0.000393333X1X2+0.000121667X1X3+0.0000285X2X3- 0.00435332X21- 0.0000036019X22+0.0000834881X23(R2=0.8392,P<0.01)
多元回归方程为:
Y=0.59388+0.037897X1+0.00484306X2-0.020252X3- 0.000782009X1X2+0.00165617X1X3+0.000189335X2X3-0.00470028X21-0.000119456X22+0.0000834881X23-0.0000292428X1X2X3-0.000028322X21X2+0.0000465899X21X3
+0.0000210645X1X22(R2=0.9354,P<0.05)
由以上方程可知,多元回归方程的拟合效果最好。采用Origin Pro 8.0软件绘制三维效应面图,考察X1、X2、X3三个因素对Y的影响,如图5所示。

图5 Rg1/DPPC/ST脂质体效应面图
2.4 最优工艺验证
由CCD-RSM法优选Rg1/DPPC/CH脂质体的制备工艺条件为:X1=7.4 ~8.1%,X2=50.0 ~85.0min,X3=60.0 ~63.0℃;Rg1/DPPC/ST 脂质体的制备工艺条件为:X1=7.6 ~8.1%,X2=95.0 ~100.0min,X3=40.0~63.0℃。按优选工艺分别制备Rg1/DPPC/CH脂质体和Rg1/DPPC/CH脂质体各3批,依2.2.1项下方法测定其包封率,结果见表3,数学模型满足预测要求。

表3 脂质体包封率验证结果(n=3)
2.5 脂质体粒径分布测定与形态学考察
马尔文动态光散射粒径仪检测脂质体的粒径分布。激光束波长633nm,入射与散射光束夹角173°,温度25℃。取10μL脂质体溶液用纯净水稀释至1mL,混合均匀,置比色皿中测定。透射电镜观察脂质体的形态。脂质体适当稀释后,滴于300目铜网表面,加入2%磷钨酸溶液染色,染色完成后置透射电镜中观测。实验结果见图6~7。

图6 Rg1/DPPC/CH脂质体粒径分布与电镜图

图7 Rg1/DPPC/ST脂质体粒径分布与电镜图
由图6~7可知,薄膜分散法制备的Rg1/DPPC/CH和Rg1/DPPC/ST脂质体为多层脂质体,其圆整度较好,可以满足制备工艺要求。
3 讨论
ST是植物细胞膜中的主要甾醇,与CH的结构相似,有研究表明,ST对脂质体膜的稳定性要大于CH[6],且能提高药物的生物利用度[7]。本实验同时制备Rg1/DPPC/CH脂质体和Rg1/DPPC/ST脂质体,并采用CCD-RSM法对脂质体制备工艺进行优化,结果表明,两种脂质体包封率相近,提示可以ST代替CH作为Rg1脂质体的膜材。
[1]徐丽,张敏,陈文芳.人参皂苷Rg1对多巴胺能神经元的保护作用及 ICI182,780 的阻断作用[J].山西医科大学学报,2007,38(8):677-681.
[2]刘忞,张均田.人参皂苷Rg1对老年大鼠行为活动的改善作用[J].中国药学杂志,1996,31(8):464 -467.
[3]李娜,王利民.人参皂苷Rg1对阿尔茨海默病模型大鼠学习记忆的影响[J].滨州医学院学报,2007,30(5):325 -327.
[4]XU QF,FANG XL,CHEN DF.Pharmacokinetics and bioavailability of ginsenoside Rb1 and Rg1 from Panax notoginseng in rats[J].Journal of Ethnopharmacology,2003,84(2 -3):187 -192.
[5]吴伟,崔光华,陆彬.实验设计中多指标的优化:星点设计和总评“归一值”的应用[J].中国药学杂志,2000,35(8):530-533.
[6]Muramatsu K,Maitani Y,Machida Y,et al.Effect of soybean derived sterol and its glucoside mixtures on the stability of dipalmitoylphos-phatidylcholine and dipalmitoylphosphatidylcholine/cholesterol lipo-somes[J].Int.J.Pharm,1994,107(1):1 - 8.
[7]Muramatsu K,Maitani Y,Nagai T.Dipalmitoylphosphatidylcholine li-posomes with soybean derived sterols and cholesterol as a carrier for the oral administration of insulin in rats[J].Biol.Pharm.Bull,1996,19(8):1055-1058.
