首乌延寿丹对家兔动脉粥样硬化形成的防治作用及其可能机制
王桂敏,韩凤丽
(1.辽宁医学院附属一院中医科,辽宁 锦 州 121001;2.内蒙古莫旗人民医院,内蒙古 呼 伦贝尔 162850)
首乌延寿丹出自清·陆九芝《世补斋医书》,原名延寿丹,由何首乌、菟丝子、杜仲、女贞子、桑椹、黑芝麻、旱莲草、金樱子、生地黄、牛膝、豨莶草、桑叶、忍冬藤13味中药组成。方中何首乌、菟丝子、杜仲、女贞子、旱莲草、桑椹、黑芝麻、金樱子、生地黄补肾益精;牛膝、桑叶、忍冬藤、豨莶草活血通脉。诸药相合共奏补肾活血之功,是延缓衰老之名方。现代药理学研究表明,本方能够通过降脂、抗凝、改善血管内皮功能等作用抑制AS的发生发展[1]。为了验证首乌延寿丹是否能通过其他途径起到防治AS的作用,本实验通过喂饲高脂饲料的方法,建立兔AS模型,应用首乌延寿丹进行干预治疗,并观察首乌延寿丹对AS血管PDGF-B、MMP-9表达的影响,以期为首乌延寿丹防治AS提供进一步的理论依据。
1 材料与方法
1.1 动物及饲料
健康日本大耳白兔32只,均为雄性,体重2kg~2.5kg,由辽宁医学院试验动物中心提供。高脂饲料:1%胆固醇,8%熟猪油和91%的普通饲料。
1.2 药物、试剂、仪器
1.2.1 药物 首乌延寿丹由辽宁医学院附属第一院中药局提供,按照原方药物用量(何首乌50g,豨莶草、菟丝子各15g,杜仲、怀牛膝、女贞子、旱莲草、桑叶、黑芝麻、桑葚子、金樱子各10g,金银花、生地各5g),在药学实验室研成粉末,存放在干燥通风处备用。根据人体-家兔体表面积比值法换算家兔的每日用药量[2]。辛伐他汀片(国药准字H20065119)由山东罗欣药业生产。
1.2.2 试剂及仪器 兔抗人MMP-9多克隆抗体(上海太阳生物有限公司),兔抗鼠PDGF-B多克隆抗体(北京博奥森生物制剂有限公司),CIAS-1000细胞图像分析系统(北京大恒图像视觉有限公司),台式高速冷冻离心机(太仓市医疗器械厂)。
1.3 分组与给药[3]
日本大耳白兔单笼饲养,室温20℃~22℃,相对湿度为50%~60%,经适应性喂养1周后开始试验。遵循随机原则,将动物分成4组,每组8只。A组(空白对照组),继续喂饲普通饲料140g/d/只,B组(模型组)喂饲高脂饲料140g/d;C组(首乌延寿丹组)喂饲高脂饲料140g/d加首乌延寿丹1g/kg.d;D组(辛伐他汀组)喂饲高脂饲料140g/d加辛伐他汀2.5mg/kg.d[4],喂养至第12周末。
1.4 取材与指标测定
1.4.1 取材 第12周末(实验结束时),于清晨空腹从兔耳中动脉采集血液5ml,注入不含抗凝剂的普通试管,静置后离心分离血清。用全自动生化仪测定总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、甘油三酯(TG)的水平。
实验动物于第12周末采用颈动脉割伤法处死,迅速剖开腹腔分离腹主动脉,剥除外膜结缔组织及脂肪,取约1cm长动脉血管冲净,放入4%多聚甲醛溶液中固定,用于光镜观察病理形态学及免疫组化检测。
1.4.2 指标测定 将兔主动脉标本于4%中性甲醛溶液固定24h之后,自来水冲洗4h~6h,逐级脱水、透明、浸蜡、包埋制成腊块,用石蜡切片机进行连续切片厚度5μm,于45℃温水中展片,分别用普通玻片和多聚赖氨酸防脱玻片,捞片后置于56℃温箱中干燥约2h~3h,用于HE和免疫组化染色。每一标本取3张切片(普通玻片)作HE染色,每一标本取3张切片(防脱玻片)作免疫组化染色,均按试剂盒步骤进行操作。免疫组化以棕色反应物为阳性信号,细胞浆染色测定其平均灰度值。
1.5 统计学方法
SPSS 13.0统计软件分析数据,计量资料以均数±标准差表示,4组间比较采用单因素方差分析(ANVOA),组间两两比较用LSD法进行显著性检验,P<0.05为差异有统计学意义。病理形态学资料采用对比描述分析。
2 结果
2.1 各组兔血脂变化
表1显示,第12周时,与正常对照组相比,模型组、首乌延寿丹组、辛伐他汀组TG、TC、LDL-C水平均显著升高(P<0.01,P<0.05),HDL-C显著降低(P<0.01);与模型组相比,首乌延寿丹组、辛伐他汀组TG、TC、LDL-C明显降低(P<0.05),HDL-C明显升高(P<0.01),首乌延寿丹组与辛伐他汀组TG、TC、LDL-C、HDL-C差异无显著性(P>0.05)。
表1 各组兔血脂水平变化

表1 各组兔血脂水平变化
注:与正常组比较:*P<0.05,△P<0.01;与模型组比较:▲P<0.05,#P<0.01
组别 TC(mmol/L) TG(mmol/L) LDL-C(mmol/L) HDL-C(mmol/L)正 常 对 照 组1.64±0.74 0.72±0.25 0.61±0.26 0.52±0.18模 型 组 26.7±4.83* 6.00±1.43* 13.17±2.68* 3.66±0.57△中 药 组 11.24±2.32*▲ 1.65±0.65△▲ 3.89±1.58*▲ 6.65±0.72△#辛 伐 他 汀 11.79±2.14*▲ 2.04±0.73*▲ 4.02±1.62*▲ 6.48±0.61△#
2.2 各组血管内膜病理形态学改变
HE染色显示,正常对照组血管内膜光滑、连续,内皮细胞完整,排列整齐,内弹力膜清晰完好,中膜由平滑肌细胞(SMC)组成,排列整齐,外弹力膜完整;模型组血管内膜内皮细胞绝大多数缺失,内膜不均匀明显增厚,内膜中含有大量的泡沫细胞,内有脂质沉积,内弹力膜消失,中膜SMC增殖,排列紊乱,外膜改变不明显;首乌延寿丹组、辛伐他汀组内膜轻度增厚,泡沫细胞少量,内弹力膜尚清晰完整,中膜SMC排列尚整齐,外膜改变不明显(见图1)。
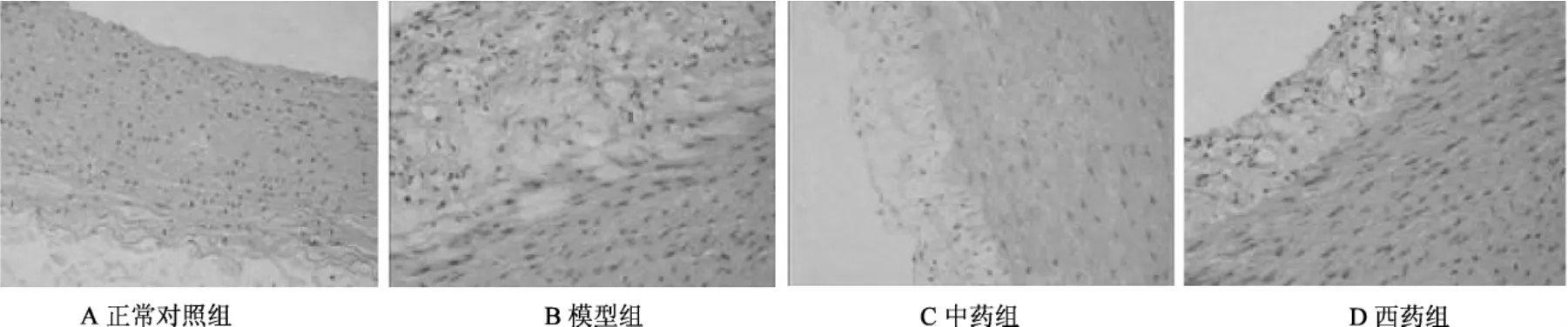
图1 各组兔血管内膜形态学变化(HE×200)
2.3 各组兔血管组织PDGF-B、MMP-9蛋白表达的改变
表2显示,PDGF-B表达于细胞的胞浆中,正常对照组血管表达量低,呈浅棕黄色;模型组表达明显增多,与正常对照组比较差异有显著性(P<0.01);与模型组比较,首乌延寿丹组及辛伐他汀组表达明显减轻(P<0.01),2用药组PDGF-B表达无统计学差异。
表2 各组PDGF-B及MMP-9平均灰度值比较

表2 各组PDGF-B及MMP-9平均灰度值比较
注:与正常组比较:*P<0.01;与模型组比较:▲P<0.01
灰度值 正常组 模型组 中药组 西药组PDGF-B 21.34±6.66 145.41±13.28* 76.51±13.14*▲ 73.03±10.58*▲MMP-9 13.32±3.85 74.58± 6.78* 33.52±3.64*▲ 32.72± 4.05*▲
表2显示,MMP-9表达于胞浆,棕色反应物。正常对照组血管壁表达少;模型组表达明显增多,与正常对照组比较差异有显著性(P<0.01);与模型组比较,首乌延寿丹组及辛伐他汀组表达明显减轻(P<0.01),2用药组MMP-9表达无统计学差异。
3 讨论
动脉粥样硬化(AS)是以血管内皮细胞损伤,大量脂质沉积,炎性细胞浸润,血管平滑肌细胞(VSMC)增殖和迁移,细胞外基质成分增多和泡沫细胞出现,最后粥样斑块形成为其主要病理基础的疾病,其中VSMC增殖、迁移是其关键性环节之一[5]。已知血小板源性生长因子(PDGF-B)是最有力的促有丝分裂源,可促进动脉中膜收缩型SMC转化为分泌型SMC,并迁移到内膜下参与粥样斑块形成[6],同时分泌大量的活性物质,促使细胞黏附及强烈的缩血管作用。基质金属蛋白酶-9(MMP-9)能够分解VSMC基底膜基质,将SMC从基底膜中释放出来,从而引起VSMC的移行,在AS发生和发展过程中起着十分重要的作用[7]。
中医学认为,AS的发生是以肾虚血瘀为其主要病理基础的[8]。肾为元气之根,内寓元阴元阳,若年老之人肾气亏虚,无力推动血液运行而致血流迟缓;或肾阳虚衰,虚寒内生,血液凝滞;或肾阴不足,虚火灼液,血液浓缩,最终瘀血阻滞脉道。这种肾虚而致血瘀的过程与现代医学所论述的动脉内膜先有内皮细胞损伤、凋亡,继而脂质沉积,纤维组织增生,以致AS斑块形成的过程极为相似,因此认为肾虚血瘀是AS形成的主要病理基础。所以本文选择补肾活血方首乌延寿丹作用于AS模型,观察首乌延寿丹对AS血管PDGF-B、MMP-9表达的影响。
TC、TG和LDL-C是血浆中血脂的主要成分,HDL-C是AS的重要防御因子,有明显抑制AS的发生发展和促进其消退的作用。本实验研究表明,通过高脂饲料喂养12周后,所有高脂饲料喂养的日本大耳白兔血清TG、TC、LDL-C水平均较正常对照组升高,HDL-C水平降低,内膜增厚,提示AS形成过程中存在血脂代谢紊乱,其中以模型组最为严重;与模型组比较,首乌延寿丹能够显著降低TG、TC、LDL-C水平,升高HDL-C水平,提示首乌延寿丹能够通过改善血脂代谢紊乱并抑制AS形成。
PDGF是一种促细胞分裂剂,主要由血小板释放。其中PDGF-B具有促进动脉中膜收缩型SMC转化为合成型SMC,并向内膜下迁移的作用[9],增殖的SMC可吞噬脂质形成泡沫细胞,从而加速AS的形成。
本实验中观察到,模型组PDGF-B蛋白表达较正常对照组显著增多;与模型组比较,首乌延寿丹组PDGF-B蛋白表达明显减轻,其效果与辛伐他汀相似,提示首乌延寿丹能降低PDGF-B蛋白水平,从而抑制SMC的增殖及转型,进而抑制AS的形成。
MMP是降解细胞外基质的主要酶类,可为SMC从中膜迁移至内膜扫清道路[10]。其中MMP-9是MMP家族中的重要成员,主要功能是降解IV型胶原和弹力纤维,在基质降解、VSMC迁移、AS形成以及促进斑块破裂上起重要作用[11]。本实验表明,模型组MMP-9蛋白表达较正常对照组显著增高;与模型组比较,首乌延寿丹组MMP-9蛋白表达明显减轻,提示首乌延寿丹能降低MMP-9蛋白水平,从而抑制SMC从中膜向内膜迁移。此结果与以往研究的系统给予MMP-9抑制剂[12],早期可减少VSMC向内膜迁移的结果相同。
综上所述,首乌延寿丹能够通过改善血脂代谢紊乱,抑制PDGF-B、MMP-9的表达、抑制内膜增生而起到防治AS的作用。其效果与HMG-CoA还原酶抑制剂辛伐他汀相同,表明首乌延寿丹抗AS疗效可靠。本文从分子生物学水平探讨了首乌延寿丹抗AS机制,为临床应用首乌延寿丹防治AS提供了进一步的理论依据。
[1]王桂敏,吴秀清.首乌延寿丹抗血管内皮细胞老化的实验研究[J].中医药学刊,2002,20(3):314-315.
[2]谭德福.中医基础学科实验教程[M].北京:中国中医药出版社,2003.206-207.
[3]阎艳丽,王鑫国,张莉芳,等.当归芍药散对高脂血症家兔脂代谢及血液流变学的影响[J].辽宁中医杂志,2005,32(2):170-171.
[4]高传玉,许文克,于 洁,等.辛伐他汀对平滑肌增殖的影响和可能的分子机理[J].实用诊断与治疗杂志,2006,20(1):5-7.
[5]Doran AC,Meller N,McNamara CA.Role of smooth muscle cells in the initiation and early progression of atherosclerosis[J].Arterioscler Thromb Vasc Biol,2008,28(5):812-819.
[6]李玉林.分子病理学[M].北京:人民卫生出版社,2002.194-209.
[7]Newby AC,Zaltsman AB.Molecular mechanisms in intimal hyperplasia[J].Pathol,2000,190(3):300-309.
[8]郭晓华,王宜芳.补心肾化痰瘀治疗冠心病初探[J].陕西中医,2006,27(11):1388-1390.
[9]Somlyo AP,Somlyo AV.Calcium sensitivity of smooth muscle and non-muscle myosin II:modulation by G proteins,kinases,and myosin phosphatase[J].Physiol Rev,2003,(83):1325-1358.[10]Galis ZS,KhatriJJ.Matrix metalloproteinases in vascular remodeling and atherogenesis the good,the bad,and the ugly[J].Circ Res,2002,90(3):251-262.
[11]CHO A,REIDY MA.Matrix metal loproteinase 9 is necessary for the regulation of smooth muscle cell replication and migration after arterial injury[J].Circ Res,2002,91(9):845-851.
[12]林梅瑟,陈碧新,赵志光,等.姜黄素对动脉粥样硬化兔基质金属蛋白酶9的影响[J].中国动脉硬化杂志,2007,15(3):189-192.

