肺炎嗜衣原体CPAF重组蛋白致小鼠肺组织炎症及对炎症细胞因子的影响①
王华丽 吴移谋 郑江花 朱翠明 李忠玉 周 洲 余敏君
(南华大学病原生物研究所,衡阳421001)
肺炎嗜衣原体(Chlamydophila pneumoniae,Cpn)是人类重要的呼吸道病原体,它可引起非典型肺炎,还可引起咽炎、支气管炎、鼻窦炎、中耳炎等,并导致了平均10%的社区获得性肺炎的发生[1,2]。Cpn的人群感染极为普遍,据统计,全球20岁以上的成人几乎都受到过Cpn的感染,血清流行病调查也显示,成人中Cpn的抗体阳性率可达50%~70%。临床上Cpn的感染多以隐性、持续性感染的形式存在,感染易反复迁延,造成组织病理损伤,致使严重的心血管系统并发症的发生[3,4]。因此,研究Cpn的致病因素,阐明毒力相关蛋白的致病作用及机制对预防Cpn感染,控制其传播具有重要意义。
衣原体蛋白酶样活性因子(Chlamydial proteaselike activity factor,CPAF),是由衣原体合成并分泌到宿主细胞内的蛋白,是Cpn和宿主之间相互作用的途径之一,且其抗原性明显强于MOMP和HSP60[5,6]。为进一步了解CPAF的潜在致病性,本研究将纯化的CPAF重组蛋白以滴鼻和静脉方式接种BALB/c小鼠,观察CPAF对小鼠肺组织的炎症损伤作用及对炎症细胞因子IL-6、TNF-α水平的影响,为进一步研究CPAF蛋白的生物学功能,了解Cpn的致病机制奠定基础。
1 材料与方法
1.1菌株、质粒 pGEX6p-2/CPAFm原核表达体、pGEX6p-2原核表达载体、E.coliBL21、E.coliJM109均为病原生物学研究所保存。
1.2主要仪器和试剂 GST琼脂糖凝胶FF纯化柱购自北京天来公司(Qiagen company);小鼠 TNF-α、IL-6 ELISA试剂盒购自北京晶美公司。倒置荧光显微镜购自日本Nikon公司,Multiskan MK-3全自动酶标仪购自芬兰雷勃公司。
1.3重组蛋白的表达和纯化 将本实验室保存并已证实转入Cpn-CPAF的181~400 aa基因(CPAFm)的重组表达菌接种于含100μg/ml的LB培养液中[7],于37℃培养至OD600为0.6~1.0时,加入终浓度为1.0 mmol/L的IPTG诱导。离心后收集菌体,加入细胞裂解液,4℃过夜;反复冻融后超声破菌,收集沉淀用包涵体洗涤液冲洗三次;离心后取沉淀加入包涵体溶解液中过夜。再次离心后,在上清中先后加入GST融合蛋白复性液和“万金油”透析复性液中进行孵育,使重组蛋白充分复性。然后按说明书用 GST琼脂糖凝胶FF进行纯10%SDS-PAGE分析蛋白质的表达形式及纯度;采用A280紫外分光光度法测定蛋白质浓度。以上的蛋白在使用前经100 μg/ml多粘菌素B预孵育2小时以消除在蛋白提取过程中可能污染的内毒素[8]。
1.4实验动物和分组 健康清洁级BALB/c雌性小鼠70只,6~8周,体重18~22 g(本校实验动物中心提供)。随机分成7组,每组10只:①鼻内滴入组:将A、B、C组的BALB/c小鼠用2%戊巴比妥钠2.3 ml/kg腹腔注射轻微麻醉,诱导小鼠过度通气;用带有4号针头的注射器于吸气相时,A组向鼻孔内滴入50μl GST-CPAFm(含100μg GST-CPAFm)[7],B 组向鼻孔内滴入50μl GST(含100μg GST),C组向鼻孔内滴入50μl PBS,小鼠保持仰卧或直立位,以确保液体全部吸入肺部;②尾静脉注射组:将D、E、F组的BALB/c小鼠尾部消毒后,用带有4号针头的注射器经尾静脉分别注射50μl GST-CPAFm(含100μg GSTCPAFm)、50μl GST(含 100μg GST)、50μl PBS;③正常组G组,不做任何处理。第3天和第6天同种方法处理BALB/c小鼠,第7天处死BALB/c小鼠[5,7]。
1.5病理检查 每组随机取5只BALB/c小鼠打开胸腔,分离并取下肺组织经4%多聚甲醛灌注固定后制成HE病理切片,观察肺组织炎症反应情况。
1.6采血及收集支气管肺泡灌洗液 每组余下的5只BALB/c小鼠摘眼球取血用于白细胞计数及分类,其余血收集到 EP管中,静置于37℃10分钟后1 500 r/min离心8分钟,血清-20℃保存。固定打开胸腔并分离颈部皮肤和肌肉,暴露器官与肺组织,在甲状腺水平将气管剪开一小口,用2号针头注射器吸取0.5 ml PBS,缓慢注入肺内,可见BALB/c小鼠肺脏逐渐膨胀、变白,缓慢回抽灌洗液,再将其缓慢注回肺内,重复1次,最后将收集到的BALF注入1.5 ml EP管中(置于冰浴中,防止细胞粘连),此为第一次灌洗,共灌洗3次,灌洗液回收率>80%,回收(1.4±0.2)ml。BALF经4 ℃离心1 500 r/min离心8分钟后,在1小时内作细胞计数,上清液于-20℃储存。
1.7血清及BALF中IL-6、TNF-α水平的测定 按小鼠IL-6、TNF-α酶联免疫吸附实验(ELISA)检测试剂盒说明书进行。
1.8统计学处理 所有重复实验数据用±s表示,用SPSS13.0软件进行统计分析,多组间均数比较用单因素方差分析,两两比较用LSD法,设显著性水准α=0.05。
2 结果
2.1肺组织病理学变化 正常组、鼻内滴入GST组和PBS组,尾静脉注射 GST组和PBS组肺组织结构清晰,肺泡壁薄,肺泡间质无明显炎症细胞浸润,血管壁及周围无明显炎症细胞浸润,支气管管壁规则,管腔无明显炎症细胞渗出(图 1B、C、E、F、G);GSTCPAFm重组蛋白鼻内滴入组和尾静脉注射组可看到渗出性炎症病灶,病变部位有大量淋巴细胞、单核细胞和中性粒细胞浸润,肺泡间隔明显增宽,支气管腔内有较多炎症细胞渗出,支气管及血管周围有大量淋巴细胞浸润(图1A、D)。

图1 各组BALB/c小鼠肺组织病理改变(HE,×200)Fig.1 Pathological changes of the lung tissue(HE,×200)
2.2BALB/c小鼠外周血及BALF中白细胞总数GST-CPAFm重组蛋白鼻内滴入组和尾静脉注射组BALB/c小鼠BALF中白细胞总数明显高于正常组、鼻内滴入 GST组和 PBS组,尾静脉注射 GST组和PBS组(表 1)。
2.3BALB/c小鼠外周血及BALF中 IL-6、TNF-α的水平
表1 各组BALB/c小鼠外周血、BALF中的白细胞总数(±s)Tab.1 Total white blood cells(TWBC)in BALB/c mouse peripheral blood BALF of different groups(±s)
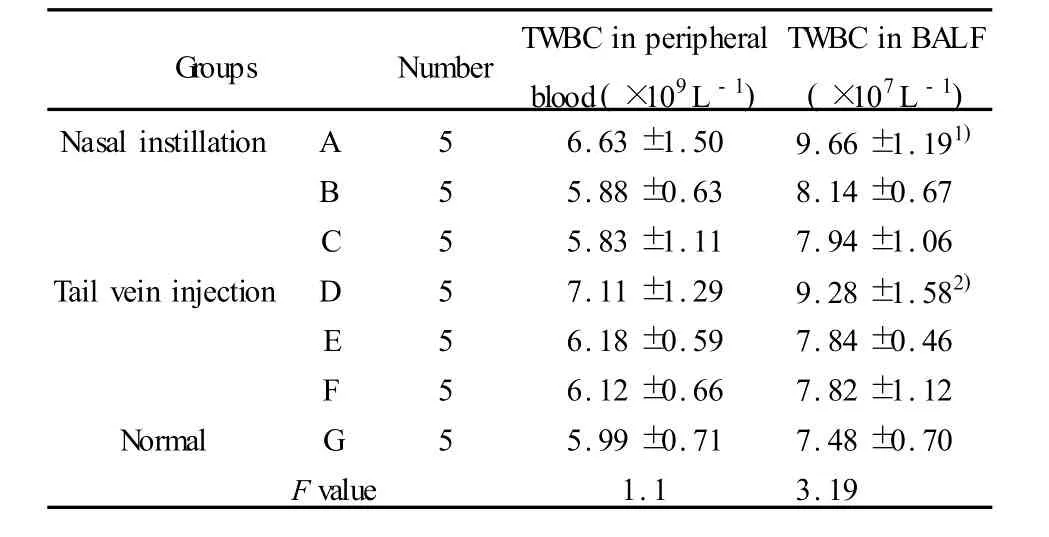
表1 各组BALB/c小鼠外周血、BALF中的白细胞总数(±s)Tab.1 Total white blood cells(TWBC)in BALB/c mouse peripheral blood BALF of different groups(±s)
Note:1)P<0.05 vs B and C group;2)P<0.01 vs Ggroup.
Groups NumberTWBC in peripheral blood(×109L-1)TWBC in BALF(×107L-1)Nasal instillation A 5 6.63±1.50 9.66±1.191)B 5 5.88±0.63 8.14±0.67 C 5 5.83±1.11 7.94±1.06 Tail vein injection D 5 7.11±1.29 9.28±1.582)E 5 6.18±0.59 7.84±0.46 F 5 6.12±0.66 7.82±1.12 Normal G 5 5.99±0.71 7.48±0.70 Fvalue 1.1 3.19
表2 各组小鼠外周血、BALF中 IL-6、TNF-α的水平(pg/ml,±s)Tab.2 Levels of IL-6 and TNF-αin BALB/c mouse peripheral blood or BALF of different groups(pg/ml,±s)
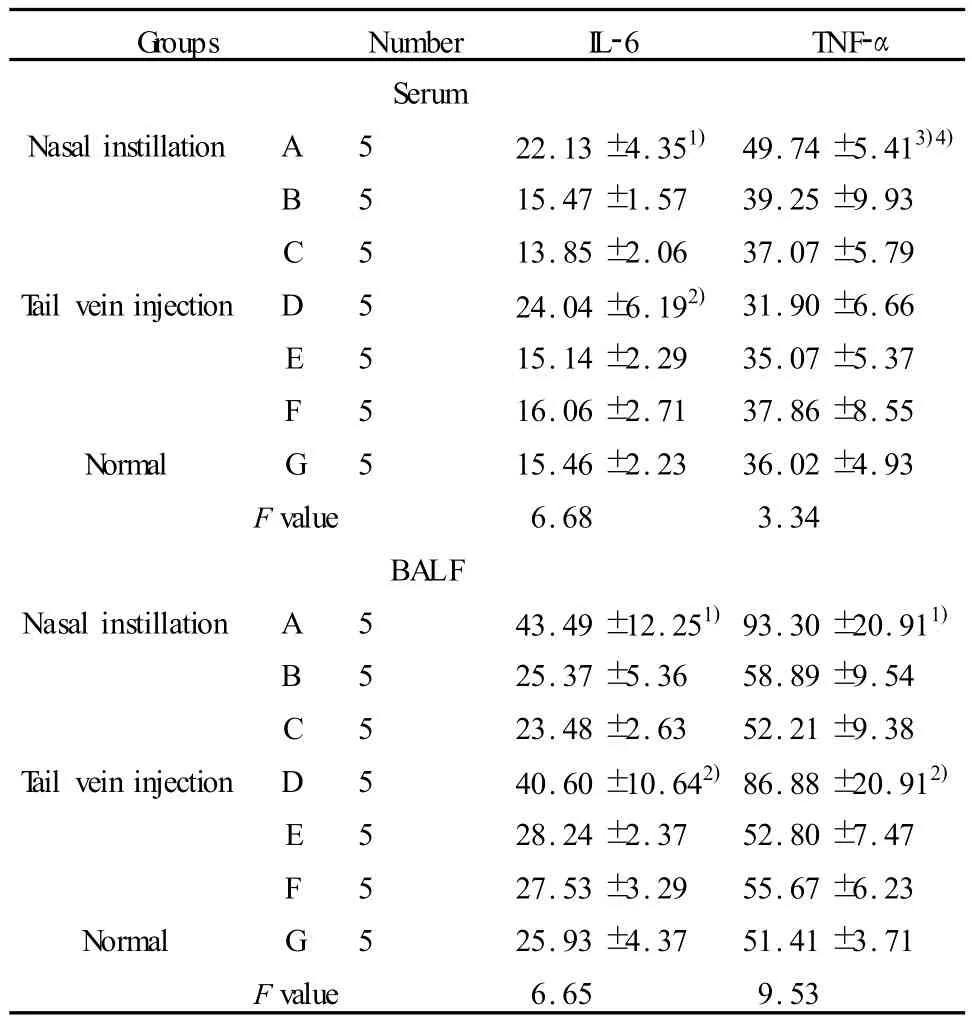
表2 各组小鼠外周血、BALF中 IL-6、TNF-α的水平(pg/ml,±s)Tab.2 Levels of IL-6 and TNF-αin BALB/c mouse peripheral blood or BALF of different groups(pg/ml,±s)
Note:1)P<0.01,vs B,C and Ggroup;2)P<0.01,vs E,F and Ggroup;))
Groups Number IL-6 TNF-α Serum Nasal instillation A 5 22.13±4.351) 49.74±5.413)4)B 5 15.47±1.57 39.25±9.93 C 5 13.85±2.06 37.07±5.79 T ail vein injection D 5 24.04±6.192) 31.90±6.66 E 5 15.14±2.29 35.07±5.37 F 5 16.06±2.71 37.86±8.55 Normal G 5 15.46±2.23 36.02±4.93 Fvalue 6.68 3.34 BALF Nasal instillation A 5 43.49±12.251)93.30±20.911)B 5 25.37±5.36 58.89±9.54 C 5 23.48±2.63 52.21±9.38 T ail vein injection D 5 40.60±10.642)86.88±20.912)E 5 28.24±2.37 52.80±7.47 F 5 27.53±3.29 55.67±6.23 Normal G 5 25.93±4.37 51.41±3.71 Fvalue 6.65 9.53
2.3.1BALB/c小鼠外周血中 IL-6、TNF-α的水平GST-CPAFm重组蛋白鼻内滴入组组外周血中炎症因子IL-6水平显著高于正常组、鼻内滴入GST组和PBS组(均P<0.01),TNF-α水平明显高于鼻内滴入GST组(P<0.05)、鼻内滴入 PBS组(P<0.01)和正常组(P<0.01);GST-CPAFm重组蛋白尾静脉注射组组外周血中炎症因子IL-6的水平明显高于正常组、尾静脉注射 GST组和PBS组(均P<0.01,表2)。
2.3.2BALB/c小鼠BALF中 IL-6、TNF-α的水平GST-CPAFm重组蛋白鼻内滴入组和尾静脉注射组BALF中炎症因子 IL-6、TNF-α的水平明显高于正常组、鼻内滴入 GST组和 PBS组,尾静脉注射 GST组和 PBS组(均P<0.01,表2)。发现炎症早期升高的TNF-α可促使更多的免疫细胞参与对病原微生物的反应,之后由升高降到了正常水平的情况相似,也有研究显示TNF-α可诱导IL-10及IL-4的合成,而 IL-4及 IL-10可强烈抑制TNF-α、IL-1、IL-6等炎症介质的合成[12,13]。这样形成一种促炎症反应与抗炎症反应之间的多环节反馈调节机制,以维持机体内炎症介质与抗炎介质之间的平衡。我们推测本实验在检测的时候外周血中的TNF-α水平可能已经由高值降为了正常水平,其原因可能是激发了其他细胞因子在一定程度上抑制TNF-α的产生,关于这一点还有待进一步研究。本实验研究表明,重组蛋白 GST-CPAFm能在BALB/c小鼠体内引起肺组织炎症损伤和细胞因子TNF-α和IL-6的水平升高,推测肺损伤可能与其引起TNF-α和 IL-6的水平升高有关,在一定程度上证实CPAF可能是Cpn的一个重要致病因子,为进一步研究CPAF蛋白的生物学功能奠定了实验基础。
3 讨论
CPAF是第一个发现的由衣原体基因编码合成并分泌到宿主细胞内的蛋白酶样活性因子,可降解宿主细胞的转录因子RFX5、USF-1和裂解角蛋白8并具有很强的免疫活性,在衣原体的致病过程中及衣原体与宿主的相互作用中发挥着重要作用[9,10]。
本实验将复性纯化的GST-CPAFm重组蛋白,经SDS-PAGE和Western blot鉴定后按鼻内滴入和尾静脉两种途径接种BALB/c小鼠,观察BALB/c小鼠肺组织的病理变化。结果发现两种方式都能引起BALB/c小鼠出现局灶性肺炎,表现为肺泡间隔增厚,伴较多炎症细胞浸润,病变较重者支气管周围及血管周围可见淋巴细胞浸润,对照组未见明显变化。对BALF的检测显示白细胞总数以及炎症因子TNF-α和IL-6的水平显著升高。此外,尾静脉注射 GSTCPAFm重组蛋白的小鼠外周血炎症因子IL-6、TNF-α水平也明显升高。
IL-6 和 TNF-α是重要的促炎介质。IL-6、TNF-α两者在炎症反应急性相中联系紧密,TNF-α等可诱导IL-6生成,IL-6刺激肝脏产生大量的C-反应蛋白(C-reactive protein,CRP),而血中CRP水平是反映机体炎症反应的敏感指标。IL-6主要由单核-吞噬细胞、血管内皮细胞、成纤维细胞等产生,该因子具有范围较宽的体液免疫、细胞免疫作用和促凝血作用,与炎症反应、组织损伤有关系。IL-6能诱导纤维蛋白原产生、启动凝血因子,刺激炎症部位形成微血栓,抑制内皮细胞修复,使血管受损及高通透状态延迟,并伴有组织炎性细胞浸润及气管肺泡粘膜损伤,使炎症进一步恶化,造成肺损伤。另一方面一定程度的升高,可以使炎症局限化,对机体具有保护作用[11]。显然,重组蛋白CPAF可以引起肺组织的炎症损伤,且细胞因子在其中扮演了更重要的角色。
实验发现尾静脉注射GST-CPAFm重组蛋白的外周血中的TNF-α水平并没有升高。这与某些研究
1 Kumar S,Hammerschlag M R.Acute respiratory infection due to Chlamydia pneumoniae:current status of diagnostic methods[J].Clin Infect Dis,2007;44(4):568-576.
2 周 洲,吴移谋.衣原体主要外膜蛋白的研究现状[J].国外医学·微生物学分册,2005;28(2):29-31.
3 Samransamruajkit R,Jitchaiwat S,Wachirapaes Wet al.Prevalence of mycoplasma and chlamydia pneumonia in severe community-Acquired pneumonia among hospitalized children in Thailand[J].Jpn J Infect Dis,2008;61(1):36-39.
4 刘 玮,何 平,成 蓓et al.肺炎衣原体对 SR-A1和 CD36表达的影响及相关信号机制研究[J].中国免疫学杂志,2009;25(11):973-977.
5 Zhong G,Fan P,Ji Het al.Identification of a chlamydial protease-like activity factor responsible for the degradation of host transcription factors[J].J Exp Med,2001;193(8):935-942.
6 Halvoren D S,Borvik T,Njolstad Iet al.Chlamydia pneumoniae IgA-and IgGantibodies in young survivors of myocardial infarction a comparison of antibody detection by a microimmunofluorescence test and an enzyme immunoassay[J].Intern Med J,2002;251(2):142-147.
7 郑江花,吴移谋,刘佳强et al.肺炎嗜衣原体蛋白酶样活性因子免疫优势区基因重组蛋白在早期诊断中的应用[J].微生物学报,2008;48(4):520-525.
8 Rawadi G,Roman-Roman S.Mycoplasma membrane lipoproteins induced proinflammatory cytokinesby a mechanism distinctfrom thatof lipopolysaccharide[J].Infect Immun,1996;64(2):637-643.
9 Zhong G,Liu L,Fan Tet al.Degradation of t ranscription factor RFX5 during the inhibition of both constitutive and interferon gammar inducible major histocompatibility complex class I expression in chlamydia infected cells[J].J Exp Med,2000;191(9):1525-1534.
10 Dong F,Su H,Huang Yet al.Cleavage of host keratin 8 by a Chlamydia secreted protease[J].Infect Immun,2004;72(7):38632-38638.
11 Finlay B B,McFadden G.Anti-immunology:evasion of the host immune system by bacterial and viral pathogens[J].Cell,2006;124(4):767-782.
12 Mijatovic T,Kruys V,Caput Det al.Interleukin-4 and-13 inhibit tumor necrosis factor-alpha mRNA translational activation in lipopolysaccharide-induced mouse macrophages[J].J Biol Chem,1997;272(22):14394-143981.
13 Zhou Y,Lin G,Baarsch Met al.Interleukin-4 suppresses inflammatory cytokine gene transcription in porcine macrophages[J].J Leukoc Biol,1994;56(4):507-513.

