阳极泥中锡含量测定方法研究 *
黄 涛,王 铭,杨谅孚,项琼宏
(昆明冶金研究院,云南 昆明 650031)
阳极泥由于其成分复杂,在对其中锡的含量进行测定时,通常会受到很多其他元素的干扰。传统测定阳极泥中锡含量的方法是铝片还原碘量法[1],但当阳极泥中含铜量超过 10 mg时滴定终点不稳定;砷、铋超过 10 mg,锑含量超过 20 mg时由于被还原为单体状态析出,影响滴定终点的判定,并对锡有吸附作用,使结果偏低。试验基于铝片还原碘量法,样品用过氧化钠熔融,研究了用 4种方法分离干扰元素:氢氧化钠沉淀分离法、氨水-氯化铵分离法、盐酸介质中使用铁粉分离法以及硫酸介质中使用铁粉分离法来去除干扰元素。经试验表明,硫酸介质中使用铁粉分离法效果最佳,该法终点易观察,测定结果稳定准确,该方法适用于测定阳极泥中质量分数含量为 1%以上的锡,相对标准偏差为 0.095%~0.41%。
1 实验部分
1.1 主要试剂
1)硫酸 (分析纯):配制成硫酸 (1+2)溶液。
2)还原铁粉 (化学纯)含铁量不少于 93%。
3)纯铝片:含量 99.5%以上,刨成片状。
4)碳酸氢钠饱和溶液。
5)可溶性淀粉: (分析纯)配置成 1%水溶液,煮沸,冷却后使用。
6)锡标准液:准确称取纯锡 99.99% (已去掉表面氧化物)4.0000 g于 400 mL烧杯中,加入盐酸 200 mL,盖表面皿放置过夜,不溶物加热溶解,移入2000 mL容量瓶中,用水稀释至刻度,摇匀,此溶液每毫升含锡 2 mg。
7)碘酸钾标准溶液 (约0.0055 mol/L):称取 11.80 g碘酸钾置于 500 mL烧杯中,加 300 mL热水,搅拌至试剂溶解完全后,冷却至室温,移入10000 mL试剂瓶中,加 3 g氢氧化钾,摇匀,加50 g碘化钾,再用水稀释至10000 mL,摇匀 (溶液 pH 9左右)。标定:取锡标准溶液 20.0 mL于300 mL锥形瓶中,补加盐酸和水,使溶液为 6 mol/L盐酸介质,体积 110 mL,再加 2~3 g铝片,装上盖氏漏斗,以下操作同实验方法,用碘酸钾标准溶液滴定至终点。
1.2 实验方法
称取0.1000~0.1500 g试样于高铝坩埚中,加入为试样重 8~10倍过氧化钠并搅匀,上面再覆盖少许。移入马弗炉中在 650~750℃中熔融 20~30 min。取出冷却后放入盛有 30 mL硫酸 (1+2)的 100 mL烧杯中,浸取熔块,煮沸,冷却,取出坩埚用蒸馏水洗净后加入 2 g还原铁粉,加热煮沸到沉淀凝聚,并不时摇动烧杯促进其作用,趁热用盛有脱脂棉的漏斗过滤,滤液收集于 250 mL锥形瓶中,用硫酸 (1+2)洗涤沉淀和烧杯 4~5次,弃去沉淀。此时应控制锥形瓶中溶液体积为 80~100 mL,补加盐酸 (1+1)至 150 mL,于锥形瓶中加 2~3 g铝片,不断摇动锥形瓶,使还原作用完全,直到溶液中仅剩下少量铝片,而还原作用较为缓慢时,立即盖上盛有碳酸氢钠饱和溶液的盖氏漏斗,于低温处加热还原至溶液清亮,取下,流水冷却至室温,应随时补加盖氏漏斗中的碳酸氢钠饱和溶液,使其液面不低于出气口,取下盖氏漏斗,快速加入 5 mL 1%淀粉 (滴定前加入2 g KI/100 mL),立即用碘酸钾标准溶液滴定至蓝色 1 min不褪色为终点。同时进行空白试验。
2 结果与讨论
2.1 阳极泥中共存元素对铝片还原碘量法的影响
对铝片还原碘量法测定锡有干扰的元素主要有:铜、砷、钨、钼、锑、铋、锗、铬、钒、铌、钽和氟。在阳极泥中主要的干扰元素有:铜、砷、锑、铋。
实验证明铜的影响较为复杂。当锡的含量较高,铜的含量少于 3 mg无显著影响。当用铝片或铁粉还原时,铜被还原析出金属铜吸附锡,加热时又能使金属铜部分溶解呈一价形态。由于溶液中所存在的亚铜离子使过量的碘还原,以致滴定终点不稳定,并消耗碘溶液,造成结果偏高。为了消除其干扰,大量铜应预先分离。
砷对测定有干扰。被还原析出的元素砷,能吸附溶液中的锡,使结果偏低,同时也影响滴定终点的辨别,大于 10 mg即有影响。铋也被还原析出铋,虽然对终点观察的影响远不及砷严重,但大于30 mg的铋易使滴定终点消失。
锑也能被铝还原,其对锡产生吸附作用,以致结果偏低。但锑又可使少量四价锡还原为二价,使结果稍增高。因此,锑量大于 15 mg时锡的结果不稳定。
利用 As3+、Sb3+、Bi3+、Cu2+的氧化还原反应,加入铁粉,可使溶液中锡与其他干扰元素分离。锡仍以 SnSO4离子存在于溶液中,而 As、Sb、Bi、Cu干扰元素则进入置换渣。
2.2 熔剂的选择
分解含锡阳极泥最有效和最常用的方法是碱熔融法。经实验表明,过氧化钠熔融法、锌粉还原焙烧法均能很好地分解样品,其中使用锌粉还原焙烧法还能达到去除一些杂质元素的效果,但由于其费时较多,并且在硫酸介质中使用铁粉分离能够很好地去除杂质元素,故我们选择使用过氧化钠熔融法。
2.3 不同分离方法的效果
锡的分离方法,主要有沉淀、挥发 (或蒸馏)以及萃取等方法。此外离子交换法也有应用。但在试验中只采用了沉淀法作为主要的分离方式,因为其对设备要求低,分离效果好、迅速、便捷。由于没有相应的阳极泥标样,试验中用锡精矿标样和阳极泥试样,检验方法的回收率。
2.3.1 硫酸介质铁粉分离法锡的分析结果
用所拟定的试验方法,对阳极泥中锡的含量进行了测定,结果详见表1。
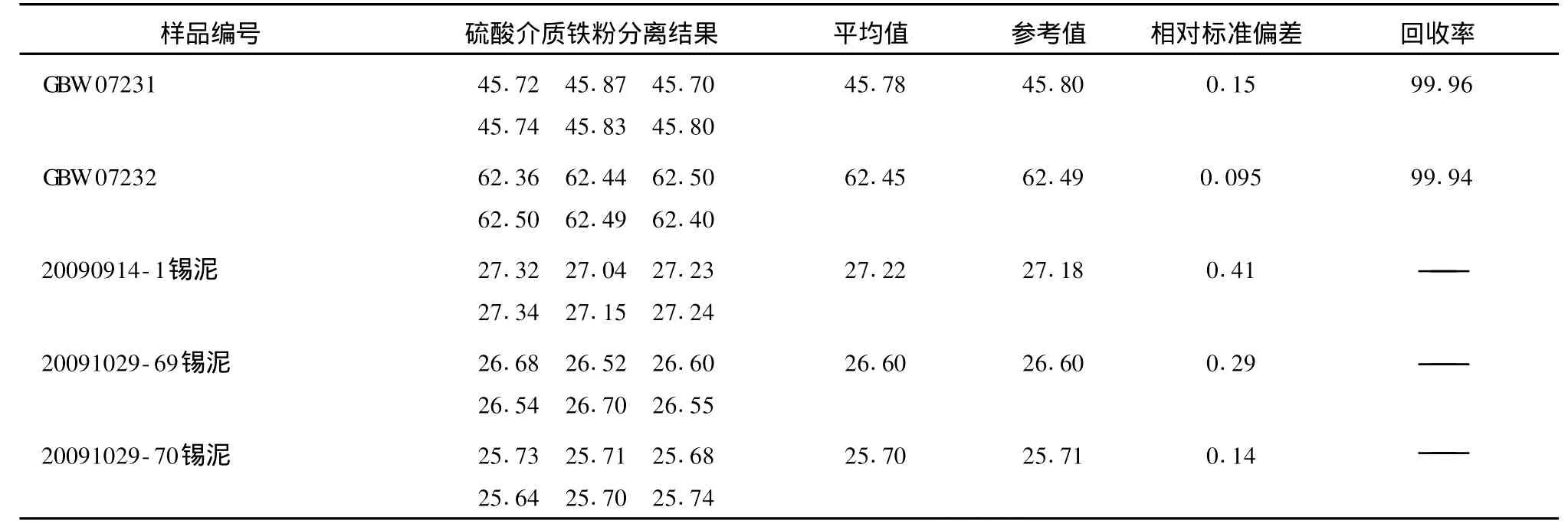
表1 硫酸介质铁粉分离法锡的分析结果Tab.1 Analysis result of tin separated by iron powder in Sulfuric acid %
由表1可以看出,利用硫酸介质铁粉分离法能够将大部分铜、砷、铋、锑分离出来,测定结果稳定可靠,重现性好,操作简便。
2.3.2 氢氧化钠沉淀分离法
试样经碱熔浸取分离后,加入氢氧化钠,锡能与大部分生成氢氧化物沉淀的金属离子分离,经过滤,收集滤液,使用浓盐酸调节滤液至微酸性,补加盐酸 (1+1),加入铝片,以下操作同试验方法。检测结果见表2。
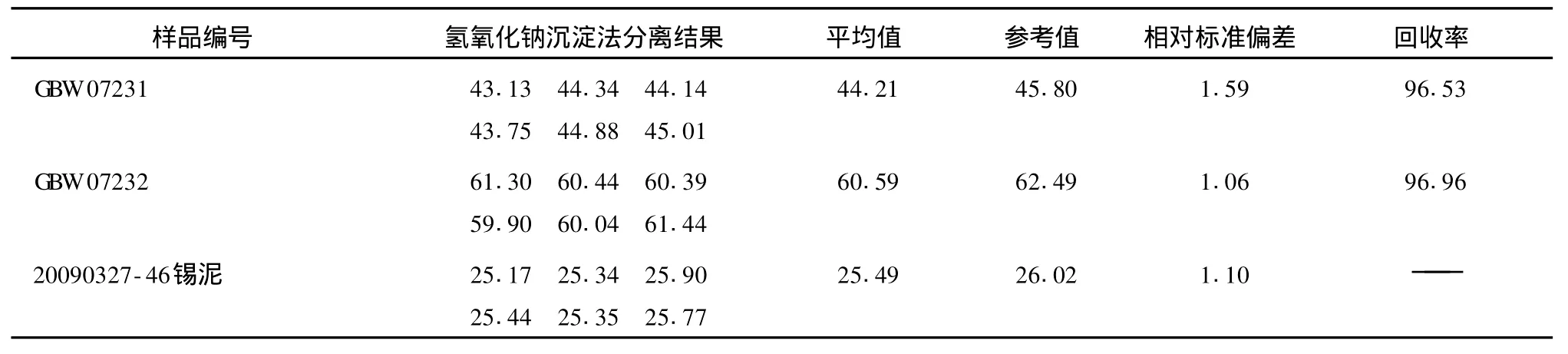
表2 氢氧化钠沉淀分离法锡的分析结果Tab.2 Analysis result of tin separated by sodium hydroxide precipitation %
由表2可以看出,利用氢氧化钠沉淀分离法能够很好地去除溶液中的铜,但由于砷、铋、锑均能存在于碱性溶液中,不能被分离,而且生成的氢氧化物沉淀容易对锡造成吸附,测定结果偏低,重现性差,操作繁琐。
2.3.3 盐酸介质铁粉分离法
分析方法同实验方法,但其中浸取的酸和滤渣洗液为盐酸 (1+1)。检测结果见表3。
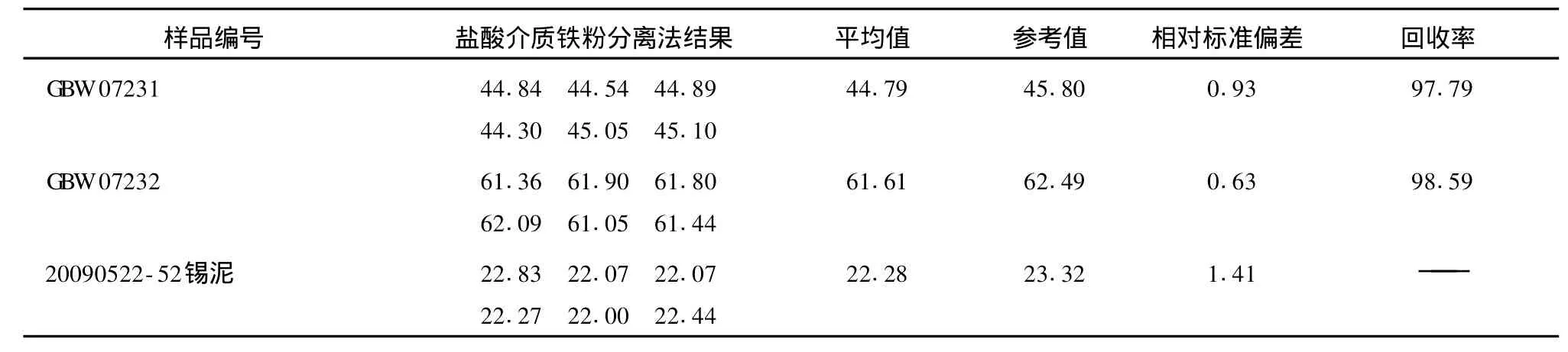
表3 盐酸介质铁粉分离法锡的分析结果Tab.3 Analysis result of tin separated by iron powder in hydrochloric acid %
由表3可以看出,由于在盐酸介质中一部分Cu2+会与盐酸络合形成 [CuCl4]2-,从而不参与铁粉的反应直接进入溶液中,造成铜离子分离不完全,影响终点的观察,使测定结果偏低,重现性差。
2.3.4 氨水-氯化铵分离法
样品经盐酸、硝酸溶解,用氨水-氯化铵分离法将锡沉淀,过滤,用氨水溶液洗涤沉淀后用盐酸将沉淀溶解,加适量铝片,以下操作同实验方法。再将洗净的滤纸熔解后使用极谱法[2]测量其中的微量锡,最后将两部分结果加和得到总锡含量。检测结果见表4。
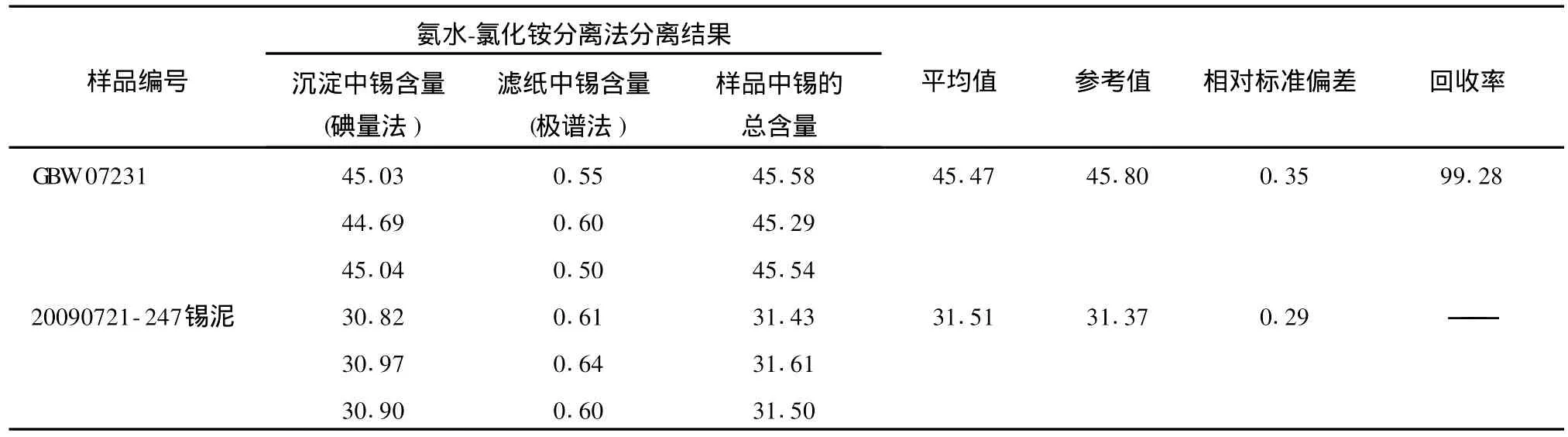
表4 氨水-氯化铵分离法锡的分析结果Tab.4 Analysis result of tin by ammonia-ammonium chloride separation method %
由表4可以看出,锡与铜的分离可用氨水-氯化铵分离法将锡沉淀为氢氧化物,但由于此法对砷、铋、锑的分离效果不理想,而且氢氧化物对锡产生吸附,需用极谱法补正。
3 结 语
通过上述实验表明:4种分离方法都能达到分离干扰元素的效果,滴定终点清晰,但氢氧化钠沉淀分离法、盐酸介质铁粉分离法及氨水-氯化铵分离法都存在测定结果偏低,重现性差,操作繁琐等问题,用硫酸介质铁粉分离法测定结果稳定可靠,重现性好且操作简便。
[1]北京矿冶研究总院分析室.矿石及有色金属分析手册 [M].北京:冶金工业出版社,1990.
[2]李 蓉.草酸-次甲基蓝极谱法测定有色金属矿石中微量锡[J].冶金分析,2003,23(6):68-69.
[3]GB/T 15924-1995,锡矿石化学分析方法:碘量法测定锡量[S].
[4]周 康,纳洪良.碘量法快速测定含铜试料中的锡 [J].云南冶金,1998,27(7):70-71.
[5]李春华.铝还原碘量法测量复杂矿种中的锡 [J].湘南学院学报,2009,30(2):64-66.

