XeCl准分子激光辐照对溶菌酶结构的影响
倪志华, 陈景春, 张玉明, 葛大勇,赵晓辉, 王淑芳
1.河北大学生命科学学院,保定 071002;2.河北大学物理科学与技术学院,保定 071002
引言
蛋白质的折叠与去折叠是结构生物学领域的重要研究方向[1]。采用物理或化学的方法改变蛋白质的高级结构,进而使用光谱学和生物学方法研究蛋白质的去折叠过程,是目前结构生物学广泛采用的技术路线之一[2~6]。随着激光生物学的发展,激光在蛋白质结构研究中的应用得到了广泛关注。Zhang等[7]成功使用激光偏振光技术检测了生物芯片的抗体蛋白,令激光替代传统荧光标记技术无损检测生物芯片显示出诱人的应用前景,同时,也使激光辐照与蛋白质作用关系的研究显得尤为迫切。Yasuyuki[8]和Oujja[9]分别报道了激光辐照对蚕丝蛋白和胶原蛋白的影响,结果显示,高强度激光辐照会显著改变蛋白质的高级结构;Soustov[10]使用308 nm XeCl准分子激光辐照眼晶状体蛋白,发现激光引发了蛋白质的光聚合现象;Yoshikawa等[11]使用飞秒激光器考察激光与葡萄糖异构酶的相互作用,探讨了不同波长和能量的激光对蛋白质高级结构的影响。目前的文献多侧重于报道激光辐照引起的蛋白质结构变化,然而,蛋白质多具有生物活性,综合考察激光辐照引起的蛋白质结构、生物活性及分子水平构效关系的变化,具有更为重要的理论意义,并且可为生物芯片检测装备的研制提供必要的技术支持。
溶菌酶 (lysozyme,EC3.2.1.7)是一种单体球蛋白,由129个氨基酸组成,含有4对二硫键,6个色氨酸 (Trp),分子中不含有其它非氨基酸的组分,在生化领域应用广泛。溶菌酶的分子结构简单明确,且分子内的色氨酸可作为内源荧光探针[12],是研究蛋白质结构变化的良好模型。本文中,我们利用308 nm的XeCl准分子激光器处理溶菌酶,借助荧光光谱和核磁共振技术分析了蛋白质的结构变化,并结合电泳技术及生物活性测定等生物学实验方法,考察了激光辐照对蛋白质结构与功能的影响。
材料与方法
实验材料及仪器
溶菌酶为 Sigma公司进口分装,溶菌酶活性测定试剂盒为南京建成科技有限公司产品,D2O为美国Cambridge Isotope Laboratories,Inc.产品,其它试剂均为分析纯。
溶菌酶溶液用20mmol/L NaAc-HAc缓冲液 (pH5.2)配制。
XeCl准分子激光器为美国Coherent公司产品,型号为Compex Pro205,输出波长308 nm,脉宽为20 ns;稳态瞬态荧光光谱仪为英国Edinburgh Instruments公司产品,型号为FLS 920;蛋白电泳仪为美国BIO-RAD公司产品,型号为BIO-RAD Model 250/2.5;核磁共振光谱仪为瑞士Bruker公司产品,型号为Bruker AVANCEⅢ 600MHz。
激光辐照溶菌酶溶液
溶菌酶溶液的浓度为2.5 g/L。使用XeCl准分子激光器 (激光波长308 nm,能量密度0.3m J/mm2,频率5 Hz,光斑面积1 cm×4 cm)辐照处理,脉冲数分别为25、50、100、200、600、1200、1800、3600和7200,实验过程中保持25℃的恒温。辐照处理后,立即进行分析检测,取未经辐照处理的样品为对照。
荧光光谱分析
激发波长定为295 nm, (25±1)℃下扫描3次,扫描波长范围为300~450 nm。荧光光谱激发光谱分辨率为3 nm,发射光谱分辨率为1 nm。
溶菌酶生物活性测定
依检测试剂盒中的空白对照法测定溶菌酶辐照处理后的生物活性,与未经辐照处理的对照样品进行比较分析。
SDS-PAGE分析
为研究激光辐照后溶菌酶的存在形式和分子间的作用机制,参考边六交等人[13]的方法,以还原和非还原SDS-PAGE法检测溶菌酶结构的变化。SDS-PAGE分析使用常规的蛋白质电泳方法[14]。
核磁共振1H谱分析
以含5%D2O的20mmol/L NaAc-HAc缓冲液配置1mmol/L的溶菌酶溶液,分别辐照处理1800、3600和7200个脉冲后,分析溶菌酶1H谱的变化。操作参考Bachmann等[15]的实验进行。
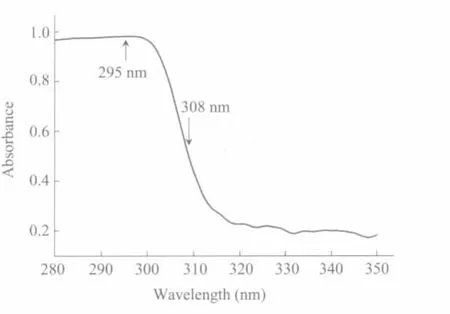
图1 溶菌酶溶液在280~350 nm波长的吸收光谱Fig.1 Absorption spectrum of lysozym e so lution at the wavelength of 280~350 nm

图2 XeCl辐照后溶菌酶体系的荧光光谱 从上到下依次是溶菌酶溶液经XeCl激光辐照25、50、100、200、0(对照)、600、1200、1800、3600和7200个脉冲后,蛋白激发光谱的变化情况 (激发光波长为295 nm)Fig.2 lntrinsic relative fluorescence intensity(RFI)of lysozym e after laser irradiation From top to bottom:changes of protein excitation spectrum of lysozyme solution after XeCl laser irradiation of 25,50, 100,200,0(control),600,1200,1800,3600 and 7200 pulse(excitation light wavelength is 295 nm)
结果与讨论
XeCl辐照后溶菌酶内源荧光光谱的变化
图1为2.5 g/L溶菌酶溶液的吸收光谱。由于溶菌酶分子内含有色氨酸、苯丙氨酸和酪氨酸,其最大吸收波长为295 nm,且在308 nm处有较强吸收,其摩尔吸收系数ε分别为5645和3240。
图2显示了激光辐照后溶菌酶荧光光谱的变化。由图可见,其333 nm处的内源荧光强度出现了有规律的变化,与未经辐照处理的对照样品相比,在25个脉冲的激光辐照后,溶菌酶的内源荧光强度有所加强,之后,随着辐照脉冲数的增大,内源荧光强度又逐渐减弱,但在200个脉冲以内,荧光强度均高于对照组。在高于200个脉冲的激光处理后,溶菌酶的内源荧光强度进一步减弱,并且出现了红移 (36 nm),这在图3中也可以看到。
内源荧光探针色氨酸的最大发射波长为334 nm左右,荧光强度的大小与色氨酸微环境的疏水性相关[16]。当溶菌酶的分子结构发生去折叠变性,即肽链由紧密有序的球状结构转为松散的长链状态,色氨酸所处微环境的疏水性降低,荧光强度也随之降低。经200个及以上脉冲的激光处理后,荧光强度的变化及最大发射波长的红移现象,也验证了这一点。
200个脉冲的激光辐照前,333 nm处的荧光强度出现了增高现象,这可能是由于低剂量的激光处理使溶菌酶的分子结构发生“微调”,色氨酸远离了周围的荧光淬灭基团,从而使荧光强度暂时增加。这与潘婷婷等[17]对溶菌酶的研究结果一致,说明激光辐射对蛋白质高级结构的变化具有阶段性作用。
激光辐照对溶菌酶活力的影响
如图3所示,随着辐照脉冲数的增加,溶菌酶的活力出现先上升再下降的趋势。低于200个脉冲的激光辐照,对溶菌酶的生物活性具有激活作用。随着辐照脉冲数的继续增加,溶菌酶的活力迅速降低。说明高强度的激光破坏了溶菌酶分子的高级结构,导致其生物活性的逐步丧失。
溶菌酶的生物活性以200个脉冲辐照为临界点变化的趋势,与荧光光谱分析的结果相互印证。说明低剂量荧光辐照引起的分子结构的“微调”,有助于增强溶菌酶的生物活性,这与杨芳等[18]盐酸胍处理溶菌酶的试验结果一致。而且,此结果还间接支持了被广泛认可的低能量激光辐照具有临床医疗价值的理论[19]。

图3 溶菌酶体系在XeCl辐照后荧光光谱的红移及酶活变化情况Fig.3 Red shift and relative activity of lysozym e after XeCl laser irradiation
SDS-PAGE检测溶菌酶去折叠过程中的蛋白存在形式
取激光辐照后的溶菌酶样品,分别与还原样品液和非还原样品液混合,进行SDS-PAGE电泳。结果显示,随着辐照脉冲数的增加,溶菌酶分子出现了聚合现象。溶菌酶在被50个脉冲的激光辐照后出现二聚体,200个脉冲辐照后出现二聚体和三聚体,600个脉冲辐照后,又逐渐出现了四聚体,如图4、图5所示;经巯基乙醇还原后,溶菌酶在100个脉冲的激光辐射后才出现二聚体,1800个脉冲辐照后出现三聚体,3600个脉冲辐照后出现四聚体。在两种情况下,二聚体的数量都随着辐照脉冲数的增加而增加。
由此可知,一部分聚合是由于溶菌酶形成了分子间的二硫键,也有一部分二聚体是由于溶菌酶形成了淀粉样沉淀,这些聚合体在加入巯基乙醇还原剂后不能打开,说明可能有其他的结合方式参与了聚合体的形成,比如强的非共价相互作用等。边六交等[13]在研究变性溶菌酶的稀释复性过程时,也有过类似的报道。
激光辐照后溶菌酶的1H谱变化
1H-NMR谱的结果表明,溶菌酶的Trp111、Trp63和Trp62经激光辐照后的化学位移发生了变化 (图5),且随着辐照脉冲数的增加而加大。因溶菌酶在308 nm处有较强的吸收,对此波长的激光敏感,高级结构易于被破坏。因此,推测激光辐照后溶菌酶的空间结构受到了影响。
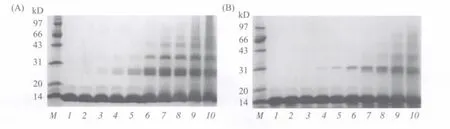
图4 溶菌酶经XeCl激光辐照后的SDS-PAGE (A)SDS-非还原电泳结果;(B)SDS-还原电泳结果。M:蛋白质标准分子量;1~10:依次是溶菌酶溶液经XeCl激光辐照0(对照)、25、50、100、200、600、1200、1800、3600和7200个脉冲后的结果Fig.4 SDS-PAGE of lysozym e a fter XeCl laser irradiation (A)Non-reducing SDS-PAGE; (B)Reducing SDS-PAGE.M:Protein marker;1~10:Results of lysozyme solution after XeCl laser irradiation of 0(control),25,50,100,200,600,1200,1800,3600 and 7200 pulse

图5 激光辐照后溶菌酶结构变化的1H-NMR谱 从上到下的辐照脉冲数分别是0、1800、3600和7200Fig.5 1H-NMR study of lysozym e a fter laser irradiation Numbers of laser irradiation pulse (from top to bottom)are 0,1800,3600 and 7200
结论
溶菌酶经308 nm XeCl准分子激光辐照后,其荧光光谱、活性和电泳行为都发生了改变。低脉冲数的激光辐照对溶菌酶有一定的激活作用,表现为荧光强度增高和活性增强,但是,随着辐照脉冲数的继续增加,溶菌酶分子发生了聚合,荧光强度降低,活性丧失,色氨酸1H的化学位移也发生了变化,说明高级结构的变化使得溶菌酶的功能逐渐丧失。
本实验就激光辐照对酶的影响机制作了初步探索,为激光辐照诱导蛋白质去折叠机制的研究提供了实验参考。
1. Baker TA.Protein unfolding trapped in the act.Nature, 1999,401:29~30
2.Tan CY,Xu CH,Ruan KC.Folding studies of two hydrostatic pressure sensitive proteins. Biochim Biophys Acta,2006,1764(3):481~488
3.钟葵,胡小松,吴继红,陈芳,廖小军.高压脉冲电场对脂肪氧化酶二级和三级构象的影响效果.光谱学与光谱分析,2009, 29(3):765~768 Zhong K,Hu XS,W u JH,Chen F,Liao XJ.Effects of high pulsed electric field on the secondary and tertiary structure of lipoxygenase.Spectrosc Spect Anal,2009, 29(3):765~768
4.Subhankar P,Madhuchhanda K,Kali PD,Saroj M,Tapan KC. Unfolding studies of Escherichia co li m altodextrin glucosidase monitored by fluorescence spectroscopy.J Bio l Phys,2008,34:539~550
5.John JB,Elizabeth JJ,Robert JL.Nonresonant fem tosecond laser vaporization of aqueous protein preserves folded structure. Proc Natl Acad Sci USA, 2011, 108(30): 12217~12222
6.Salvetti G,Tombari E.The endotherm ic effects during denaturation of lysozyme by temperature modulated calorimetry and an intermediate reaction equilibrium.J Phys Chem B,2002,106(23):6081~6087
7.Zhang HY,Lu H,LiW,Liang RQ,Jin KJ,Zhou YL,Ruan KC,Yang GZ.Detection of m icroarray protein biomolecules by oblique-incidence reaectivity difference technique without labelling agents.Chin Physics B,2008,17(6):2288~2291
8. Yasuyuki T,Masaharu G,Akira I.Pulsed laser deposition of silk protein: Effect of photosensitized-ablation on the secondary structure in thin deposited film s.J Appl Phys, 2001,89(12):7917~7923
9. Oujja M,Rebollar E,Abrusci C,Am o AD,Catalina F, Castillejo M. UV, visible and IR laser interaction w ith gelatine.J Phys:Conf Ser,2007,59:571~574
10.Soustov LV,Chelnokov EV,Sapogova NV,Bityurin NM, Nemov VV,Sergeev YV,Ostrovsky MA.Aggregation of crystallins induced by pulsed laser UV light(308 nm). Biophysics,2008,53(4):273~282
11.Yoshikawa HY,Murai R,Hasenaka H,Takahashi Y, Maruyama M, Sugiyama S, Adachi H, Takano K, Matsumura H,Murakam i S,Inoue T,Mori Y.Influence of energy and wavelength on fem tosecond laser-induced nucleation of protein.Chem Phys Lett,2011,510:139~142 12.Tayeh N,Rungassam y T,Albani JR.Fluorescence spectral resolution of tryptophan residues in bovine and human serum album ins.J Pharm aceut Biom ed,2009,50:107~116
13.边六交,梁长利,杨晓燕,刘莉.非还原脲变性蛋白溶菌酶稀释复性过程中集聚现象的研究.化学学报,2007,65(24): 2891~2897 Bian LJ,Liang CL,Yang XY,Liu L.Aggregation interaction am ong non-reducing egg white lysozymes denatured by urea during their refolding.Acta Chim Sin,2007,65(24): 2891~2897
14.郭尧君.蛋白质电泳实验技术.北京:科学出版社,1999. 123~160 Guo YJ.Experimental technology of protein eletrophoresis. Beijing:Science Press,1999.123~160
15.Bachmann A,Segel D,Kiefhaber T.Test for cooperativity in the early kinetic intermediate in lysozyme folding. Biophys Chem,2002,96:141~151
16.Albani JR.New insights in the interpretation of tryptophan fluorescence.J Fluoresc,2007,17:406~417
17.潘婷婷,储艳秋,张剑霞,吴波,吴梁,丁传凡.电喷雾质谱研究乙腈诱导的溶菌酶的构象变化.复旦学报(自然科学版),2008,47(4):449~460 Pan TT,Chu YQ,Zhang JX,Wu B,Wu L,Ding CF. Acetonitrile induced conformational transitions of lysozyme studied by electrospray ionization mass spectrom etry. J Fudan Univ(Nat Sci),2008,47(4):449~460
18.杨芳,梁毅,杨芳(小).脲和盐酸胍诱导溶菌酶去折叠的荧光相图法研究.化学学报,2003,61(6):803~807 Yang F,Liang Y,Yang F(xiao).Unfolding of lysozym e induced by urea and guanidine hydrochloride studied by phase diagram m ethod of fluorescence.Acta Chim Sin, 2003,61(6):803~807
19.Aimbire F,de Lima FM,Villaverde AB,Albertini R,de O liveira APL, Neto HCCF. Low-level laser therapy associated to N-acetylcysteine lowers macrophage inflammatory protein-2 (MIP-2) m RNA expression and generation of intracellular reactive oxygen species in alveolar m acrophages.Photom ed Laser Surg,2010,28(6): 763~771

