血啉甲醚对单增李斯特菌的光动力灭活作用及机理*
林少玲,唐书泽,唐姝姝,吴希阳,陈振强
光动力技术是指生物组织中的光敏物质受到相应波长光照后,吸收光子能量,由基态跃迁到激发态,并迅速退激释放能量而返回基态的过程。该过程能够生成大量活性氧,活性氧与多种生物大分子相互作用,从而损伤细胞结构或影响细胞功能[1-2]。在医学上,利用光动力反应进行疾病诊断和治疗的技术称之为光动力疗法 (photodynamic therapy,PDT),目前主要用于恶性肿瘤和皮肤癌的治疗[3],在血液制品消毒等方面的作用也得到了广泛认同,其安全性也得到了较为详尽的论证[4-5]。
光动力灭菌技术 (anti-microbial photodynamic technology,APDT)是在光动力技术的基础上,利用光敏剂对细菌的优先聚集特性,在适当波长的光激发下,使光敏剂吸收能量后产生单线态氧、自由基等活性氧物质进而通过氧化作用杀伤微生物,而不伤害周围组织和细胞的一项新技术[6]。抗生素是目前抑制或杀灭病原微生物的主要手段,但近年来随着抗生素滥用导致了诸如“超级细菌”爆发等事件的不断出现,使人们开始寻找抗生素之外有效且安全的抑菌或杀菌方法[7]。APDT已被证实具有显著的杀伤耐药菌的作用[8],本课题组前期研究已证实其对曲霉孢子[9]、金黄色葡萄球菌[10]、蜡样芽胞杆菌和大肠杆菌[11]具有很好的光动力灭活作用。
单核细胞增多性李斯特菌 (L isterisa m onocytogenes),简称单增李斯特菌,是近年来受到特别关注的一种食源性致病菌。在加拿大、美国和欧洲,肉类食品单增李斯特菌食物中毒案例时有报道,感染后发病致死率高达 25%以上[12]。随着我国肉类消费大幅增加,尤其是对冷鲜肉食品的消费,呈迅速上升趋势,肉类食品单增李斯特菌污染导致的潜在食物中毒将更加受到关注。本实验选用单增李斯特菌为实验菌株,研究血啉甲醚 (hematoporyrin monomethyl ether,HMME)作为光敏剂对单增李斯特菌的 APDT灭活效果,并利用聚丙烯酰胺凝胶电泳 (sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDSPAGE)和聚合酶链式反应 (polymerase chain reaction,PCR)技术分析 HMME对单增李斯特菌菌体蛋白和基因组 DNA的光动力影响,探讨光动力灭菌技术的作用机理。
1 材料和方法
1.1 材料
1.1.1 菌株
单增李斯特菌,广州市疾病预防控制中心。
1.1.2 培养基
细菌计数培养基和胰蛋白胨大豆肉汤培养基(tryptone soy broth,TSB),青岛海博生物技术有限公司。
1.2 主要试剂和仪器
血啉甲醚 (10 mg/mL,批号 980225),上海第二军医大学五二三药物研究室;U21901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;75 W溴钨灯 (光源光功密度为 200 mW/cm2),北京卓立汉光仪器有限公司;TaqMix和细菌基因组DNA快速提取试剂盒,广州东盛生物科技有限公司。
1.3 引物合成
依据文献[13]针对单增李斯特菌hlyA全基因序列,利用 primer 5.0设计引物,委托上海捷瑞生物工程有限公司合成,其序列如下:上游引物 5’-TGC AAG TCC TAA GAC GCC A-3′下游引物 5’-CAC TGC ATC TCC GTG GTA TAC TAA-3′
1.4 单增李斯特菌的光动力灭活试验
1.4.1 菌株培养及前处理
将活化的单增李斯特菌接种于 TSB培养液中,37℃振荡培养至对数期,离心收集菌体 (4 000 r/min,10 min),弃上清液,重新悬浮菌体于 0.1 mol/L的磷酸缓冲溶液 (PBS)中,使其OD600=0.05(相当于 107CFU/mL左右)。
1.4.2 HMME浓度试验
在 96孔细胞培养板中 (任取 1孔)加入已处理好的 200μL菌悬液,并加入不同浓度 HMME,使其终浓度分别为 1,5,10,25和 50μg/mL,37℃避光孵育 30 min,放在距离溴钨灯光源 20 cm处照射 30 min后进行平板计数 (L+S+)。同时设置不光照和 或不加 HMME组作为对照 (L-S-;L+S-;L-S+)。
1.4.3 光照时间试验
按照 1.4.1方法处理单增李斯特菌后,在 96孔板中 (任取 1孔)各加入 200μL菌悬液并加入HMME,使其终浓度为 25μg/mL,37℃避光孵育 30 min后放在距离溴钨灯光源 20 cm处照射 5,10,20和 30 min后进行平板计数 (L+S+)。同时设置不光照和 或不加 HMME组作为对照 (L-S-;L+S-;L-S+)。
1.4.4 细菌菌落平板计数
1.4.2 和 1.4.3中不同处理方式所得的菌悬液均以 1∶10梯度稀释后涂板于细菌计数培养基平皿中,于 37℃生化培养箱中恒温培养,24 h后取出进行菌落计数。实验重复 3次,取平均值。
1.5 单增李斯特菌菌体蛋白降解和基因组 DNA损伤试验
1.5.1 菌株培养及前处理
按 1.4.1的方法培养单增李斯特菌,离心收集菌体 (4 000 r/min,10 min),弃上清液,重新悬浮菌体于PBS,使其OD600=0.05,在 96孔板中 (任取 4孔 ),每孔加入 200μL菌悬液并加入 HMME,使其终浓度为25μg/mL,37℃避光孵育 30 min后,放在距离溴钨灯光源 20 cm处照射 30 min(L+S+)。同时设置不光照和 或不加 HMME组作为对照 (L-S-;L+S-;L-S+)。
1.5.2 SDS-PAGE分析菌体蛋白降解试验
1.5.1 中 4组实验所得的各 800μL菌悬液置于EP管中,离心弃上清液后 (10 000 r/min,2 min)。加入 20μL无菌去离子水重悬菌体,5μL 4×SDSPAGE上样缓冲液,95℃加热 5 min后进行 SDSPAGE电泳。
1.5.3 PCR分析基因组DNA断裂试验
1.5.3.1 单增李斯特菌基因组 DNA的提取
将 1.5.1实验所得的 4个实验菌株进行基因组DNA的提取,单增李斯特菌基因组 DNA抽提按照试剂盒说明书进行,抽提所得基因组 DNA进行琼脂糖凝胶电泳并作为 PCR检测 hlyA基因的模板。
1.5.3.2 单增李斯特菌 hlyA基因片段 PCR扩增
使用hlyA基因的上下游引物检测上述 4组单增李斯特菌基因组 DNA的断裂情况,PCR反应体系如下:
单增李斯特菌基因组 DNA模板 1μL;2×PCRMix 10μL;
上游引物 1μL;下游引物 1μL;ddH2O 7μL;PCR反应条件:95℃预变性 5 min;95℃变性 30 s,56℃退火 30 s,72℃延伸 30 s,30个循环;最后 72℃延伸 5 min,反应结束,PCR产物进行琼脂糖凝胶电泳。
1.6 统计分析
结果以均数 ±标准差表示,用 GraphPad Prism 5所带的统计软件进行统计学处理。差异显著性采用t检验,P<0.05为显著差异。
2 结果与讨论
2.1 HMM E浓度对单增李斯特菌光动力灭活作用的影响
HMME在 0~50μg/mL内对单增李斯特菌的光动力灭活作用见图1和图2。从图1、图2中可以看出,随着光敏剂 HMME浓度的增加,对单增李斯特菌的光动力灭活作用逐渐增强。当 HMME浓度低至 1 μg/mL的情况下,光照 30 min即可使约 90%的单增李斯特菌灭活。当 HMME浓度达到 50μg/mL时,几乎可完全使单增李斯特菌灭活。而光照对照组及光敏剂对照组,均未显示出明显的杀伤作用。[0]表明一定浓度的 HMME在光照情况下对单增李斯特菌有较好的杀伤作用。
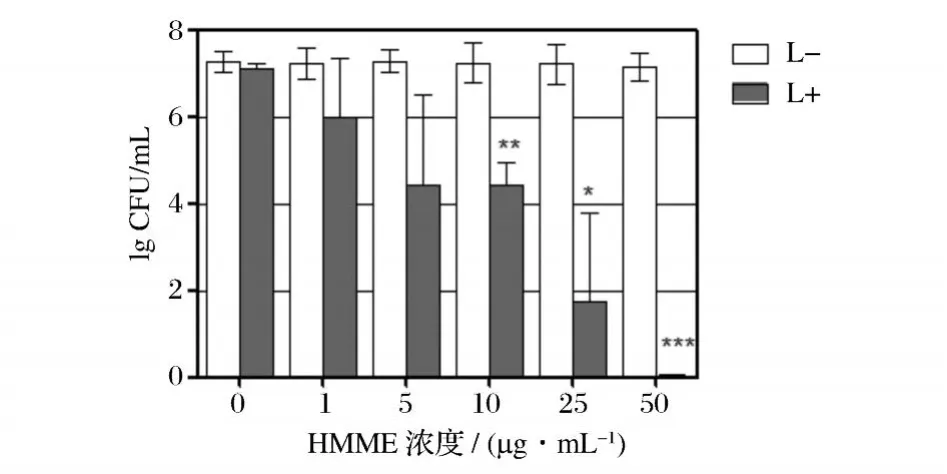
图1 不同浓度 HMME对单增李斯特菌菌落数 (CFU)的影响

图2 不同浓度 HMME对单增李斯特菌失活率的影响
2.2 光照时间对单增李斯特菌光动力灭活作用的影响
图3 和图4显示了 HMME浓度在 25μg/mL时,光照时间对单增李斯特菌的光动力灭活作用的影响。光照 10 min以上,均能使菌落总数降低 2个数量级以上,即 99%以上的单增李斯特菌被灭活;当光照时间达到 30 min时,几乎可以完全杀伤单增李斯特菌,灭活率达到 99.999 9%。表明 HMME在一定浓度下,光动力杀菌技术对单增李斯特菌的光动力杀伤作用随着光照时间的延长而加强。
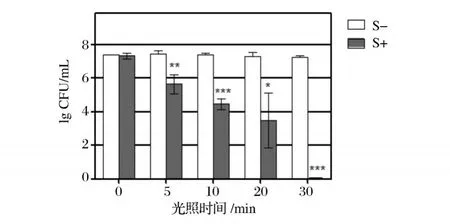
图3 不同光照时间的 HMME对单增李斯特菌菌落数的影响
2.3 HMM E-APDT对单增李斯特菌细菌全蛋白降解效果的影响
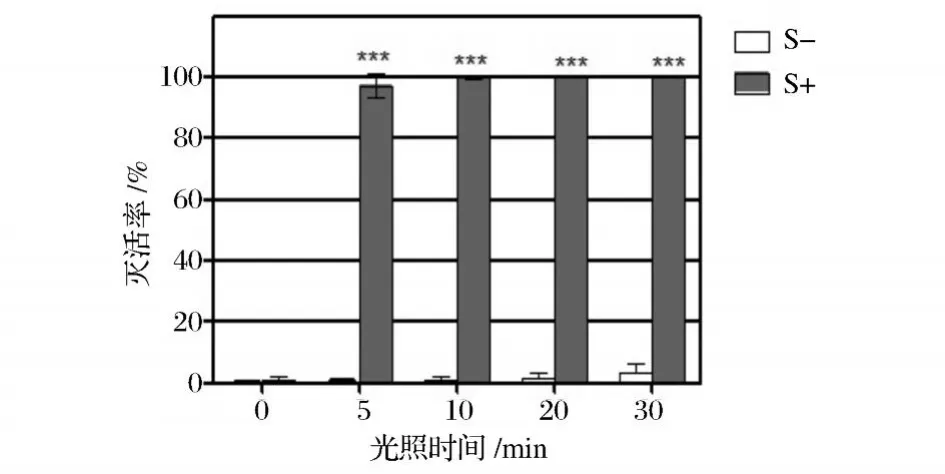
图4 不同光照时间的 HMME对单增李斯特菌失活率的关系
HMME-APDT对单增李斯特菌细菌全蛋白的降解作用见图5,其中条带M是蛋白质分子量标准 (6.5~175 ku),条带 1是光敏剂进行光照的不带菌空白条带,条带 2是不加光敏剂直接进行光照的光照对照组,条带 3是不加光敏剂并且不光照的完全对照组,条带 4是加光敏剂并且进行光照的实验组,条带 5则是加光敏剂不光照的光敏剂对照组。从图中可以明显看出,单增李斯特菌在光敏剂 HMME(25μg/mL),光照 30 min的情况下,其菌体大部分蛋白被降解,只在 20 ku处有一降解不完全的条带。而光照对照组及光敏剂对照组与完全对照组相比较,蛋白条带无明显变化。
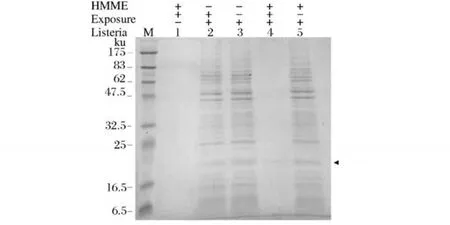
图5 HMME-APDT处理后细菌全蛋白 SDS-PSGE图谱
2.4 HMM E-APDT对单增李斯特菌 DNA全基因组损伤效果影响
HMME-APDT对单增李斯特菌基因组 DNA的影响见图6,其中条带 1是不加光敏剂直接进行光照的光照对照组,条带 2是不加光敏剂并且不光照的完全对照组,条带 3是加光敏剂并且进行光照的实验组,条带 4则是加光敏剂不光照的光敏剂对照组。与完全对照组 (L-S-)、光照对照组 (L+S-)和光敏剂对照组 (L-S+)相对比,经过 25μg/mL的光敏剂HMME和 30 min的光照处理的实验组单增李斯特菌基因组DNA断裂非常明显,几乎看不到 DNA片段。为了更准确比较实验组与试验对照组的基因组DNA的断裂程度,同时进行更为灵敏的 PCR鉴定。
以单增李斯特菌的特异性基因hlyA基因设计引物,进行 PCR,结果见图7,其中条带 M是 DNA分子量标准 (DL 5000),条带 1是不加光敏剂直接进行光照的光照对照组,条带 2是不加光敏剂并且不光照的完全对照组,条带 3是加光敏剂并且进行光照的实验组,条带 4则是加光敏剂不光照的光敏剂对照组。通过光敏剂 HMME(25μg/mL)和 30 min光照处理的实验组仅有微弱的 PCR产物生成,而其余各试验对照组均获得一明亮的特异性 PCR产物条带,且条带大小与所设计的hlyA基因片段 112 bp大小吻合。表明单增李斯特菌在一定浓度光敏剂HMME光照30 min的情况下确实能够引起基因组 DNA断裂,且损伤程度较大。
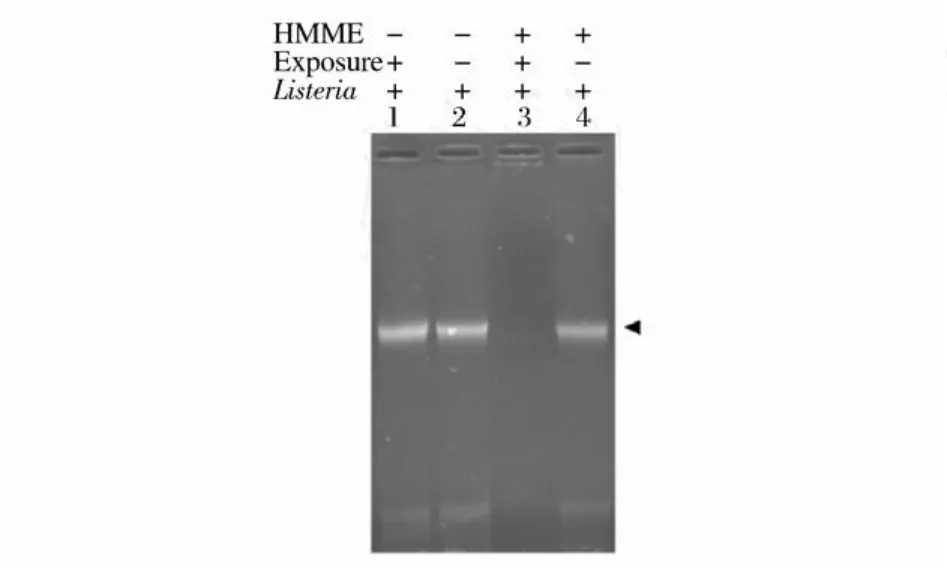
图6 琼脂糖凝胶电泳分析 HMME对单增细胞李斯特菌光动力处理的全基因组图谱
本研究发现光功密度 200 mW/cm2的溴钨灯光照 30 min下,浓度为 25μg/mL的 HMME能杀灭99.999%的单增李斯特菌,光照对照组或光敏剂对照组则未观察到类似杀灭作用。
SDS-PAGE分析发现,HMME-APDT对于活体单增李斯特菌能够有效降解其绝大部分蛋白质,这与前人的研究结果基本一致。Bliss[14]研究报道,光敏剂对细胞的光动力失活效应中主要涉及脂质过氧化和蛋白质变性失活。Tubby[15]等人通过细菌体外试验发现光敏剂能够在光照情况下诱发蛋白质降解。本研究结果进一步表明,光动力技术的灭菌效果,可能是通过氧化降解等途径[16]引起细菌内蛋白降解,从而导致单增李斯特菌失活。
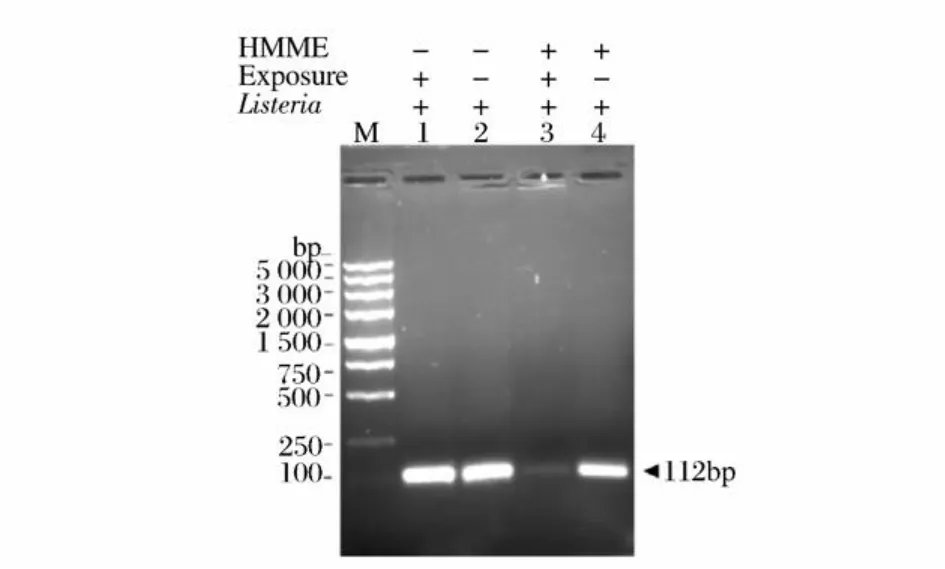
图7 单增李斯特菌 hlyA基因 PCR扩增结果
Menezes[17]在研究光动力灭活大肠杆菌的实验中发现,APDT能够造成其基因组 DNA损伤。本研究中,HMME-APDT被发现同样能够有效降解单增李斯特菌的基因组 DNA。结果表明,HMME-APDT的灭菌作用不仅来自于对细菌蛋白质的变性,还来自于细菌基因组DNA断裂破坏作用。
HMME作为一种新型光敏剂,属于天然产物,因来源广泛,安全性较高,可以作为一种很有前景的灭菌技术应用于肉类食品工业。
3 结论
浓度为 25μg/mL的 HMME在光功密度为 200 mW/cm2的可见光光照 30 min下,对单增李斯特菌的光动力灭活效果高达 99.999 9%,并能导致其蛋白质和基因组降解,表明光动力技术对单增李斯特菌具有极强的灭活作用,蛋白质降解和基因组 DNA受损可能是 HMME-APDT有效灭活单增李斯特菌的作用机理。
[1] Macdonald IJ,Dougherty T J.Basic principlesof photodynamic therapy[J].Journal of Porphyrins and Phthalocyanines,2001,5:105-129.
[2] DolmansD E J G J,Fukumura D,Jain R K.Photodynamic therapy for cancer[J].Nature,2003,3:380-387.
[3] Ochsner M.Photodynamic therapy:the clinical perspective:review on applications for control of diverse tumors and non-tumorous disease[J].Arzneimittel-Forschung-Drug Research,1997,47:1 185-1 194.
[4] Luksiene Z,Peciulyte D,Jurkoniene S,et al.Inactivation of possible fungal food contaminants by photosensitization[J].Food Technology and Biotechnology,2005,43(4):335-341.
[5] Malik Z,Ladan H,Nitzan Y.Photodynamic inactivation of gram negative bacteria:problems and possible solutions[J].Photochemistry and Photobiology,1990,5(B):811-816.
[6] Maisch T.Anti-microbial photodynamic therapy:useful in the future[J].Lasers inMedical Science,2007,22:83-91.
[7] WainwrightM,Phoenix D,Marland J,et al.A Study of photobactericidal activity in the Phenothiazinium Series[J].Fems I mmunology and MedicalMicrobiology,1997,19:75-80.
[8] WainwrightaM,Phoenixa D A,GaskellaM.Photobactericidal activity of methylene blue derivatives against vancomycin resistantEnterococcusspp.[J].Journal of Antimicrobial Chemotherapy,1999,44:823-825.
[9] 李颖,唐书泽,任雅清,等 .光敏化作用对曲霉孢子失活的影响[J].食品与发酵工业,2008,34(8):22-24.
[10] 任雅清,唐书泽,金花,等 .光动力对金黄色葡萄球菌的杀伤作用及其 AFM观察[J].食品与发酵工业,2008,34(8):56-59.
[11] 任雅清,唐书泽,吴希阳,等 .光动力对细菌的杀伤作用研究[J].中国调味品,2008(6):37-40.
[12] Chen Y,ZhangW,Knabel S J.Multi-virulence-locus sequence typing identifies single mucleotide polymorphisms which differentiate epidemic clones and outbreak strains ofListeria m onocytogenes[J].Journalof ClinicalMicrobiology,2007,45(3):835-846.
[13] Rudi K,Nogva H K,Naterstad K.SubtypingListeria m onocytogenesthrough the combined analyses of genotype and expression of thehlyA virulence determinant[J].Journal ofAppliedMicrobiology,2003,94,720–732.
[14] Bliss J M,Bigelow C E,Foster T H,et al.Susceptibility ofCandidaspecies to photodynamic effects of Photofrin[J].Antimicrobial Agents and Chemotherapy,2004,48:2000-2006.
[15] Tubby S,W ilson M,Nair S P.Inactivation of staphylococcal virulence factors using a light-activated antimicrobial agent[J].BMCMicrobiology,2009,9:211.
[16] Hamblin M R,Hasan T.Photodynamic therapy:a new antimicrobial approach to infectious disease[J].Photochemical and Photobiological Sciences,2004,3(5):436-450.
[17] Menezes S,CapellaM A,CaldasL R.Photodynamic action ofmethylene blue:repair and mutation inEscherichia coli[J].Journal of Photochemistry and Photobiology BBiology,1990,5:505-517.

