幽门螺杆菌感染蒙古沙土鼠疾病模型的建立
谢献胜,刘 孟,王小波,李建基, 彭大新
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏畜牧兽医职业技术学院,江苏泰州 225300)
幽门螺杆菌感染蒙古沙土鼠疾病模型的建立
谢献胜1,2,刘 孟1,王小波1,李建基1, 彭大新1
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏畜牧兽医职业技术学院,江苏泰州 225300)
利用蒙古沙土鼠建立幽门螺杆菌(Helicobacterpylori,Hp)NCTC 11637株胃内感染模型。感染方法有两种,方法Ⅰ是沙土鼠禁食18h后用50%酒精0.5mL预处理,6h后接种H p,间隔12h、24h分别再次接种。方法Ⅱ的接种方法同方法Ⅰ,但接种后每日口服雷尼替丁(5mg/k g体重)。胃内接种H p后,于第7天、15天、35天、45天分别用H p抗原酶联免疫诊断试剂盒、细菌培养和胃组织切片的方法观察沙土鼠胃内细菌感染情况和胃病理组织学变化。结果表明,给沙土鼠胃内灌服酒精以损伤胃黏膜并每日口服雷尼替丁,在人工接种35天后,胃内见有多量H p生长,胃组织病变与H p自然感染的病例相似。
幽门螺杆菌;感染;蒙古沙土鼠;疾病模型
自1983年澳大利亚学者Warren和Marshall成功地从人胃黏膜样品中分离到幽门螺杆菌(Helicobacter pylori,Hp)以来,Hp及其相关胃、十二指肠疾病的研究一直是近20年来胃肠病学的热点课题[1]。Hp是一种定植在人胃中的非常多见的病原体,并与慢性活动性胃炎、消化性溃疡和黏膜淋巴样组织淋巴瘤密切相关[2]。幽门螺杆菌感染动物模型在筛选抗Hp特异药物与防治方法、Hp疫苗研制等方面具有重要意义。迄今已报道建立小鼠、大鼠、豚鼠、雪貂、猴、比格犬、小型猪等动物Hp感染动物模型[3,4,5]。有关Hp感染蒙古沙土鼠疾病模型的制作方法及其效果,资料之间存在较大的差异。本实验对利用蒙古沙土鼠制作Hp胃内感染疾病模型的方法及其效果作了探讨,现介绍如下。
1 材料和方法
1.1 菌株及培养
Hp菌种(NCTC11637)由上海消化道研究所提供;培养基为含8%山羊血的哥伦比亚血琼脂,含 TMP5mg/L,多粘菌素 2500U/L,万古霉素10mg/L。微需氧条件培养3-5天[6]。菌种复苏后用布氏肉汤液体培养基培养5天并做细菌计数,然后,用布氏肉汤液稀释至1×109CFU/mL。
1.2 实验动物
蒙古沙土鼠48只,2月龄,体重80g左右。随机分为3组,Ⅰ组是对照组,8只;Ⅱ组、Ⅲ组是实验组,20只/组;雌、雄各半。
1.3 Hp胃内感染的方法
蒙古沙土鼠禁食禁水24h(在禁食禁水18h后灌服50%酒精0.5mL/只),对照组每次灌服生理盐水1mL;实验组灌胃接种Hp3次,Ⅱ组、Ⅲ组每只蒙古沙土鼠接种细菌1mL(109CFU/mL),12h后第二次接种,24h后第三次接种,最后一次接种4h后开始饲喂[7,8]。Ⅰ组、Ⅱ组常规饲喂,Ⅲ组饲料中加入雷尼替丁(每天5mg/kg体重)。
1.4 Hp分离培养和鉴定
于最后一次灌胃后的第7天、15天、35天、45天分别取实验鼠胃和十二指肠球部进行Hp检测。Ⅰ组每次取2只,Ⅱ组、Ⅲ组每次各取5只。实验鼠断颈椎处死后,无菌取胃和十二指肠球部。纵向对称剪开胃和十二指肠。一半样品与布氏肉汤液体培养液匀浆后用于细菌鉴定培养和试剂盒检测,另一半用于病理组织学检查(10%中性福尔马林固定)[9,10]。
1.5 病理学检查
取胃窦,胃底和十二指肠球部做组织切片并作HE和银染色[11]。观察炎症变化和Hp定植情况。
2 结果
2.1 Hp抗原酶联免疫法诊断试剂盒测试结果
接种细菌后第7天和第15天,Ⅰ组均为阴性,Ⅱ组分别有1/5、2/5鼠为阳性,其余为可疑;Ⅲ组分别有3/5、2/5为可疑,其余为阳性。于接种后第35天和第45天,Ⅰ组为阴性(图1),Ⅱ组分别有3/5、5/5为阳性,其余为可疑;Ⅲ组接种后第35天有1/5鼠为可疑,其余为阳性。
2.2 胃组织匀浆细菌分离培养结果
接种Hp第7天,3组均未见Hp生长。第15天,Ⅱ组、Ⅲ组分别有1/5、2/5鼠Hp培养阳性。第35天和第45天,Ⅱ组分别有1/5、2/5鼠Hp培养阳性,Ⅲ组有3/5、3/5阳性。取无色透明的小菌落,用革兰氏染色镜检,见粉红色海鸥状的幽门螺杆菌。
2.3 病理组织学变化
感染Hp第7天胃肠无明显的病理变化,第15天胃黏膜轻微脱落,黏膜层出现炎性细胞浸润(图2);第35天和第45天,胃底部有明显的充血,固有层见有慢性炎症、少量炎性细胞浸润和肠化生现象(图3),胃黏膜层见Hp(图4)。

图1 对照组的胃底(HE×400)

图2 Ⅲ组胃固有层炎性细胞浸润(HE×400)
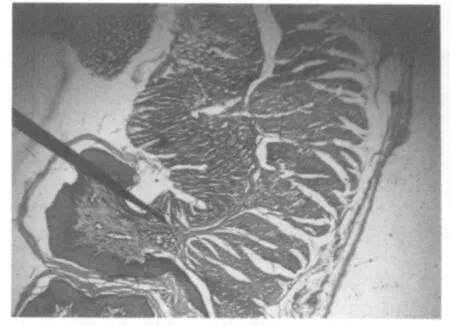
图3 Ⅲ组胃的肠化生现象(HE×100)
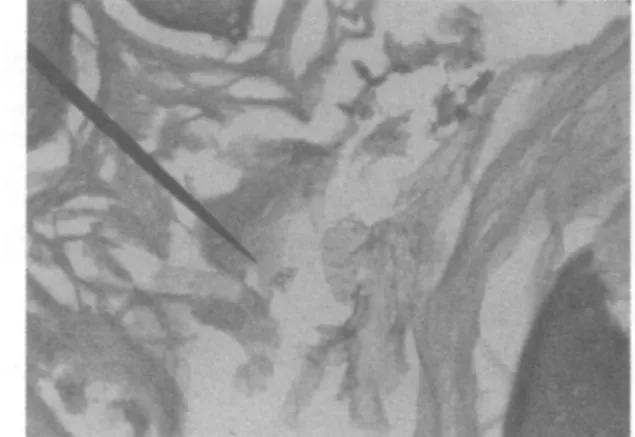
图4 Ⅲ组胃黏膜内有Hp菌体(HE×1000)
3 讨论
Hp是慢性胃炎、消化性溃疡的主要致病因素;与胃腺癌、胃淋巴瘤关系也非常密切,WHO已将其列为一类致癌物[12,13],Hp感染模型的研究具有重要的临床意义。
蒙古沙土鼠(MG)是Hp感染模型的理想实验动物。MG自然患胃炎约2%,亦未见自然感染Hp,但其胃病变与人类最为相似,可发生萎缩、溃疡、肠化生和胃癌[14,15],且是目前唯一单独感染Hp能够诱发胃癌的实验动物[15]。但是造模周期较长,加之对其病理生理研究甚少,一定程度上限制了其应用。
Hp适应弱酸性环境(PH值为5.5-6.5),正常MG胃内pH为0.9-1.8[16]。为了提高Hp感染率,本实验先灌服酒精破坏胃环境,口服雷尼替丁抑制胃酸分泌。王毅超等人采取三种不同的感染预处理实验,结果发现用50%酒精处理的沙土鼠感染率最高[17]。酒精刺激与口服雷尼替丁相结合,可以产生更好的造病效果,且方法简便、易行。
若直接用胃部匀浆进行细菌培养的方法来检测是否感染,检出率非常低。Hp是一种生存、生长条件都非常苛刻的细菌,对培养基及培养条件有很高的要求。当周围环境不利于细菌的生长时,如细菌接种量过多,延长培养,暴露空气(有氧环境)中,温度低、培养基的pH升高等,Hp会产生变异体或不生长[18]。Hp菌落半透明,扁平、圆形,直径约1mm,涂片Gram染色为阴性杆菌,形状呈螺旋状、S状,弧形[19]。Hp初代培养不少于5天或培养1周仍无细菌生长,才能报告阴性。培养期间很容易感染霉菌,尤其湿度掌握不好的情况下更易有霉菌生长。Hp在外界环境中存活的时间非常短,易发生死亡。
从本实验中可以看出,Hp感染需要的时间比较长。感染7天内仅有少量细菌生长,从胃内取样进行细菌培养未见有细菌生长,病理组织学观察只有轻微的炎症反应;35天后胃内有多量细菌生长,细菌培养阳性率提高。Hp感染先引起机体急性胃炎,然后转为慢性炎症,随着时间逐渐延长,炎症逐渐加重。据报道,以感染5个月炎症最为明显,在幽门和胃小弯处可见溃疡。病理组织学观察在Hp诊断中具有重要的意义。根据组织学变化,可以确定感染的严重程度,细菌定植的部位以及菌群数量,对判断治疗效果也有重要意义。有学者认为,胃窦部一块组织足以诊断Hp感染情况,组织学可以作为Hp诊断的金标准。
Hp定植在胃黏膜层,它是一种生长在胃黏膜表面与黏膜层之间的微需氧菌。尿激酶是Hp重要的定植因子,在体内Hp分泌尿激酶分解尿素产生的氨,可中和胃酸,这种一过性的低酸和高pH值使细菌能顺利穿过胃黏膜到达近中性的黏膜表层定植。氨和水化合生成的羟基有细胞毒作用,氨离子会干扰胃黏膜的正常氢离子反渗,导致组织损伤,黏膜脱落。Hp感染致胃黏膜上皮细胞增殖和凋亡失衡,随着病程的进一步发展,可引起肠上皮化生现象。
Hp的染色方法很多,各有其优缺点。不同方法制备的苏木精可使细菌的着色深浅不一,一般HE染色Hp着色浅、淡,在细菌量多时较易辨认;在细菌量少时,因细菌形态不够清楚,不易辨认,但是HE染色仍是一种简便的Hp检查方法,有一定的应用价值。HE染色诊断Hp的总体准确性为92%。Warthin-Starry银染色诊断Hp的总体准确性为95%,胃黏膜背景细胞质呈棕黄色,胞核棕褐色,Hp呈黄色,银在细菌表面沉积使菌体增大,反差大,对比度强,易于辨认,但是此染色法操作繁琐,技术要求高,染色时间长,试剂价格高。
[1]Monique M,Arnoud HM,,Ernst J,et al.Helicobacter pylori anDAntimicrobial resistance:molecular mechanisms and clinical implications[J].Lancet,2006,11(6):699-709.
[2]Eurogast Study Group.An international association between Helcobacterpyloriinfection and gastriccancer[J].Lancet,1993,(341):1359-1362.
[3]Sturegard E,Sjunnesson H,Ho B,et al.Severe gastritis in guinea-pigs infected with Helicobacter pylori[J].J Med Micro biol,1998,47(12):1123-1129.
[4]Rokutan K.Role of heat shock proteins in gastric mucosal protection[J].J Gastroenterol Hepatol,2000,(15):12-19.
[5]Sutton P,Wilson J,Lee A.Further developmengt of the Heli cobacter pylori mouse vaccination model[J].vaccine,2000,18(24):2677-2685.
[6]Tae Young,Marie Yeo,Sang UK et al.Synergism of Heli cobacter pylori and stress on the augmentation of gastric mu cosal damage and its prevention with α-tocopherol[J].Free Radical Biologyand Medicine.2005,11(38),1447-1457
[7]王毅超,郭刚,刘开云,等.不同预处理方法建立幽门螺杆菌感染动物模型的比较[J].中国生物制品学杂志,2002,(15):292-294.
[8]Hirohito,Yasuhito and Ken-ichi,et al.Inhibitory effect of etodolac,a selective cyclooxygenase-2inhibitior,on stomach carcinogenesis in Helicobacter pylori-infected Mongolian gerbils[J].Biochemical and Biophysical Research Communica tions.2005,2(334),606-612
[9]Johana anDAnn-Mari,Oral immunization with HpaAaffords therapeutic protective immnity against H.pylori that is re flected byspecificmucosalimmuneresponses.Vaccine,2006,25(14),2591-2598
[10]郑青,陈晓宇,施尧,等.幽门螺杆菌长期感染蒙古沙土鼠建立胃癌模型的研究[J].中华消化杂志,2003,23(2):92-96.
[11]刑璐,李春鸣.改良Warthin-Starry银染法在胃幽门弯曲菌染色中的应用[J].遵义医学院学报,1994,17(2):149.
[12]Marshall BJ.helicobacter pylori[J].AmJ Gsatroenterol,1994,89:s116.
[13]Eidt S,Stolte M.The significance of helocobacter pylori in relationtogastriccancerandlymphoma[J].EurJGastroenterol Hepatol,1995,7:318.
[14]Newell DG.Human antibody responses to the surface Pro tein antigens of Campylobacter pyloridis[J].Serodiagn Immunother,1997,1:209.
[15]ZhengQ,Chen XY,Shi Y,et al.Chin J Dig,2003;23:92~9
[16]Watanabe T,Tada M,Nagai H,et al.Gastroenterology,1998;115:642-648.
[17]Fujioka T,Honda S,Tokieda M.Helicobacter pylori infection and gastric carcinoma in animal models[J].J Gastroenterol Hepatol,2000,15:55-59.
[18]Hunt RH,Malfertheiner P,Yeomans ND,et al.Critical issues in thepathophysiologyand managementofpepticulceraisease[J].Eur J Gastroenterol Hepatol,1995,7:685
[19]AnsorgR,Recklinghausen GV,Romarius R,et al.Evaluation oftechnigues for isolation,subcultivation,and preservation ofhelicobacter pylori[J].J Clin Microbiol,1991,29:51
Establishment of Helicobacter Pylori Infection Model in Mongolian Gerbils
XIE Xian-sheng1,2,LIU Meng1,WANG Xiao-bo1,LI Jian-ji1,PENG Da-xin1
(1.College of Veterinary Medicine,Yangzhou University,Yangzhou Jiangsu 225009,China;2.Nat Wat spec Gen Pool,Jiangsu Animal Husbandry and Vetorinary College,Taizhou Jiangsu 225300,China)
Two methods were used to establish models of Helicobacter pylori(NCTC11637)infection in the Mongolian gerbil stomach..The methodⅠwas that the Mongolian gerbils were forbidden to eat for18hours,then feed 0.5mL of 50%alcohol and inoculated Helicobacter pylori three times at a 6h-,12h-,and 24h-interval.The methodⅡwas that it was treateDAs same as the above method,but taken Ranitidine orally everyday,with 5mg/kGBody weight.On the 7th,15th,35th,and the 45th day after inoculation,the infection and pathological changes in gastric mucosa were observed by Hp antigen diagnostic ELISA kit,bacterial culture,and histological section.The results showed that there were much Helicobacter pylori in the stomach in 35days after artificial inoculated Helicobacter pylori,combining the gastric mucous membrane damaged by alcohol with Ranitidine by oral administration per day,and the pathological changes were the same with that in natural infected cases.
helicobacter pylori;infections;mongolian gerbi;disease mode
Q93
B
1671-0142(2011)03-0078-04
谢献胜(1961-),男,江苏泰兴人,研究员博士,研究方向为胃内幽门螺杆菌感染模型制作与胃炎防治.
“抗幽门螺杆菌高免蛋的研制”,泰州市科技开发项目(TL200519).
(责任编辑刘 红)

