变构菌素生物合成基因簇的研究进展
李明,唐莉
(大连理工大学分子药物中心,辽宁大连116024)
1989年,Cheng及其同事从中国浙江省的土壤样品中分离出链霉菌Streptomyces griseochromogenes,在其发酵液中提取出一种具有抗真菌活性的化合物,命名为Tautomycetin(TTN)[1],变构菌素。它是一种互变异构混合物,呈酸性的黄色胶状固体,具有旋光性,[α]20D+19.4°(C=0.83,CHCl3),溶于甲醇、丙酮、乙酸乙酯、三氯甲烷和苯,难溶于水和正己烷。UV λmax=268 nm,在298 nm有一个肩峰。通过化学降解和光谱分析等方法,Cheng等[2]进一步确定了TTN的结构,其化学式为C33H50O10,相对分子量606.75,由左侧的二烷基马来酸酐和右侧的线性聚酮侧链组成,属于Ⅰ型聚酮化合物。TTN的结构与变构霉素Tautomycin(TTM)高度相似(图1)[3],两者都是有效的细胞可渗透性蛋白磷酸酶PP1/PP2A抑制剂[4-5]。PP1和PP2A是主要的丝-苏氨酸蛋白磷酸酶,参与众多生理活动:如细胞内糖代谢、钙转运、肌肉收缩、基因表达、蛋白质合成、细胞凋亡等[3,6-7]。许多癌症都是由蛋白磷酸酶的异变所引起的,因此对PP1和PP2A的选择性抑制被认为是筛选抗肿瘤药物的标准。TTM对PP1和PP2A的IC50为22~32 nmol/L,对两者的选择性相对接近。而TTN对PP1和PP2A的IC50分别为1.6 nmol/L和62 nmol/L,相差约40倍,显示出对PP1的超高选择性。这一高选择性也使TTN成为研究PP1在多个生物途径中所起作用的较好工具。TTN和TTM在结构上的区别为:TTM侧链上有螺酮缩醇,而TTN上的相同部位缺少这一结构;此外,TTN末端C1-C5的双键结构也不同于TTM。这些不同点可能是决定TTN对PP1更具特异性的原因。TTN还被证实在器官移植中对T细胞具有免疫抑制的作用[8-9]。TTN抑制T细胞扩散的浓度比cyclosporine A(CsA)的有效抑制浓度低100倍。CsA和FK506都是通过与亲免素相结合来达到他们的药物作用的。这一结合体又与Ser/Thr钙调神经磷酸酶相结合幷抑制其活性。但是因为钙调神经磷酸酶的生理普遍性使得这一作用有一些负面影响[10-12]。而TTN的免疫抑制作用完全不同于CsA和FK506,它通过酪氨酸磷酸化来阻断T细胞内Src酪氨酸磷酸激酶下游的信号介质,而这一阻断导致Bcl-2、caspase-9、caspase-3和poly(ADP-ribose)polymerase(但不是caspase-1)的断裂,从而造成特异性细胞凋亡[13]。对活性T细胞的特异性抑制使这一独特的聚酮化合物优于CsA和FK506,成为免疫抑制药物的开发首选。

图1 TTN和TTM的结构[3]Fig.1 Chemical structure of TTN and TTM[3]
1 TTN生物合成基因簇的研究
韩国仁和大学的Choi等[14]在2007年率先报道了约70 kb的TTN生物合成基因簇的分离和鉴定。而美国威斯康星大学麦迪逊分校的Shen研究小组随后在2009年发表了全部TTN生物合成基因簇的分离,并通过基因失活和互补实验证实了部分参与TTN生物合成基因的功能[15]。TTN基因簇定位于一个79 kb大小的DNA区域,由19个开放阅读框(ORF)构成,这些阅读框编码的蛋白包括2个聚酮合成酶Ⅰ(PKSⅠ)(TtnAB)、1个硫酯酶Ⅱ(TtnH)、8个参与合成二烷基马来酸酐的酶(TtnKLMNOPRS)、4个后修饰酶(TtnCDFI)、还有2个调控蛋白(TtnG和TtnQ)和1个抗性蛋白(TtnJ)。
1.1 聚酮链合成相关基因
在TTN基因簇中编码两个PKSⅠ的开放阅读框ttnA和ttnB具有相同的转录方向,两者相加共有10个PKS模块:ttnA编码一个装载模块和延伸模块1-5,ttnB编码延伸模块6-9和一个卸载聚酮链的C端硫酯酶。所有模块都具有高度保守的序列。这些模块中有很多不同的功能结构域,包括10个酮基酰基-ACP合成酶(KS)、7个脱水酶(DH)、10个酰基转移酶(AT)、3个烯醇还原酶(ER)、10个酰基载体蛋白(ACP)和一个硫酯酶(TE)。这些结构域上的活性位点都十分保守,例如:所有的KS结构域上都包含缩合反应所需的CHH催化三联体,所有的ACP结构域都包含有高度保守的DSL活性位点。而ttnB上的最后一个活性结构域TE,包含非常保守的GXGSXG和GdH位点,已被证实在β-羟基位置具有高度立体选择性[16],其功能是卸载聚酮链。为了进一步证实通过序列比较所推断出的基因功能,Shen小组利用PCR targeting的方法将ttnA失活,所得突变体经发酵和高压液相色谱分析,结果显示ttnA的破坏彻底影响了TTN的生物合成。
1.2 二烷基马来酸酐合成相关基因
TTN生物合成基因簇中的ttnKLMNOPRS 8个基因与TTM基因簇中参与二烷基马来酸酐合成的ttmKLMNOPRS具有高度同源性,虽然它们在各自基因簇中的位置和排列顺序有所不同,但ttnKLMNOPRS编码的基因产物很有可能参与二烷基马来酸酐的合成。这8个基因产物包括:(i)TtnO,柠檬酰辅酶A裂解酶;(ii)TtnP,辅酶A转移酶;(iii)TtnR,脱水酶;(iv)TtnM,羟化酶;(v)TtnK,酯酶;(vi)TtnS,环化酶;(vii)TtnL,磷脂酰乙醇胺结合蛋白;(viii)TtnN,未知功能蛋白。为了证明它们的功能,Shen等[15]对其中的ttnM、ttnP、ttnR和ttnS进行了基因敲除和互补实验,对所得突变菌株发酵后的TTN产量进行了分析。所有4个基因的破坏都完全阻止了TTN生物合成,显示了这4个基因在TMC生物合成中的重要性。此外,在ttnP、ttnR和ttnS的突变菌株中没有检测到任何中间产物,证明了它们在二烷基马来酸酐合成中的重要作用。而ttnM敲除菌株的发酵液中分离出以TTN M-1(C-3'脱羧形式的TTN)为主的4种代谢产物,也证明了TtnM在C-3'位置的羟化作用。
1.3 聚酮链后修饰基因
相对于由TtnB中硫酯酶卸载下来的新生聚酮链,TTN结构中的聚酮链与其有2点不同:(i)C-5位置的羰基,(ii)末端双键结构。Ttn基因簇中有4个基因的产物可能参与对聚酮链的后修饰作用,包括TtnC、黄素蛋白脱羧酶;TtnD、UbiD家族脱羧酶;TtnF、L-肉碱脱水酶;TtnI、细胞色素P450羟化酶。根据基因功能推断,聚酮链末端脱羧和脱水形成烯烃结构的反应可能由TtnD和TtnF所催化。对ttnD和ttnF的基因失活和互补实验证实了这一判断[17]。ΔttnF产生了TTN-F1,如图2所示,而ΔttnD产生了TTN-D1(4)、TTN-D2(5)、TTN-D3(6)和TTN-D4(7)。TTN-F1的结构确认了TtnF作为脱水酶的功能。另外,其末端的酸基说明TtnD的脱羧作用应该依赖TtnF的存在,TtnD自己不能有效地进行脱羧。ΔttnF的发酵液中未分离到TTN和产物4、5、6、7,说明TtnF和TtnD的作用可能是共同的。所有的突变菌株都未产生含有β-羟酸的中间产物,说明C5位的氧化作用可能在TtnD和TtnF之后进行,这一步骤可能由TtnI,细胞色素P450羟化酶的同系物,也是ttn基因簇中唯一一个加氧酶所催化。实验表明产物3、4、6、7对PP1的抑制浓度低于TTN约一个数量级,而对PP2A的抑制能力与TTN相当,说明TtnD和TtnF对右半部分结构的修饰大大加强了TTN对PP1的选择性。
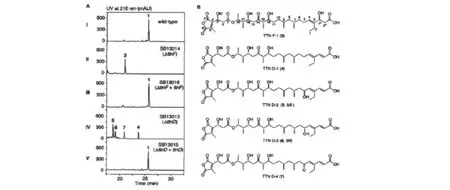
图2 ΔttnF和ΔttnD突变菌株中的TTN合成中间产物和副产物[17]Fig.2 TTN biosynthetic intermediates and shunt metabolites accumulated in the ΔttnF and ΔttnD mutant strains[17]
1.4 调控基因和抗性基因
对ttn基因簇的测序结果也显示了调控基因和抗性基因的存在。2个调节基因分别是ttnG,编码一个与ThcG具有33%同源性的蛋白,ThcG是Rhodococcus erythropolis中的一个调控蛋白;ttnQ编码一个与SareDRAFT_1231具有41%同源性的蛋白,SareDRAFT_1231来源于Salinispora arenicola CNS205。这2个蛋白都属于LuxR家族的转录因子,在它们的近C端具有典型的LuxR螺旋-转角-螺旋基序(HTH motif)。LuxR家族的蛋白通过与DNA结合而激活,同时与autoinducers如N-(3-oxohexanoyl)-L-homoserine lactone有关。但是分析结果显示TtnG和TtnQ都缺少N端autoinducer结合区域。此外,TtnG蛋白上有TTA密码子,这说明它的转录可能依赖tRNA UUA构成基因bldA。对ttnQ和tmcN(ttnG同源基因)的基因破坏完全阻止了TTN的生物合成[15,18],说明了这2个蛋白作为正调控因子的重要作用。通常微生物自身都具有用来自我保护的抗性机制,包括胞内物质修饰或储存,以及向细胞外的传输等。在ttn基因簇中也发现了一个传输蛋白,TtnJ。TtnJ与Rhodococcus sp.RHA1中的细胞质膜多抗性传输蛋白RHA1_ro04399(YP_704343)具有49%的同源性[15]。因此可判断出S.griseochromogenes的抗TTN机制是通过传输机制实现的。
2 TTN生物合成途径的推断
根据从序列分析得出的功能分配和基因失活及互补实验结果,研究人员已初步推断出了TTN的生物合成途径,如图3所示。TTN的聚酮侧链由TtnA和TtnB催化合成。它们共同催化了9个脱羧缩合反应,其中利用1个乙酰辅酶A(acetyl-CoA)作为起始单元,3个丙二酸单酰辅酶A(malonyl CoA),4个甲基丙二酰辅酶A(methyl malonyl-CoA)和1个乙基丙二酰辅酶A(ethyl malonyl CoA)作为延伸单元。2-酮戊二酸(2-oxoglutarate)和丙酸(propionate)在TtnLMNOPRS的催化下合成了二烷基马来酸酐,再通过TtnK将其和聚酮链的一部分酯化偶联,所得中间产物经硫酯酶卸载后进一步通过TtnDFI修饰得到TTN。这一合成途径中有3个关键步骤尚未确定,分别是:(i)二烷基马来酸酐与部分聚酮链酯化偶联的时间;(ii)C-5位的氧化;(iii)末端双键的形成。在之前对相似天然产物TTM的研究中,Li等[19]发现二烷基马来酸酐是合成之后与聚酮链发生的酯化偶联,而不是与一段聚酮链偶联后不断延伸加长的。但TTN的情况不同,对编码二烷基马来酸酐的基因ttnP、ttnR和ttnS进行基因失活后,发酵不能得到TTN,同时也没有合成聚酮链结构或相关代谢产物,说明二烷基马来酸酐可能在聚酮链完全合成并卸载之前与之偶联,但具体的连接时间还尚未研究清楚。而C-5位置氧化和末端双键的形成可能有以下2种途径:(i)聚酮链从TtnB上卸载之后,所得中间产物3先经TtnF催化脱水形成双键,再由TtnI在C-5位氧化生成酮基,最后由TtnD脱羧生成TTN。(ii)中间产物3在TtnF和TtnD同时作用下产生一个具有末端双键结构的中间产物,这一产物的C-5位置再经TtnI氧化生成TTN。

图3 TTN的生物合成途径推断[15,17]Fig.3 Proposed biosynthesis pathway of TTN[15,17]
3 展望
TTN对蛋白磷酸酶PP1的抑制有着高选择性,而对活性T细胞的特异性抑制也优于其他免疫抑制剂,因此,TTN及其衍生物在肿瘤治疗、免疫抑制等诸多领域都有着广泛的应用前景。TTN
生物合成基因簇的分离和生物合成途径的研究可为TTN及其衍生物的工业化生产和新药研发奠定良好基础。目前为止,TTN生物合成途径虽已基本阐明,但其中部分基因的功能和关键步骤还尚未确立,如二烷基马来酸酐的生物合成相关基因,聚酮链与二烷基马来酸酐的结合时机等。本研究小组正在开展对这些方面的研究,目前已对二烷基马来酸酐合成相关基因如ttnN等进行了基因失活、异源表达等研究,为进一步确立TTN的生物合成途径及活性衍生物的开发奠定了基础。
[1] Shim JH,Lee HK,Chang EJ,et al.A new antibiotic,tautomycetin[J].J Antibiot(Tokyo),1989,42(1):141-144.
[2] Cheng XC,Ubukata M,Isono K.The structure of tautomycin,a dialkylmaleic anhydride antibiotic[J].J Antibiot(Tokyo),1990,43(7):809-819.
[3] Honkanen RE,Golden T.Regulators of serine/threonine protein phosphatases at the dawn of a clinical era?[J].Curr Med Chem,2002,9(22):2055-2075.
[4] Mitsuhashi S,Matsuura N,Ubukata M,et al.Tautomycetin is a novel and specific inhibitor of serine/threonine protein phosphatase type 1,PP1[J].Biochem Biophys Res Commun,2001,287(2):328-331.
[5] MacKintosh C,Klumpp S.Tautomycin from the bacterium Streptomyces verticillatus.Another potent and specific inhibitor of protein phosphatases 1 and 2A[J].FEBS Lett,1990,277(1-2):137-140.
[6] Sakoff JA,McCluskey A.Protein phosphatase inhibition:structure based design.Towards new therapeutic agents[J].Curr Pharm Des,2004,10(10):1139-1159.
[7] Oikawa H.Synthesis of specific protein phosphatase inhibitors,tautomycin and tautomycetin toward structure-activity relationship study[J].Curr Med Chem,2002,9(22):2033-2053.
[8] Shim JH,Lee HK,Chang EJ,et al.Immunosuppressive effects of tautomycetin in vivo and in vitro via T cell-specific apoptosis induction[J].Proc Natl Acad Sci USA,2002,99(16):10617-10622.
[9] Han DJ,Jeong YL,Wee YM,et al.Tautomycetin as a novel immunosuppressant in transplantation[J].Transplant Proc,2003,35(1):547.
[10] Flanagan WM,Corthesy B,Bram RJ,et al.Nuclear association of a T-cell transcription factor blocked by FK-506 and cyclosporin A[J].Nature,1991,352(6338):803-807.
[11] Bierer BE,Mattila PS,Standaert RF,et al.Two distinct signal transmission pathways in T lymphocytes are inhibited by complexes formed between an immunophilin and either FK506 or rapamycin[J].Proc Natl Acad Sci USA,1990,87(23):9231-9235.
[12] Hong JC,Kahan BD.Immunosuppressive agents in organ transplantation:past,present,and future[J].Semin Nephrol,2000,20(2):108-125.
[13] Chae WJ,Choi JM,Yang JJ,et al.T Cell-specific immunosuppression using tautomycetin or PTD-conjugated protein drugs[J].Yonsei Med J,2004,45(6):978-990.
[14] Choi SS,Hur YA,Sherman DH,et al.Isolation of the biosynthetic gene cluster for tautomycetin,a linear polyketide T cell-specific immunomodulator from Streptomyces sp.CK4412[J].Microbiology,2007,153(Pt 4):1095-1102.
[15] Li W,Luo Y,Ju J,et al.Characterization of the tautomycetin biosynthetic gene cluster from Streptomyces griseochromogenes provides new insight into dialkylmaleic anhydride biosynthesis[J].J Nat Prod,2009,72(3):450-459.
[16] Scaglione JB,Akey DL,Sullivan R,et al.Biochemical and structural characterization of the tautomycetin thioesterase:analysis of a stereoselective polyketide hydrolase[J].Angew Chem Int Ed Engl,2010,49(33):5726-5730.
[17] Luo Y,Li W,Ju J,et al.Functional characterization of TtnD and TtnF,unveiling new insights into tautomycetin biosynthesis[J].J Am Chem Soc,2010,132(19):6663-6671.
[18] Hur YA,Choi SS,Sherman DH,et al.Identification of TmcN as a pathway-specific positive regulator of tautomycetin biosynthesis in Streptomyces sp.CK4412[J].Microbiology,2008,154(10):2912-2919.
[19] Li W,Ju J,Rajski SR,et al.Characterization of the tautomycin biosynthetic gene cluster from Streptomyces spiroverticillatus unveiling new insights into dialkylmaleic anhydride and polyketide biosynthesis[J].J Biol Chem,2008,283(42):28607-28617.

