反式脂肪酸 Trans C18∶1诱导内皮细胞凋亡的研究
邱 斌, 刘 蓉, 邓泽元*, 范亚苇, 李 静, 胡蒋宁, 黎 玉
(1.食品科学与技术国家重点实验室,南昌大学,江西南昌 330047;2.南昌大学生命科学与食品工程学院,江西南昌 330047)
反式脂肪酸 Trans C18∶1诱导内皮细胞凋亡的研究
邱 斌1, 刘 蓉1, 邓泽元*1, 范亚苇1, 李 静1, 胡蒋宁1, 黎 玉2
(1.食品科学与技术国家重点实验室,南昌大学,江西南昌 330047;2.南昌大学生命科学与食品工程学院,江西南昌 330047)
通过检测相关细胞凋亡指标,探讨trans C18:1诱导内皮细胞的凋亡机制。采用体外细胞培养方法将不同浓度trans C18∶1与内皮细胞共同孵育后,通过吉姆萨染色,观察内皮细胞形态变化;采用流式细胞仪检测细胞的早期凋亡变化;通过试剂盒检测观察trans C18:1对凋亡酶Caspase活力的影响;最后考察Caspase抑制剂z-VAD-fm k,对trans C18∶1对内皮细胞存活率的影响。吉姆萨染色后,细胞呈典型的凋亡形态;流失细胞仪检测内皮凋亡细胞的数量明显增加;同时发现trans C18∶1引起内皮细胞的凋亡可能与Caspase-3酶激活有关,因为Caspase抑制剂又能提高trans C18∶1处理的内皮细胞存活率。
反式脂肪酸;trans C18∶1;内皮细胞;凋亡
反式脂肪酸(trans fatty acids,TFA)是油脂或含有油脂的食品中常见的一个组成成分[1]。由于TFA会加速动脉粥样硬化,容易诱发心血管和老年痴呆等疾病。因此,食品中的 TFA的形成已成为当前国际上的研究热点[2]。人摄入 TFA后,会引发系统炎症和内皮功能改变,并进一步诱发心血管疾病的发生和发展,但具体的机制目前仍不清楚。
研究表明,内皮凋亡是血管损伤的重要作用机制,许多外界刺激均可诱导内皮凋亡,并进一步导致血管渗漏,炎症和血液凝固[3]。作者已发现transC18∶1会造成内皮细胞损伤[4],现探讨transC18∶1对内皮细胞凋亡的影响,希望为研究 TFA引起的动脉粥样硬化的发生机制提供科学的数据。
1 材料与方法
1.1 材料
人脐静脉内皮细胞株:南昌大学医学院提供;trans C18∶1(反式-9-十八碳烯酸)、DM EM、胰蛋白酶M TT:Sigma公司产品;吉姆萨试剂盒:南京建成公司产品,酶标仪M K3:Thermo公司产品,Caspase-3试剂盒、Caspase广谱抑制剂 z-VAD-fmk:Annexin V-FITC细胞凋亡检测试剂盒:南京凯基生物公司产品;流式细胞仪COUL TER EPICS XL:BECKM AN公司产品。
1.2 方法
1.2.1 细胞培养 人脐静脉内皮细胞的培养:取人脐静脉血管内皮细胞细胞株复苏,接种于50 m L培养瓶内,待生长铺满后,经2.5 g/L胰蛋白酶消化传代,置于37℃、体积分数5%的CO2培养箱培养。隔天换培养液,培养第3天分组。
1.2.2 吉姆萨染色 待细胞铺满90%以上时,弃去培养皿内原培养液,用PBS冲洗3次后加吉姆萨染色液Ⅰ染液3~5滴,使其迅速盖满皿底,大约1 min后滴加试剂Ⅱ缓冲液5~10滴,轻轻摇动平皿,使染液充分混合均匀,5~10 min后用超纯水迅速冲去多余染液,晾干后在倒置相差显微镜下观察细胞形态。
1.2.3 A nnexin V-FITC双染法检测细胞凋亡transC18∶1处理过的内皮细胞用不含EDTA的胰酶消化,然后用PBS洗涤细胞两次(2 000 r/m in离心5 min)收集1-5×105细胞,加入500μL的Binding Buffer悬浮细胞,加入5μL AnnexinV-FITC混匀后,再加入5μL Propidium Iodide混匀,室温、避光、反应5~15 min,在1 h内进行流式细胞仪的观察和检测。
1.2.4 Caspase-3活性的检测 按试剂盒说明操
作,胰酶消化收集trans C18∶1处理过的内皮细胞并重悬于 Lysis Buffer(裂解液)中,冰上孵育 10 min,离心并收集上清液(胞浆提取液),加入含DDT的Reaction Buffer,再加5μL蛋白酶底物多肽37℃孵育4 h,在酶标仪405 nm处检测光密度值。结果以检测的A值表示。
1.2.5 Caspase抑制剂对内皮细胞存活率的影响
将细胞以1×105/m L接种于96孔板中,每孔加入细胞悬液100μL,待细胞长到融合。分别设立空白对照组,trans C18∶1(200μmol/L)组,Caspase抑制剂 1.25、2.5、5μmol/L Caspase抑制剂组中都同时添加trans C18∶1(200μmol/L),10μmol/L Caspase抑制剂组不添加trans18∶1,每个浓度6个复孔。37℃、体积分数5%CO2孵箱内培养24或48 h后,去除培养液,每孔加入0.5 mg/m L的M TT溶液20μL,继续培养4 h后,弃去上清液,每孔加入150μL二甲基亚砜(DMSO),震荡使蓝紫色结晶充分溶解,用酶标仪测定A490nm值。计算各浓度Caspase抑制剂对细胞存活率的影响。

1.3 统计分析
所有实验数据用SPSS for window s软件进行数据分析。
2 结果与分析
2.1 trans C18∶1诱导内皮细胞凋亡的形态学观察
如图1所示,经吉姆萨染料着色后的细胞核呈紫红色,而细胞浆着色不明显,呈淡红色。对照组细胞轮廓清晰,呈多角形“铺路石样”排列;核居中,为圆形或椭圆形。经200μmol/L trans C18∶1作用24 h后,胞质明显回缩,细胞间连接消失,胞体呈圆形;胞核浓缩深染,偏于一侧,部分核已破裂,呈现出凋亡细胞典型的形态学特征。
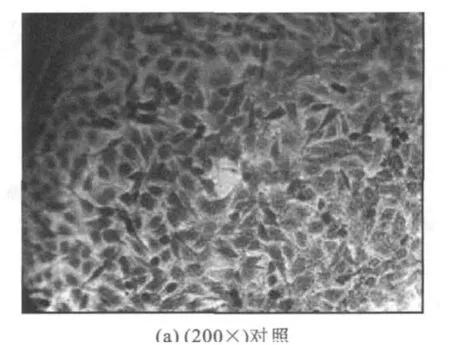
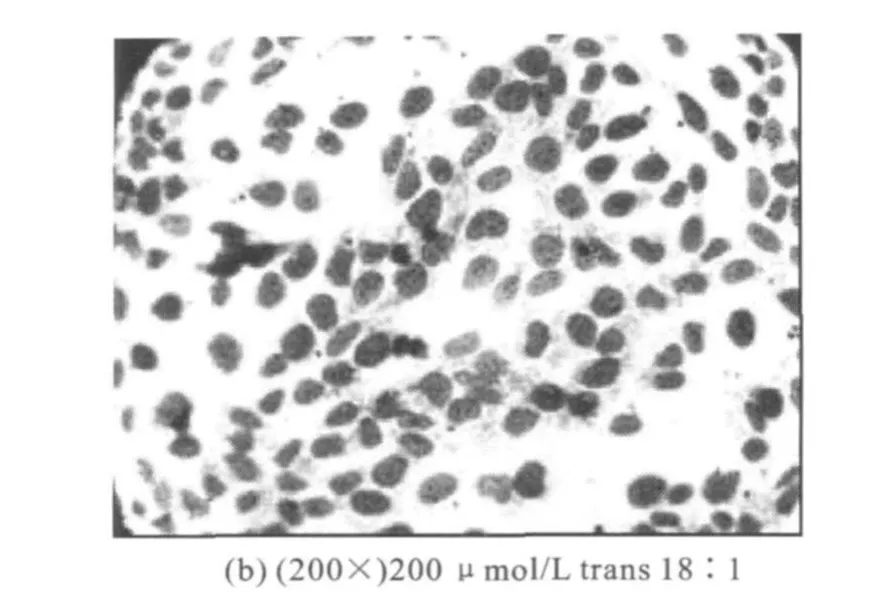
图1 吉姆萨染色显示内皮细胞形态变化Fig.1 Morphological changes shown by Gimersa staining
2.2 Annexin V-FITC法检测trans C18∶1诱导内皮细胞凋亡
在细胞凋亡早期,位于细胞膜内侧的磷脂酞丝氨酸(PS)迁移至细胞膜外侧。Annexin V是一种钙依赖性的磷脂结合蛋白,与PS具有高度的结合力。因此,AnnexinV可以作为探针检测暴露在细胞外侧的PS。将AnnexinV标记上绿色荧光蛋白FITC,同时结合核酸染料 PI(活细胞未染)进行细胞双染,可区分活细胞、凋亡及死亡细胞。图2显示,对照组出现少量凋亡细胞(图 2(a));trans C18∶1组,早期凋亡率为16.73%(图2(b)),比对照组有明显增加。

图2 trans C18∶1对内皮细胞凋亡率的影响Fig.2 Effect of trans C18∶1 on apoptosis rate
2.3 trans C18∶1对Caspase-3活性的影响
Caspase-3是细胞凋亡过程中最主要的终末剪切酶,在细胞凋亡中起着不可替代的作用[5]。如图3所示,Caspase-3活性可被 trans C18∶1激活,trans C18∶1(200μmol/L)与对照组相比Caspase-3活力有显著升高(p<0.001)。
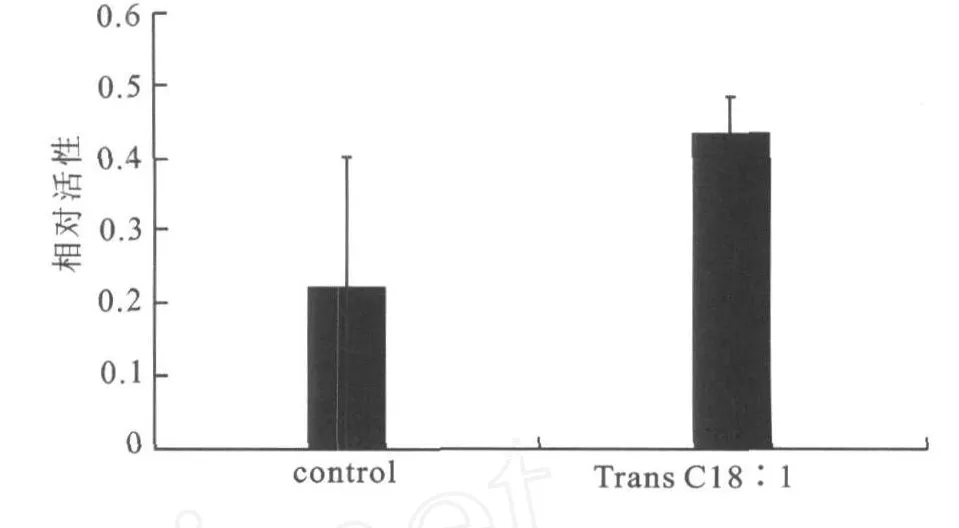
图3 trans C18∶1对内皮细胞Caspase-3活性的影响Fig.3 Effect of trans C18∶1 on the activity of Caspase-3
2.4 Caspase抑制剂对trans C18∶1处理的内皮细胞存活率的影响
Caspase抑制剂对trans C18∶1处理的内皮细胞存活率的影响结果见图4。将Caspase抑制剂z-VAD-fm k加入培养基中,trans C18∶1作用24~48 h后,发现Caspase抑制剂预处理组的内皮细胞存活率比仅trans C18∶1处理组明显升高(p<0.001),且与对照组和单独添加Caspase抑制剂相比无统计学差异。

图4 Caspase抑制剂对细胞存活率的影响Fig.4 Effect of Caspase inhibitor on cell viability
3 结 语
众多研究表明[6-7],在细胞凋亡的过程中,Caspase家族在其信号转导系统中起着非常重要的作用,其中Caspase-3(胱氨酸蛋白酶-3)为关键的信息分子[8]。正常情况下,胞质中Caspase-3(胱氨酸蛋白酶-3)以无活性、相对分子质量约为32 000的前Caspase-3的形式存在。当细胞凋亡过程被启动,凋亡信号传导至Caspases时,可引起各种Caspases的“瀑布式”层层激活的蛋白酶级联切割的过程,不同的蛋白酶分别切割 Caspase-3酶原,从而激活Caspase-3,活化的Caspase-3进一步又切割不同的底物,导致蛋白酶级联切割放大,最终引起细胞凋亡[9]。而在此蛋白酶级联切割过程中,Caspase-3处于核心位置,发挥重要的作用,因此被称为死亡蛋白酶。
作者发现,在反式脂肪酸诱导内皮凋亡的过程中,Caspase-3活性显著升高,表明 Caspase-3参与了内皮细胞的凋亡。Caspase抑制剂可通过提高trans C18∶1处理的内皮细胞存活率抑制内皮的细胞凋亡。Michaela Artwohl发现硬脂酸通过激活Caspase诱导内皮细胞凋亡,并且 Caspase抑制剂可以完全抑制硬脂酸诱导的内皮细胞凋亡[10],其结果和作者的研究结果一致。Yumi Kondoh发现transC18:1能够激活 Caspase-3且部分激活Caspase-8,-9,诱导人肝癌细胞株(Hep G2)凋亡[11],说明死亡受体通路和线粒体通路均部分参与了transC18∶1诱导的 Hep G2细胞凋亡过程。TFA通过什么通路引起血管内皮细胞的凋亡,需要进一步深入研究。
(References):
[1]邓泽元,周潇奇,黄玉华,等.中国居民20年间食物脂肪酸摄入量调查分析[J].食品与生物技术学报,2008,27:7-19.
DENG Ze-yuan,ZHOU Xiao-qi,HUANG Yu-hua,et al.Investigation of dietary fatty acids intakes of Chinese people during twtenty years[J].Journal of Food Science and Biotechnology,2008,27:7-19.(in Chinese)
[2]陈宜,张青龄,林丛,等.食品中反式脂肪酸的研究进展[J].食品科技,2009,16(5):25-28.
CHEN Yi,ZHANGQing-ling,L IN Cong,et al.Research progresson trans fatty acids in food[J].Cerealand food industry,2009,16(5):25-28.(in Chinese)
[3]Winn RK,Harlan JM.The role of endothelial cell apoptosis in in?ammatory and immune diseases[J].Thromb Haemost,2005,3:1815-24.
[4]邱斌,刘蓉,邓泽元,等.反式C18:1对血管内皮细胞损伤的影响[J].营养学报,2010,32:328-335.
Q IU Bin,L IU Rong,DENG Ze-yuan,et al.Effects of trans C18∶1 on endothelial injury[J].Acta Nutrimenta Sinica,2010,32:328-335.(in Chinese)
[5]Ostergard T,Hansen TK,Nyholm B,et al.Circulating ghrelin concentrations are reduced in healthy offsp ring of type 2 diabetic subjects and are inereased in Women independent of a family history of type 2 diabetes[J].Diabetologia,2003,46(1):134-136.
[6]Du HJ,Hui YN,Wang YS,et al.Caspase-3 activity during dauno rubicin induced human retinal pigment epithelineum cell apoptosis[J].Disi Junyi Daxue Xuebao,2001,22(7):609-611.
[7]Evan G,Littlewood T.A matter of life and cell death[J].Science,1998,281(5381):1317-1322.
[8]Duan H,Chinnaiyan AM,Hudson PL,et al.ICE-LAP3,a novelmammalian homologue of the caenorhabditis elegants cell death protein Ced-3 is activiated during Fas-and tumor necrosis factor-induced apoptosis[J].Biol Chem,1996,271(3):1621-1625.
[9]Enari M,Sakahira H,Yokoyama H,et al.A caspase-activated Dnase that degraded DNA during apoptosis and its inhibitor ICAD[J].Nature,1998,391:43-50.
[10]A rtwohl M.,Lindenmair A,et al.Different mechanisms of saturated versus polyunsaturated FFA-induced apoptosis in human endothelial cells[J].J Lipid Res,2008,49(12):2627-2640.
[11]Yumi Kondoh,Teruo Kawada,Reiko Urade.Activation of caspase 3 in Hep G2 cells by elaidic acid(t18∶1)[J].Biochimica et Biophysica Acta,2007,17(71):500-505.
Apoptosis of Human Umbilical Vein Endothelial Cells Induced by Trans C18∶1
QIU Bin1, LIU Rong1, DENG Ze-yuan*1, FAN Ya-wei1,LI Jing1, HU Jiang-ning1, LI Yu2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.School of Life Sciences and Food Engineering,Nanchang University,Nanchang 330047,China)
The target of this study is to exoplore the apoptotic mechanism of endothelial cells through detecting relevanting apoptosis index.For this,EC were cultured with trans C18∶1 at different concentrations,then the morphological changes of endothelial cells were observed through giemsa staining.The apoptotic cells were detected by flow cytometry.The activity of caspase-3 was detected by spectrophotography after endothelial cells treated with trans C18∶1.The cell viability was measured by MTT after endothelial cells cultured with trans C18∶1 and caspase inhibitor for 24~48 h.Results:The number of apoptotic cells raised and endothelial cells displayed classical apoptotic morphology after endothelial cells cultured with trans C18∶1.The activity of caspase-3 ascended and the caspase inhibitor could protect endothelial cells from trans C18∶1.
trans fatty acids,trans C18∶1,endothelial cell,apoptosis
*通信作者:邓泽元(1963-),男,江西瑞金人,教授,博士研究生导师,主要从事脂肪酸研究。Email:dengzy28@yahoo.com.cn
R 151.41
A
1673-1689(2011)04-0588-04
2010-08-26
国家自然科学基金项目(30972482),江西省学术带头人计划项目(2008DD00900),教育部博士点基金项目(20070403002),江西省自然科学基金项目(2008GQY0023)。
邱斌(1982-),男,山东肥城人,食品科学与工程博士研究生,主要从事食品营养学研究。Email:422083898@qq.com

