气相色谱—火焰光度法测定大米中三丁基锡和三苯基锡
李 娟, 申明月, 鄢爱平, 郭 岚, 万益群*1,
(1.食品科学与技术国家重点实验室,南昌大学,江西南昌 330047;2.南昌大学分析测试中心,江西南昌 330047)
气相色谱—火焰光度法测定大米中三丁基锡和三苯基锡
李 娟2, 申明月2, 鄢爱平2, 郭 岚2, 万益群*1,2
(1.食品科学与技术国家重点实验室,南昌大学,江西南昌 330047;2.南昌大学分析测试中心,江西南昌 330047)
建立了大米中三丁基锡和三苯基锡化合物同时分析的气相色谱法。样品以二氯甲烷超声提取,四乙基硼酸钠衍生,衍生物经弗罗里硅土层析柱净化后,采用气相色谱—火焰光度法进行检测,并对影响测定的各种因素进行了探讨。三丁基锡、三苯基锡均在0.1~10 mg/L质量浓度范围内线性良好,线性相关系数分别为0.999 0,0.999 5,方法检出限分别为0.049,0.075 mg/kg。在0.5、5.0、10 mg/L 3个添加水平下,三丁基锡、三苯基锡的平均回收率为96.4%~109.4%,相对标准偏差为4.09%~8.46%。方法用于大米中三丁基锡和三苯基锡化合物的同时检测,结果良好。
三丁基锡;三苯基锡;气相色谱-火焰光度法;大米
随着经济的发展,有机锡化合物尤其是三丁基锡和三苯基锡作为杀虫剂、PVC稳定剂、船舶防污涂料等得到广泛应用[1]。有机锡具有生物毒性,对人体健康会造成严重的危害,不同形态的有机锡,其毒性和环境行为有显著差异。其中三丁基锡(tributyltin,TBT)和三苯基锡(triphenyltin,TPh T)毒性最大,极低含量就可导致生物体内分泌混乱[2],具有肌肉毒性、基因毒性和胚胎毒性等。国内外关于有机锡化合物的研究多集中在环境样品[3,4,5]及纺织品[6]上,相对来讲,食品中[7,8]有机锡化合物的研究报道较少,大米中有机锡化合物的研究更尚未见报。大米是人们食物的主要来源之一,开展大米中有机锡化合物污染水平调查,揭示其对人体健康的影响,具有一定的现实意义。
目前常用的有机锡化合物分析技术有液相色谱—电感偶合等离子体质谱[9]、液相色谱—质谱[10]、气相色谱—质谱法[11,12]、气相色谱—火焰光度法[13,14,15]、气相色谱—原子发射光谱法[16]等。Jiang Gui bin等[15]将猪油样品经格氏试剂衍生,环已烷萃取后,过弗罗里硅土柱净化,采用 GC-FPD对一甲基锡(monomethyltin,MM T)、二甲基锡(dimethyltin,DM T)、三甲基锡 (trimethyltin,TM T)进行检测。结果发现,猪油样中二甲基锡的含量达到mg/g级,三甲基锡和单甲基锡的含量达到μg/g级。Santos等[16]向生物样品中加入四甲基氢氧化铵消化10~20 min,上清液用NaBEt4(sodium tetraethylbo rate)衍生,正已烷萃取,采用 GCAED对一丁基锡(monobutyltin,MBT)、二丁基锡(dibutyltin,DBT)、三丁基锡(tributyltin,TBT)、一苯基锡 (monophenyltin,M Ph T)、二苯基锡 (diphenyltin,DPh T)、三 苯 基 锡 (triphenyltin,TPh T)进行分析,结果发现,样品均受到有机锡化合物不同程度的污染。
作者系统研究了大米中三丁基锡和三苯基锡化合物提取、净化条件,建立了大米中三丁基锡和三苯基锡同时分析新方法。相对传统的分析方法,该方法同时进行衍生和萃取,缩短了分析时间,简化了操作步骤,具有较好的实用价值。
1 材料与方法
1.1 主要仪器与试剂
Agilent 6890N气相色谱仪:美国Agilent公司产品,配火焰光度检测器、Agilent 7683自动进样器和Agilent色谱工作站(B.01.03C);DSY-Ⅱ型自动快速浓缩仪:北京金科精华苑技术研究所产品;M S2迷你振荡器:广州仪科实验室技术有限公司产品;RE-52A旋转蒸发仪:上海亚荣生化仪器厂产品;M illi-Q超纯水装置:美国M illipo re公司产品。
三丁基氯化锡、三苯基氯化锡标准品:购自德国Ehrenstorfer公司;四乙基硼酸钠(NaBEt4):购自美国Strem Chemicals公司;甲醇为色谱纯;正己烷、二氯甲烷、乙酸乙酯、丙酮、醋酸、醋酸钠、氯化钠:均为分析纯;无水Na2SO4(分析纯,使用前450℃灼烧4 h);Florisil:农残级,使用前650 ℃灼烧4 h。
1.2 色谱分析条件
HP-5毛细管柱(30 m×0.32 mm×0.25μm);进样口温度:250℃;柱温:80℃保持1 min,然后以20℃/min升至250℃,保持5 min;检测器温度:250℃;氢气流量:250 m L/min;空气流量:100 mL/min;尾吹气(N2)流量:50 mL/min;载气:高纯氮气,流速为1.0 mL/min;进样量:2.0μL(不分流进样)。
1.3 标准溶液配制及衍生化
分别称取一定量三丁基锡、三苯基锡标准品于50 m L棕色容量瓶中,并用甲醇溶液定容,配成100 mg/L TBT、TPh T的标准储备液,置于4℃冰箱内保存。
准确移取1.0 mL一定浓度的 TBT、TPh T混合标准液于10 m L离心管中,依次加入1.0 m L醋酸-醋酸钠缓冲溶液(p H=5.0)、1.0 m L 1 g/dL NaBEt4溶液和3.0 m L正己烷,振荡萃取40 min,静置分层,分出有机相,在旋转蒸发仪上浓缩至近干,并用正己烷定容至1.0 mL,在选定的实验条件下进行测定。
1.4 样品前处理
将大米粉碎后过0.45 mm粒径筛。称取1.0 g左右大米样品于50 mL玻璃瓶中,依次加入1.0 m L醋酸-醋酸钠缓冲溶液(p H=5.0)、1.0 m L质量分数1%NaBEt4溶液、2.0 mL饱和氯化钠溶液和10 m L二氯甲烷,超声提取10 min后,将溶液转移到离心管中,于4 000 r/min离心10 min,分出有机相,在旋转蒸发仪上浓缩至3.0 mL左右,以备净化。
层析柱(10 mm×25 cm)自下而上装填:1 cm无水硫酸钠,3 g弗罗里硅土,1 cm无水硫酸钠。用10 m L正己烷预淋洗柱子,然后将浓缩液转移至柱头,待层析柱中试样溶液的液面接近上层无水硫酸钠时,用20 m L乙酸乙酯-正己烷(体积比为1∶1)溶液洗脱,收集洗脱液,在旋转蒸发仪上浓缩至近干,并用2.0 m L正己烷溶解残余物,微弱氮气吹至200μL,在选定的实验条件下进行测定。
2 结果与讨论
2.1 色谱条件的选择
考查进样口温度在250~290℃范围对 TBT和TPh T峰面积的影响。结果表明,改变进样口温度对 TBT峰面积影响不大,而 TPh T的峰面积随着进样口温度的升高而增大,当进样口温度在250~290℃时,TPh T峰面积无显著变化。作者选择进样口温度为250℃。同时为提高 TBT和 TPh T检测的灵敏度,对空气与氢气流量比进行优化,固定空气流量(100 m L/min)及其它条件,考查氢气流量在90~250 m L/min范围对 TBT和 TPh T峰面积的影响。结果表明,TBT和TPh T的峰面积随着氢气流量的增大而增大,当氢气流量为250 m L/min时TBT和TPh T的峰面积最大,而且该值也是仪器的最大设定值。在上述色谱条件下,TBT、TPh T得到了较好的分离(见图1)。
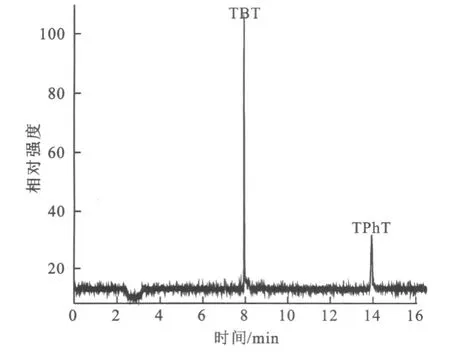
图1 TBT、TPhT标准溶液的色谱分离图Fig.1 Chromatogram of TBT,TPhT standard solution
2.2 提取溶剂的选择
取1.0 g左右大米,加入1.0 m L 1.0 mg/L的TBT、TPh T混合标准液,再分别用20 m L正已烷、乙酸乙酯-正已烷(体积比1∶1)、二氯甲烷按“1.4”方法超声提取20min,比较这 3种溶剂对 TBT、TPh T的提取效果。结果表明,正已烷为提取剂时TBT、TPh T回收率分别为87%,77%;乙酸乙酯—正已烷(体积比为1∶1)为提取剂时 TBT、TPh T回收率分别为92%,81%;而二氯甲烷提取效果较好,TBT、TPh T回收率分别为97%,92%。在此基础上,再考查二氯甲烷用量对 TBT、TPh T提取效果的影响(见图2),由图2可知,当二氯甲烷的用量在10~30 m L时,TBT、TPh T提取效果较好。作者选择10 m L的二氯甲烷。

图2 二氯甲烷用量对TBT、TPhT提取效率的影响Fig.2 Effect of CH2 Cl2 volume on TBT and TPhT extraction efficiency
2.3 提取时间的选择
考查超声提取时间分别为 5、10、20、30、40 min对 TBT和 TPh T提取效果的影响(见图3)。由图3可知,提取时间在5~40 min时对 TBT、TPh T提取影响不大。作者选择提取时间为10 min。

图3 提取时间对TBT、TPhT提取效率的影响Fig.3 Effects of extraction time on TBT and TPhT extraction efficiency
2.4 净化条件选择
为了避免大米基质对分析结果的影响,采用柱层析法对提取液进行净化。弗罗里硅土能大量地吸附脂肪、蜡质、色素等杂质,作者采用弗罗里硅土装柱对提取液进行净化。洗脱溶剂考查了正已烷、二氯甲烷、二氯甲烷—正己烷(体积比1∶1)、乙酸乙酯-正已烷(体积比1∶1)对 TBT、TPh T的洗脱情况,结果发现,正已烷、二氯甲烷、二氯甲烷—正己烷(体积比1∶1)洗脱效果不是很理想,正已烷-乙酸乙酯(体积比1∶1)混合溶剂洗脱情况较好。又通过不同的配比实验,结果表明,用正已烷-乙酸乙酯(体积比1∶1)混合溶剂洗脱,TBT、TPh T都能较好地淋洗下来。故选择的淋洗条件为20 m L乙酸乙酯-正已烷 (体积比1∶1)混合溶剂。
2.5 线性方程、相关系数及检出限
分别配制浓度为 0.1、1.0、2.0、6.0、8.0、10 mg/L的 TBT和 TPh T混合标准工作液,按“1.3”方法进行衍生及测定。结果表明:TBT、TPh T在0.1~10 mg/L的浓度范围内线性良好,相关系数分别为0.999 0,0.999 5,方法检出限分别为0.049 m g/kg,0.075 mg/kg。
2.6 方法回收率和精密度
称取1.0 g左右大米若干份,分别加入1.0 mL质量浓度为0.5、5.0、10 mg/L TBT和 TPh T混合标准液,按1.4方法对样品进行处理后,用正已烷定容至1.0 m L,每个添加水平平行测定5次(见表1)。结果表明 ,在 0.5、5.0、10 mg/L 3个添加水平下,TBT、TPh T的平均回收率为 96.4%~109.4%,相对标准偏差为4.09%~8.46%,所建立的方法能满足实际样品分析的要求。

表1 回收实验结果(n=5)Tab.1 Results of recovery(n=5)
2.7 样品分析
应用建立的方法对南昌等3个地方的大米进行分析,见图4。分别称取一定量的大米,按“1.4”方法进行提取和净化后,氮吹至200μL,在选定的实验条件下测定,结果表明,在所测的大米中均未检出 TBT、TPh T。

图4 大米样品色谱图Fig.4 Chromatogram of rice sample
3 结 语
作者建立了大米中三丁基锡和三苯基锡同时分析的气相色谱法。该方法同时进行衍生和萃取,大大缩短了分析时间,简化了操作步骤,适合于实际样品的分析。
(References):
[1]丘红梅,刘桂华,于振花,等.LC-ICP-MS联用测定海产品中有机锡[J].实用预防医学,2008,15(5):1342-1344.
QIU Hong-mei,LIU Gui-hua,YU Zhen-hua,et al.Speciation analysis of TBT and TPh T in seafood by liquid chromatography linked to inductively coup led plasma mass spectrometry[J].Practical Preventive Medicine,2008,15(5):1342-1344.(in Chines)
[2]Wang X P,Ding L,Zhang H R,et al.Development of an analytical method for organotin compounds in fortified flour samples using microwave-assisted extraction and normal-phase HPLC with UV detection[J].Journal of Chromatography B,2006,843:268-274.
[3]Bravo M,Lespes G,Gregori ID,et al.Determination of organotin compounds by headspace solid phasemicro extraction gas chromatography pulsed flame photometric detection(HS-SPM E GC PFPD)[J].Anal Bioanal Chem,2005,383:1082-1089.
[4]Heroult J,Zuliani T,Bueno M,et al.Analytical advances in butyl-,phenyl-and octyltin speciation analysis in soil by GC-PFPD[J].Talanta,2008,75:486-493.
[5]Jiang GB,Ceulemans M,A dam s F C.Optimization study for the speciation analysis of organo tin and organogermanium compounds by on-column capillary gas chromatography with flame photometric detection using quartz surface-induced luminescence[J].Journal of Chromatography A,1996,727:119-129.
[6]胡勇杰.纺织品中有机锡化合物含量的测定[J].中国纤检,2007,3:19-22.
HU Yong-jie.The determination of o rganotin compounds in textile products[J].China Fibre Product Testing,2007,3:19-22.(in Chinese)
[7]Heroult J,Bueno M,Potin-Gautier M,et al.Organotin speciation in French brandies and wines by solid-phasemicro-extraction and gas chromatography pulsed flame photometric detection[J].Journal of Chromatography A,2008,1180:122-130.
[8]Jiang GB,Zhou Q F.Direct Grignard pentylation of organotin contaminated lard samples followed by capillary gas chromatography with flame photometric detection[J].Journal of Chromatography A,2000,886:197-205.
[9]Yu Z H,Jing M,Wang G,et al.Speciation analysis of organotin compounds in shellfish by hyphenated technique of high performance liquid chromatography inductively coup led plasma mass spectrometry[J].Chinese Journal of Analytical Chem istry,2008,36(8):1035-1039.
[10]Wang X P,Jin H Y,Ding L,et al.Organo tin speciation in textile and plastics by microwave-assisted extraction HPLC ESI-MS[J].Talanta,2008,75:556-563.
[11]Ikonomou M G,Fernandez M P,He T,et al.Gas chromatography high-resolution mass spectrometry based method for the simultaneous determination of nineorganotin compounds in water,sediment and tissue[J].Journal of Chromatography A,2002,975:319-333.
[12]Magi E,Liscio C,Di Carro M.Multivariate optimization approach for the analysis of butyltin compounds in mussel tissues by gas chromatography-mass spectrometry[J].Journal of Chromatography A,2008,1210:99-107.
[13]Tang C H,Wang W H.Op timization of an analytical method for determining organotin compounds in fish tissue by basehydrolysis pretreatment and simultaneous ethylation extraction procedures[J].Analytica Chimica Acta,2007,581:370-376.
[14]Gallego-Gallegos M,Liva M,Munoz Olivas R,et al.Focused ultrasound and molecularly imprinted polymers:A new approach to organotin analysis in environmental samples[J].Journal of Chromatography A,2006,1114:82-88.
[15]Jiang GB,Zhou Q F.Direct Grignard pentylation of organotin contaminated lard samples followed by capillary gas chromatography with flame photometric detection[J].Journal of Chromatography A,2000,886:197-205.
[16]Santos M M,Enes P,Reis-Henriques M A,et al.Organotin levels in seafood from Portuguese markets and the risk for consumers[J].Chemosphere,2009,75:661-666.
Determination of Tributyltin and Triphenyltin in Rice by Gas Chromatography-Flame Photometry
LI Juan2, SHENG Ming-yue2, YAN Ai-ping2, GUO Lan2, WAN Yi-qun*1,2
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Center of Analysis and Testing of Nanchang University,Nanchang 330047,China)
A method for simultaneous determination of tributyltin(TBT)and triphenyltin(TPh T)in rice by GC-FPD was developed in this study.The sample was extracted with CH2Cl2by ultrasonic and derivatived with NaBEt4,then cleaned up by a column filled with florisil.After that,the extract was determined by GC-FPD,the various factors influencing analysis results were exp lo red.The results present the good linearities between analytical signal and analyte concentration in the range of 0.1~10 mg/L with the linear correlation coefficients of 0.9990,0.9995,respectively.Fo r TBT and TPh T,the method detect limit was 0.049 mg/kg and 0.075 mg/kg,respectively.The average recoveries obtained from samples spiked with standards at the concentration levels of 0.5 m g/L,5.0 m g/L and 10 mg/L was in the range of 96.4%~109.4%with relative standard derivation of 4.09%~8.46%.A satisfactory result was obtained in thedetermination of organotin compounds in rice.
tributyltin,triphenyltin,gas chromatography-flame photometry,rice
O 657.63
A
1673-1689(2011)04-0571-05
2010-09-01
国家自然科学基金项目(20765002,20965005);江西省科技支撑项目(2008BB22400);食品科学与技术国家重点实验室目标导向资助项目(SKLF-MB200807);食品科学与技术国家重点实验室自由探索资助项目(SKLF-TS-200918)。
*
万益群(1964-),男,江西进贤人,工学博士,教授,博士研究生导师,主要从事食品质量与安全研究。Email:yqwanoy@sina.com

