菠萝渣纤维素降解菌的筛选及鉴定
罗萍,陈永辉,贺军军,李勤奋,刘洋,易润华
(1.中国热带农业科学院环境与植物保护研究所,海南儋州571737;2.中国热带农业科学院湛江实验站,广东湛江524013;3.广东海洋大学,广东湛江524088)
菠萝原名凤梨,原产巴西,目前已广泛分布在南北回归线之间,成为世界重要的果树之一。16世纪时传入我国,在广东、广西、福建、台湾等地区大面积栽培种植,种植面积达70 000 hm2左右[1]。然而,由于菠萝保存期较短,收获后常用来加工罐头、浓缩汁和蜜饯等,占全果重50%~60%的菠萝皮副产品多被堆积废弃,造成环境污染和资源浪费[2-3]。近年来,随着国内对废弃物综合利用的开发,菠萝加工副产品在资源化利用越来越受到重视,其中生物肥料化利用成为生产中的有效利用方式,但对其科学研究很少[4-5],特别是在利用有效微生物加快发酵方面未见报道。本研究从微生物加快菠萝渣发酵熟化的角度出发,通过对不同堆放时间的菠萝渣中的微生物进行分离、纯化和筛选,选出菠萝渣中的高效降解纤维素菌株,并对其最佳功能培养基进行了筛选及优化,以期为菠萝渣肥料化的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 分离材料采集用于分离的菠萝渣采自广东省丰收糖业发展有限公司堆积场中。
1.1.2 供试分离和筛选培养基样品分离采用4种培养基,具体如下:①赫奇逊CMC培养基(C1,g/L):NaCl 0.1,KH2PO41,MgSO4·7H2O 0.3,FeCl30.01,CaCl20.1,NaNO32.5,CMC 10,琼脂20,pH 7.2~7.4;②赫奇逊CMC-Na培养基(C2,g/L):NaCl 0.1,KH2PO41,MgSO4·7H2O 0.3,FeCl30.01,CaCl20.1,NaNO32.5,CMC-Na 10,琼脂20,pH 7.2~7.4;③纤维素刚果红平板培养基(C3,g/L):(NH4)2SO42,MgSO4·7H2O 0.5,KH2PO41,NaCl 0.5,CMC-Na 10,琼脂20,刚果红0.2,pH值自然;④纤维素刚果红平板培养基(C4,g/L):(NH4)2SO42,MgSO4·7H2O 0.5,KH2PO41,NaCl 0.5,CMC 10,琼脂20,刚果红0.2,pH值自然。功能菌株筛选培养基,具体如下:①Dubos纤维素培养基(g/L):NaNO30.5,K2HPO41,Fe2(SO4)3·7H2O 0.001,CMC 5,MgSO4·7H2O 0.5,KCl 0.5,pH 7.5;②Hutchison培养基(g/L):NaNO32.5,NaCl 0.1,KH2PO41,MgSO4·7H2O 0.3,FeCl30.01,CaCl20.1,CMC 5,pH 7.2~7.4;③磷酸铵钠培养基(g/L):Na(NH4)HPO42,CaCO35,KH2PO41,CaCl2·6H2O 0.3,MgSO4·7H2O 0.5,蛋白胨1,纤维素5 g;④蛋白胨纤维素培养基(g/L):NaCl 5,CaCO32,K2HPO40.5,MgSO40.5,刚果红0.1,蛋白胨5,酵母膏5,纤维素5,微量元素溶液0.5 mL(微量元素溶液成分(g/L):ZnSO40.30,CaCl20.25,CuSO40.25,FeSO40.20),50℃静置培养;⑤改良纤维素刚果红培养基(g/L):NaCl 0.5,(NH4)2SO42,MgSO4·7H2O 0.5,KH2PO41,纤维素粉5,蛋白胨1,pH值自然;⑥CMC培养基(g/L):(NH4)2SO44,KH2PO42,CMC-Na 5,MgSO4·7H2O 0.5,蛋白胨1,pH 7.0~7.4。
1.2 方法
1.2.1 纤维素降解菌的分离采用平板稀释法进行分离。称取菠萝渣样品1 g,加入无菌水10 mL,在振荡机上振荡10 min,形成悬液,吸取1 mL悬液依10倍法稀释到10-6,取10-6稀释液0.1 mL涂布于分离培养基中,每处理重复3次,28℃培养72~96 h,计算菌落数。根据菌落形态、颜色等挑取单菌落,按常规方法纯化后保存。
1.2.2 纤维素功能降解菌的筛选菌株初筛采用滤纸分解法,将滤纸剪成小条,放入试管中,使其略露出液面。将各菌株接种到以滤纸为唯一碳源的Dubos液体培养基中,然后于30℃110 r/min振荡培养5 d,观察滤纸的崩解效果;在初筛的基础上,以FPA酶(3,5-乙硝基水杨酸比色法测定)为评价指标进一步筛选得出纤维素功能降解菌株。
1.2.3 培养基筛选将筛选得到的功能菌株分别接种到菌株筛选培养基中,进行功能培养基的筛选,每个处理3个重复。
1.2.4 菌株鉴定对筛选出的纤维素降解菌进行种的鉴定:①形态学特征鉴定:将筛选出的纤维素降解菌接种于PDA平板中,28℃,恒温培养2~3 d,观察其菌落的生长情况、外观形态;②生理生化特征:主要包括过氧化氢酶、苯丙氨酸脱氨酶、卵磷脂酶试验,糖、醇类分解试验,V-P测定,明胶液化,淀粉水解,丙二酸利用,吲哚产生及生长pH值和温度的测定等,方法参考东秀珠《常见细菌系统鉴定手册》[6];③分子鉴定:细菌的16S分析:经改良的SDS法提取菌株降解微生物的基因组DNA。PCR引物为细菌鉴定通用引物:16(+)5'-AGAGTTTGATCCTGGCTCAG-3',16(-)5'-ACGGCTACCTTGTTACGACT-3'。25 μL扩增体系:模板2 μL,上游引物1 μL,下游引物1 μL,10×buffer 2.5 μL,MgCl2(25 mmol/L)2.5 μL,dNTPs(2 mmol/L)2.5 μL,Taq(3 U/μ)0.35 μL,ddH2O 13.15 μL。将提取的基因组DNA作为模板进行PCR扩增。反应程序:94℃4 min;94℃1 min,50℃30 s,72℃30 s,35个循环;72℃10 min。PCR产物在1%琼脂糖凝胶电泳在标准条件下检测。琼脂糖凝胶电泳并回收目标DNA片段,由生工生物工程(上海)有限公司完成测序,测序结果用BLAST软件在GenBank进行同源性比较,以Clustal X进行多序列比对后,用MEGA 4.0的Neighbor-Joining法构建同源进化树,并进行1 000次Bootstraps检验。
2 结果与分析
2.1 功能菌株分离
由表1可知,从4种分离培养基来看,纤维素刚果红平板培养基Ⅰ(C3)的分离效果最好,平均分离菌落数为36.4 cfu/g;赫奇逊CMC培养基(C1)、赫奇逊CMC-Na培养基(C2)和纤维素刚果红平板培养基Ⅱ(C4)的分离效果相对较差。
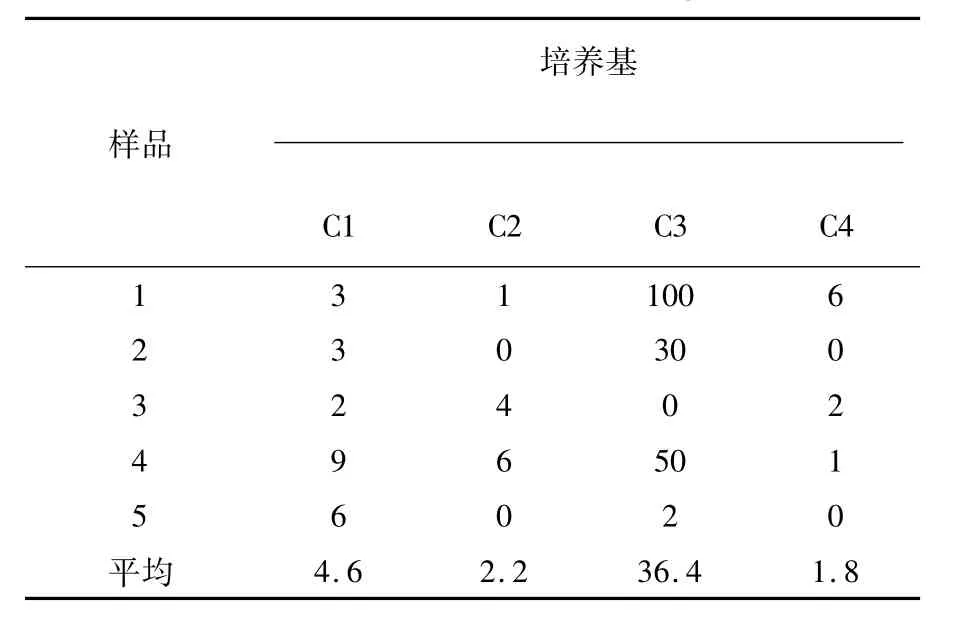
表1 不同培养基纤维素降解菌株分离效果(单位:cfu/g)Table 1 Effect of cellulose degradation strains in different mediums(Unit:cfu/g)
2.2 功能菌株初筛

表2 纤维素降解功能菌株筛选Table 2 First screening of cellulose degrading-bacteria
采用滤纸分解法对纤维素降解菌进行初筛,由表2可看出,从菠萝渣中共获得了72个菌株,其中17个菌株降解能力强,19个菌株有中度降解能力,25个菌株有轻微降解能力,11个菌株没有任何降解能力。
2.3 功能菌株复筛
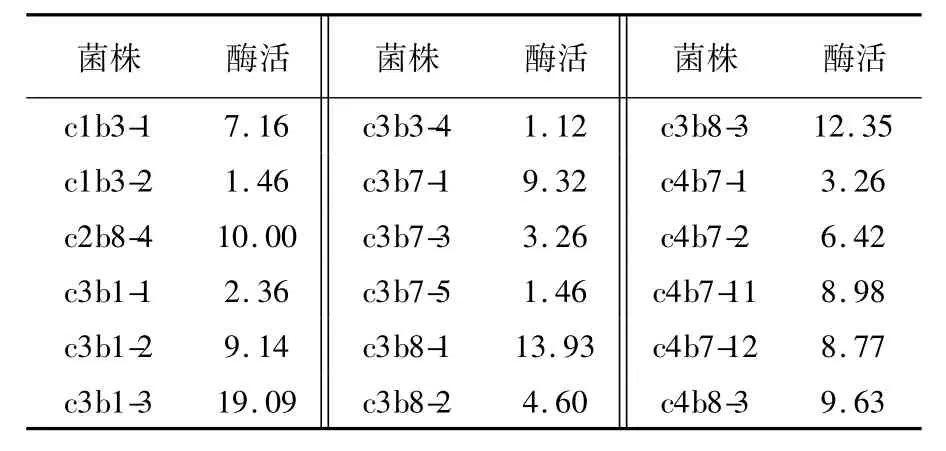
表3 纤维素降解功能菌株复筛(单位:μg/(mL·h))Table 3 Second screening of cellulose degrading-bacteria(Unit:μg/(mL·h))
2.4 功能培养基筛选

表4 功能菌株在不同培养基上FPA酶活(单位:μg/(mL·h))Table 4 FPA enzyme activity of degrading-bacteria in different mediums(Unit:μg/(mL·h))
利用功能菌株在不同培养基上的FPA酶活性来评价菌株功能发挥的最适培养基。由表4可知,c3b1-3菌株FPA酶活性在6种不同培养基表现不一,在蛋白胨纤维素培养基上最高为48.13 μg/(mL·h)。因此,c3b1-3菌株最适功能培养基分别是蛋白胨纤维素培养基(g/L):NaCl 5,
滤纸中的纤维素含量较高,FPA酶水解滤纸中的纤维素,释放出的还原糖与3,5-乙硝基水杨酸(DNS)反应,产生颜色变化,这种颜色变化与释放的还原糖量成正比关系,即与酶样品的酶活性成正比关系。通过用FPA酶活性来评价初筛菌株对纤维素降解能力的大小,从而确定纤维素功能降解菌株。通过实验表明:c3b1-3菌株的FPA酶活性最好,分别为19.09 μg/(mL·h),被确定为纤维素功能降解功能菌株(表3)。CaCO32,K2HPO40.5,MgSO40.5,刚果红0.1,蛋白胨5,酵母膏5,纤维素5,微量元素溶液0.5 mL(微量元素溶液成分(g/L):ZnSO40.30,CaCl20.25,CuSO40.25,FeSO40.20),50℃静置培养。
2.5 高效菌株鉴定
2.5.1 表面形态特征及生理生化特征c3b1-3菌株菌落呈黄白色,表面湿润、光滑,边缘不整齐;杆菌,革兰染色阴性,周生鞭毛,轻微弯曲的杆状,大小0.59 μm×1.64 μm。c3b1-3菌株生理生化测定结果(表5):c3b1-3菌株生长温度范围为15~45℃,生长的pH范围为5~9,能够耐受7%的氯化钠,c3b1-3菌株可能为金黄杆菌属(Chryseobacterium sp.)。
2.5.2 分子鉴定通过测序与比对,c3b1-3菌株rDNA 16S序列与Chryseobacteriumsp.GU 257958.1同源性最高,达到100%。因此,确定c3b1-3菌株为金黄杆菌(Chryseobacterium sp.)(图1)。
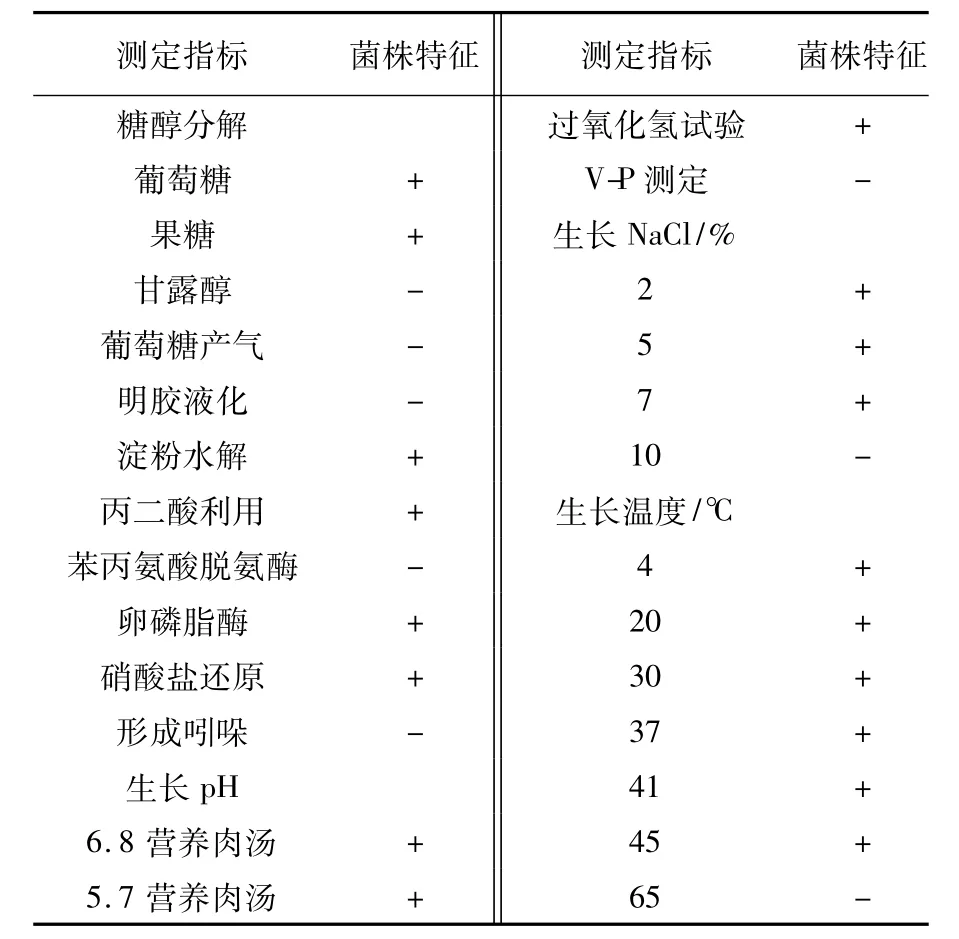
表5 c3b1-3菌株的生理生化特征Table 5 Physiological and biochemical characteristics of c3b1-3 strain
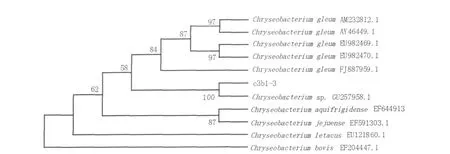
图1 c3b1-3菌株16S rDNA序列同源进化树Fig.1 Homologous evolutionary tree based on the 16S rDNA sequence of c3b1-3 strain
3 小结与讨论
微生物分解纤维素的研究早在1912年就开始了,应用研究主要从20世纪60年代开始,利用微生物生产单细胞蛋白和防止环境污染等方面,在纤维素降解菌株筛选、降解机制及应用方面取得了较大成效。在纤维素降解菌的筛选方面,能降解纤维的纤维粘菌(Cytophaga)、纤维杆菌(Cellulomonas)、纤维放线菌(Acidothermus cellulolyticus)、诺卡氏菌属(Ncardia)及真菌中的木霉属(Trichoderma)、曲霉属(Aspergillus)等[7-10],其中从堆肥中分离筛选到的有纤维单胞菌(Cellulomonas sp.)、斜卧青霉(Penicilliumdecumbens)[11-12]。目前,虽然筛选出不少纤维素降解优势菌株及组合[13-16],但在实际堆肥应用方面的效应不是很理想,仍需要进一步筛选出活性高、产酶量大的菌株或群体,从而实现纤维素类物质的资源化利用。
本文针对菠萝渣肥料化利用出发,通过对多种分离源的纤维素降解菌进行分离、纯化和筛选,从菠萝渣堆制过程中分别获得了1株纤维素功能降解菌,并对其最佳培养基进行筛选。通过试验得出以下结论:①利用多种选择培养基,经过初筛和复筛,从自然发酵不同阶段的菠萝渣中获得了1株高效降解纤维素菌株c3b1-3;②本实验通过采用不同培养基对c3b1-3菌株进行培养,获得了其最适功能培养基为蛋白胨纤维素培养基。通过对其形态、生理生化特征和分子综合鉴定确定出c3b1-3菌株为金黄杆菌属(Chryseobacterium sp.);③c3b1-3菌株的降解效率及其分解的最佳温度等条件还需做进一步的研究。
[1] 邓干然,张劲,李明福,等.我国菠萝叶纤维发展前景分析[J].中国麻业科学,2009,31(4):274-277.
[2] 黄发新,詹云辉.菠萝皮渣酿制白兰地的初步研究[J].广西热作科技,1997,(2):31-35.
[3] 杨礼富,谢贵水.菠萝加工废料—果皮渣的综合利用[J].热带农业科学,2002,22(4):61-70.
[4] 邓干然,张劲,连文伟,等.菠萝叶渣生产有机肥技术初探[J].中国热带农业,2007,(1):55-56.
[5] 邓干然,张劲,连文伟,等.利用菠萝叶渣生产生物有机肥[J].农村新技术,2009,(18):36-37.
[6] 东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001,62.
[7] 刘娣.秸秆纤维素高效降解真菌的筛选、鉴定及其纤维素酶基因克隆[D].北京:中国农业科学院,2008.
[8] Sakon J,Adney W S,Himmel M E,et al.Crystal structure of thermostable family 5 endocellulase E1 from Acidothermus cellulolyticus in complex with cellotetraose[J].Biochem J,1996,35(33):10648-10660.
[9] 刘东波,高培基.纤维素诺卡氏菌的一个新菌株[J].微生物学报,1990,30(1):70-72.
[10] 朴哲,崔宗均,苏宝林,等.一组高效稳定纤维素分解菌复合系MC1的酶活特性[J].中国农业大学学报,2003,8(3):74-79.
[11] 蔡兴旺,路福平,杜连祥.兼性厌氧纤维素降解菌的筛选和产酶研究[J].工业微生物,2005,35(1):6-9.
[12] 刘韫滔,淑霞,龙传南,等.纤维素降解菌L-06的筛选、鉴定及其产酶条件的分析[J].生物工程学报,2008,24(6):1112-1116.
[13] 崔宗均,李美丹,黄志勇,等.一组高效稳定纤维素分解菌复合菌系MC1的筛选及功能[J].环境科学,2002,23(3):36-39.
[14] 邱向阳,陆文静.蔬菜-花卉秸杆混合堆肥性状表征及纤维素分解菌群选育研究[J].北京大学学报,2003,39(2):254-261.
[15] 王伟东,王小芬,高丽娟,等.高效稳定纤维素分解菌复合菌系WSC-6的筛选及其功能[J].黑龙江八一农垦大学学报,2005,(3):14-18.
[16] 费辉盈,常志州,王世梅,等.常温纤维素降解菌群的筛选及其特性初探[J].生态与农村环境学报,2007,23(3):60-64,69.

