1株甲苯降解真菌的筛选鉴定及其降解甲苯的特性
段传人,胡江,宋永安,朱成惠,唐菊,孙达
(1.重庆大学生物工艺实验室,重庆400044;2.重庆有色金属研究所有限公司,重庆400039)
苯系物是环境中分布较广的一类有毒化合物,具有“三致效应”,被许多国家列入优先控制污染物[1-2]。甲苯是一种重要的溶剂和化工原料,甲苯使用量逐年增加,由此带来的环境污染和对人体的健康危害也日益受到关注。人体吸入甲苯主要经呼吸道和皮肤吸收,短时间内吸入较高浓度甲苯可出现眼及上呼吸道明显的刺激症状、眼结膜及咽部充血、头晕、头痛、恶心、呕吐、胸闷、四肢无力、步态蹒跚、意识模糊。重症者可有躁动、抽搐、昏迷。长期接触可发生神经衰弱综合征,肝肿大。因此寻找防治甲苯污染的对策刻不容缓,对人类的健康和环境保护具有重大意义。近年来,生物法处理苯系物污染以其简单高效、能耗低、费用低、无二次污染等特点越来越受到重视[3]。与细菌为核心的生物工艺相比,丝状真菌由于所产生的菌丝体易捕捉气相中的疏水性污染物,同时又具备耐受低pH值和适应干燥环境等特性,而日益成为VOCs生物过滤技术中新的研究热点[4]。国外分离降解苯、甲苯的真菌主要有宛氏拟青霉(Paecilomyces variotii)[5]、尖端赛多孢子菌(Scedosporium apiospermum)[6]、诺卡氏菌(Nocardia)[7]、孢瓶霉属真菌(Cladophialophora)[8]、外甁霉(Exophiala oligosperma)[9]等,国内的研究较少,仅有侯晨涛[10]进行了相关研究,分离的真菌为霉菌(绿色木霉、宛氏拟青霉、文氏曲霉和顶孢头孢霉)。白腐真菌是一类引起木质白色腐烂的丝状真菌的总称,白腐菌分泌多种生物酶参与芳香化合物的降解过程,并且可能按照不同的降解机制将芳香化合物降解,降解反应也不仅仅局限次生代谢阶段和细胞外以及主要降解酶的非专一性,白腐菌对多环芳烃、烷基苯类、氯代芳香化合物及硝基苯类化合物等4大类芳香族化合物均有一定的降解能力[11]。多数研究者利用白腐真菌降解多环芳烃,而研究表明白腐菌也能降解挥发性有机物。Qi等[12]研究了5种白腐真菌以9种VOC(苯、甲苯、乙烯、苯乙烯等)的蒸汽作为碳源和能源,研究表明,黄孢原毛平革菌除了苯乙烯外的其他几种VOC,这项工作为建立利用白腐菌对VOC污染进行治理的反应器模型(如生物滤池)提供了研究基础。发现黄孢原毛平革菌能降解苯、甲苯、二甲苯、乙烯等挥发性有机化合物。黄孢原毛平革菌对挥发性有机物的降解发生在初级代谢。虽然白腐菌对非挥发性有机物化合物(包括PAH和其他难降解化合物)的降解能力的研究很多,但是白腐菌降解气相VOC污染物的能力报道几乎很少。近年来人们对白腐菌降解VOCs产生了浓厚的兴趣,对其降解VOCs的机制进行了初步研究,对其在生物过滤法去除VOCs气体污染的应用中进行了深入的实践。白腐真菌主要通过细胞色素氧化酶(P450)和木质素降解酶系2种途径来实现对污染物的降解。木质素降解酶系包括LiP、MnP、Lac 3种酶,这3种酶都是在白腐菌次生生长阶段产生,利用这3种酶对底物进行降解时需要额外添加白腐菌生长所需要的营养物质。本文筛选到1株甲苯优势降解菌H1,鉴定为毛栓菌(Trametes hirsuta),该菌株是一种富产漆酶的白腐菌。漆酶是一种含铜的多酚氧化酶,对多种环境污染物具有降解能力。目前主要研究了真菌漆酶对多环芳烃类物质和氯酚类物质的降解规律[13],毛栓菌及其漆酶对甲苯的降解的研究还很少。本实验对毛栓菌生物学特性及甲苯降解特性进行了研究,为深入开发该菌用于含甲苯的污水和废气处理奠定了良好基础。
1 材料与方法
1.1 材料
1.1.1 试验菌种Phanerochaete chrysosporium
(编号5.776)购于中国科学院微生物研究所;Pleurotus ostreatus(编号1#)购于重庆市农科所;H1~H5采集于重庆缙云山,保存于本实验室。
1.1.2 培养基(g/L)PDA培养基:土豆200,葡萄糖20,琼脂18;土豆葡萄糖液体培养基:土豆200,葡萄糖20;限氮培养基:葡萄糖10,酒石酸铵0.2,苯甲醇0.54,KH2PO42.56,MgSO4·7H2O 0.71,维生素B10.001,微量元素液70 mL,10 mmol/L醋酸缓冲液调节pH至4.5;微量元素液:氨基乙酸0.6,MnSO4·H2O 0.5,NaCl 1,FeSO4·7H2O 0.1,CoCl2·H2O 0.19,CaCl2·2H2O 1.56,ZnSO4·7H2O 0.1,CuSO4·5H2O 0.1,KAl(SO4)2·12H2O 0.01,HBO30.01;无碳培养基:酒石酸铵2.0,Na2HPO40.47,KH2PO40.45,MgSO4·7H2O 0.5,无水CaCl20.01,MnSO4·H2O 0.001,FeSO40.001,ZnSO4·7H2O 0.001,CuSO4·5H2O 0.001。
1.2 方法
1.2.1 菌株的筛选甲苯降解菌的筛选在含有50 mL基础盐培养基的250 mL磨口三角瓶中进行。将实验室保藏的5株真菌(H1~H5)和购买的黄孢原毛平革菌(Phanerochaete chrysosporium)、糙皮侧耳(Pleurotus ostreatus)接种到PDA平板置于30℃恒温活化6 d,经过活化的菌种用10 mm的打孔器打孔,挑取2片菌片,置于50 mL甲苯浓度为200 mg/L的基础盐培养基中,用铝箔将三角瓶的瓶口密封,以防止苯和甲苯的挥发,于30℃、150 r/min培养10 d。每天观察记录菌种的生长情况。气相色谱法测定第10天7株菌株对甲苯的降解率。
1.2.2 菌株对甲苯降解率测定为了解菌株对甲苯的降解速率,将活化后的菌种分别接入50 mL的无机盐培养基中,向培养基中投入433 mg/L的甲苯。甲苯浓度的测定采用气相色谱法,气相色谱仪为Agilent HP6890,检测器为FID,柱子为Agilent DB-1,载气为99.999%N2,流量为80 mL/min,检测温度240℃、柱相温度80℃、汽化室温度200℃。用微量注射器直接取三角瓶里的气体,进样量为100 μL。
1.2.3 优势甲苯菌株的鉴定①菌株形态鉴定:菌种形态鉴定的方法和分类依据见参考文献[10];②菌种分子鉴定:提取H1基因组DNA作为模板,用真菌ITS的通用引物进行PCR扩增。上游引物ITS1(5'-TCCGATGGTGAACCTGCGG-3'),下游引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')。扩增体系:模板(50 ng/μL)2 μL,dNTPs(2.5 mmol/L)1 μL,引物(10 μmol/L)各1 μL,Mg2+(25 mmol/L)1.5 μL,10×Taq缓冲液2.5 μL,Taq酶(5 U/μL)0.5 μL,加ddH2O至25 μL。PCR反应条件:95℃5 min,95℃30 s,60℃30 s,72℃1 min,循环30次,72℃延伸10 min。琼脂糖凝胶电泳检测PCR产物。回收PCR产物并与PUM-T质粒连接(反应体系为5 μL:PUM-T载体0.5 μL,PCR产物0.5 μL,连接缓冲液2.5 μL,T4连接酶0.5 μL,ddH2O 1 μL),16℃连接过夜。转化后挑阳性克隆提质粒,经酶切鉴定后测序(北京六合华大基因科技股份有限公司完成),将测序序列与GenBank中的基因序列进行相似性比较。
1.2.4 优势降解菌降解条件正交实验设计本实验采用的4因素为A培养温度、B初始pH、C甲苯浓度、D吐温添加量,采用4因素4水平正交实验设计,见表1。用0.1 mol/L的HCl和0.1 mol/L NaOH调节基础培养基的pH值。
1.2.5 漆酶酶活测定[14]①酶液制备:对液体发酵的菌种,从第2天起每天定时取样,具体步骤:在超净工作台中将培养了2 d的液体菌种10 mL倒入50 mL的离心管中,4 000 r/min离心15 min,取上清液作为待测样品备用;②漆酶酶活测定:取待测酶液,对每种样品进行3次平行实验,实验结果取平均值。漆酶(Lac)测定方法:取2 mL(浓度为50 mmol/L,pH值为4.5)乙酸-乙酸钠缓冲液,加入1 mL粗酶液和1 mL(浓度为16 mmol/L)愈创木酚,组成4 mL的反应体系。在35℃时测定465 nm处光吸收值变化量。酶活单位的定义:1 min内吸光度增加0.01所需要的酶量为1 U。

表1 因素与水平的设置Table 1 Arrangement of factors and levels
2 结果与分析
2.1 甲苯优势降解菌的筛选

图17 株真菌对甲苯的降解能力比较Fig.1 Degradation ability comparison of seven toluene-degradlng bacteria
在甲苯作为唯一碳源的无机盐培养基中,微生物菌体细胞只能通过对甲苯的降解,获得生长所需的碳源。郭晓芬等[15]研究发现甲苯降解和菌体浓度变化具有一致性,利用菌体浓度变化是一种简单、省时可行的评估方法。将7株真菌接种到甲苯初始浓度为200 mg/L的无机盐培养基中培养10 d,每天记录真菌的生长量(表2),菌株H1菌体生长量显著高于其余6株真菌菌体生长量。当培养第4天时,H1菌种开始生长,优先于黄孢原毛平革菌(第5天)和H5菌株(第5天)。采用气相色谱法测定培养10 d后,7种真菌的培养基中剩余的甲苯浓度,由图1可知,黄孢原毛平革菌、糙皮侧耳、H1和H4菌株能够降解甲苯,降解率分别为64.8%、50.2%、83.3%、62.9%。而菌株H2、H3、H4几乎不能降解甲苯。综上所述,选择甲苯降解率最高的H1菌株作为降解甲苯的优势菌株。

表2 7株真菌在甲苯作为唯一碳源的培养基中的菌丝量Table 2 Mycelium production by seven fungal strains growing on toluene as sole carbon
2.2 菌种鉴定
2.2.1 形态鉴定菌株在PDA培养基上生长情况:供试菌株在PDA培养基上接种2 d后便开始萌发。菌落呈白色,绒毛状,菌丝致密,爬壁能力较强,菌落平展圆形(见图2a)。菌丝电子显微镜观察如图2b所示:菌丝无色,长短、粗细不等,单个或数个相连,菌丝分枝、有锁状联合。

图2 菌株H1菌落形态和扫描电镜照片Fig.2 Colonies morphology and scanning electron micrograph of strain H1
2.2.2 H1菌株的ITS序列测定及其系统发育树的构建利用ITSrDNA通用引物对H1基因组DNA进行PCR扩增得到600 bp的目的DNA片段。同GenBank中的基因序列进行同源性对比。从结果中选取20株Trametes具有代表性的菌株,以ITS基因序列同源性为基础,结果表明H1菌株的ITS序列与菌株Trametes hirsuta(EF546240.1)、Trametes hirsuta(FJ550367.1)ITS序列区具有100%的同源性。结合采用Clustal X2.0和MEGA 4.0(1 000次抽样分析)软件构建系统发育树,如图3所示。遗传距离显示菌株H1与Trametes hir-suta(EF546240.1)、Trametes hirsuta(FJ550367.1)的遗传距离最近。根据形态特征和ITS序列分析结果,参见文献[16]确定菌株H1为毛栓菌(Trametes hirsuta)。毛栓菌隶属于担子菌门非褶菌目多孔菌科栓菌属,是重要的白腐真菌,栓孔菌多是重要的生物资源,在我国广泛分布。查阅相关文献,未发现该菌降解甲苯的报道。

图3 H1菌株与Trametes sp.中典型菌株的系统发育树图Fig.3 Phylogenetic tree of the strain H1 with type strains of Trametes sp.
2.3 菌株H1对甲苯的降解曲线
菌株H1对甲苯的降解率随时间变化如图4所示,菌株H1在培养基体系中具有较长的适应期,在4 d即开始表现出一定的降解能力,降解率为10.4%,随着培养时间的延长,降解效率逐渐增加,在最初的8 d里,甲苯的降解效率随时间迅速升高,达到44.27%,但在随后的几天里降解效率趋缓。到12 d培养结束时达到最大降解率,最大降解率为57.17%。Demir G.[17]研究了杂色云芝(Trametes versicolor)在pH为5、温度为28℃、转速为150 r/min的条件下对4种不同浓度的苯、甲苯降解,该菌4 h内能将50 mg/L的苯甲苯完全降解,36 h能降解300 mg/L的甲苯,表明栓菌属真菌能够有效地降解甲苯。

图4 H1对甲苯的降解率Fig.4 Toluene degradation rates of H1 strain
2.4 正交实验结果与分析
微生物生长以及对甲苯的利用受到培养基组成、温度、pH、甲苯浓度等许多因素的影响,提供最适条件可加速甲苯的降解,反之则会降低微生物降解甲苯速率。目前报道的菌种最适降解条件不能间接或直接来自其他菌株培养所用,因此通过优化降解条件,甲苯降解速率可能会得到进一步提升。本实验对4个因素(温度、pH、初始甲苯浓度、吐温添加量)进行了正交实验。表4的分析结果方差结果表明,甲苯浓度、温度、pH对降解率的差异极显著,吐温添加量对降解率的影响不显著,4因素的主次顺序为甲苯浓度>pH>温度>吐温添加量。吐温添加量在0~1 mL/L之间对甲苯的降解率影响不大,温度在20~35℃、pH在5~8、初始甲苯浓度在50~500 mg/L之间变化都对甲苯的降解率有不同程度的影响。由表3可以看出,菌株H1降解甲苯的最佳条件为A3B3C1D2,即当甲苯初始浓度为300 mg/L,温度为30℃,pH为5.0,吐温添加量为0.05%时,培养10 d,H1菌株对甲苯的降解效果最好,降解率为85.3%。一定浓度的吐温80可以显著提高水相中苯系物的溶解度,增大微生物与底物的接触几率,增加生物可利用率,提高酶促反应;吐温浓度过高则会抑制微生物对底物的降解,吐温80与底物成竞争关系。由于本实验选取的吐温80浓度较低,所以对甲苯的降解率的影响不显著。
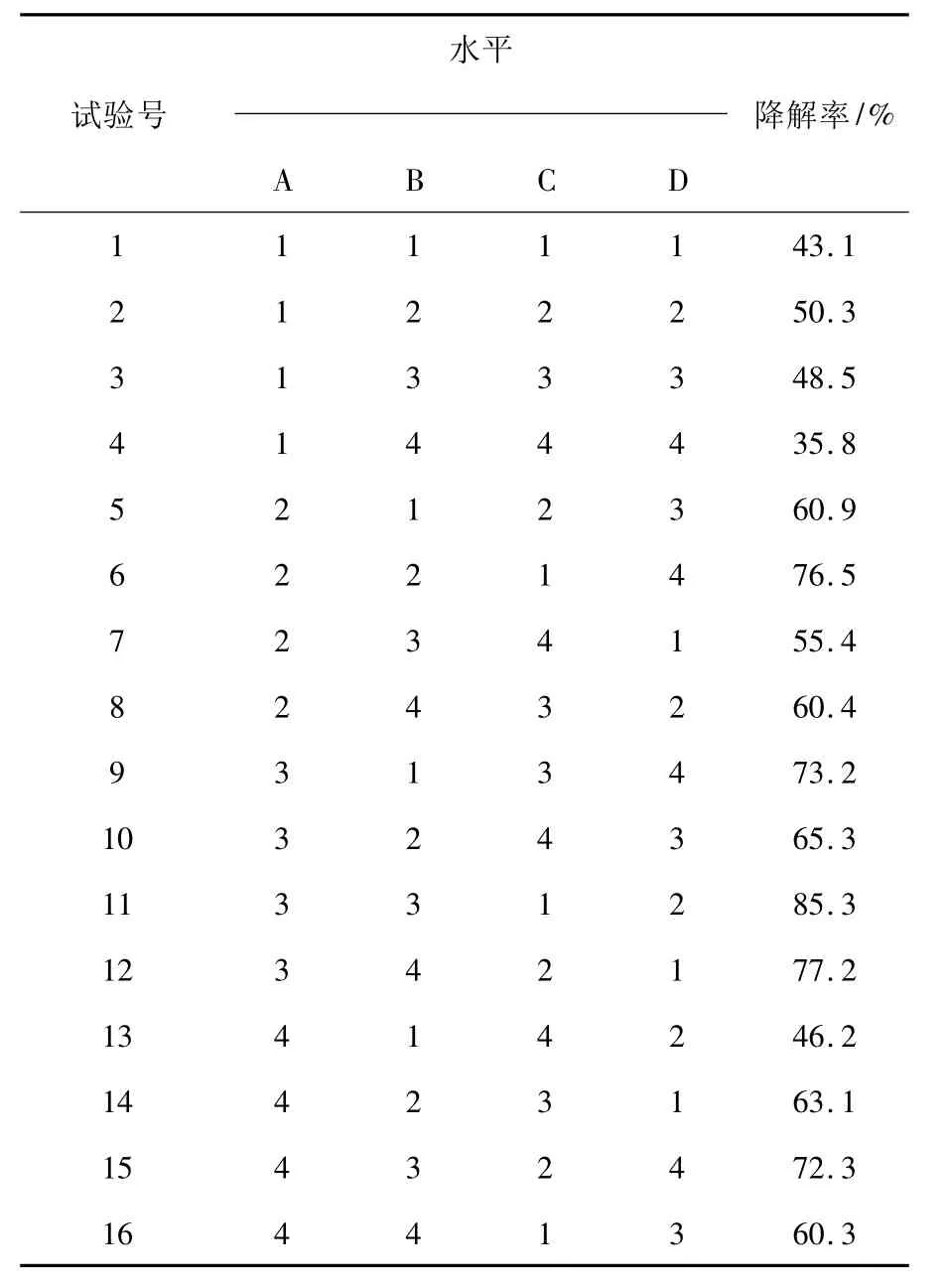
表3 L16(44)正交实验结果Table 3 Results of L16(44)orthogonal experiment
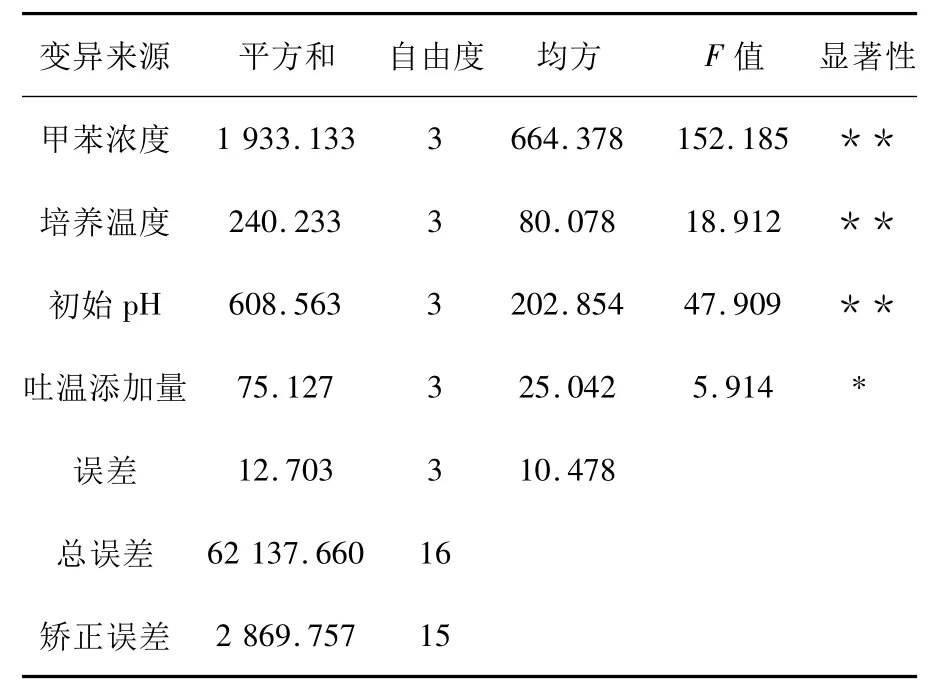
表4 正交实验结果方差分析Table 4 Analysis of variance of orthogonal test
2.5 H1菌株在3种培养基中的产漆酶能力比较

图5 H1菌株在3种培养基中的漆酶活性Fig.5 The laccase activity produced by H1 in three kinds of medium
漆酶(Laccase)是一种含铜的多酚氧化酶,漆酶在生物制浆、生物漂白、脱色以及有毒化合物的降解等方面具有广泛的应用前景。H1菌株所属的栓菌属是真菌漆酶的研究热点。本实验选择了限氮培养基、土豆葡萄糖液体培养基、无机盐培养基作为供试培养基,测定H1菌株在3种培养基中的产酶情况,由图5可知,第7天时H1在3种培养基培养出现产酶高峰期,H1在限氮培养基、土豆葡萄糖液体培养基、无机盐培养基的酶活分别为5 540、16 500、589 U/L。在甲苯为唯一碳源的无机盐培养基中,漆酶酶活小于H1菌株在土豆培养基和限氮培养基中漆酶的酶活,可能是由于甲苯作为碳源时限制了漆酶的分泌。司静等[18]通过正交实验方法对筛选到的漆酶高产菌株东方栓孔菌(Trametes orientalis Cui 6300)的漆酶产酶条件进行优化,优化后漆酶酶活最高可达19 923 U/L。本实验H1菌种在未优化的条件下漆酶酶活最高可达16 500 U/L,由此表明H1菌株是1株漆酶高产菌株。
3 讨论
甲苯的使用越来越广泛,其危害给人类健康带来了巨大的威胁。自然界的某些微生物能够通过体内的降解酶将甲苯降解为水和CO2。在目前已报道的苯系物降解微生物中,主要分布在细菌中的假单胞菌属(Pseudomonas sp.)[19]、不动杆菌属(Acinetobacter sp.)[20]、芽胞杆菌属(Bacillus sp.)[21]和红球菌属(Rhodococcus sp.)[21],但对真菌降解苯系物的报道还比较少。在已分离到的菌种中铜绿假单胞菌(Pseudomonas aeruginosa)[22]在28℃、pH 7.0、初始甲苯浓度为500 mg/L条件下,该菌48 h降解率达到99.2%。嗜吡啶红球菌[23]PYJ-1(Rhodococcus pyridinovorans)在pH 7.0,温度为32℃时能降解50 mg/L的甲苯。本实验从实验室保存的7株真菌中筛选到1株甲苯高效降解菌毛栓菌(Trametes hirsuta)H1,该菌甲苯在初始浓度为300 mg/L,温度为30℃,pH为5.0,吐温添加量为0.05%时,培养10 d,H1菌株对甲苯的降解效果最好,降解率为85.3%,菌株优化后的甲苯降解率比优化前提高了28.13%。本实验还表明毛栓菌H1菌株在甲苯的底物浓度在50~500 mg/L、温度在20~35℃、pH在5~8的范围内对甲苯均有一定的降解效果,说明该菌对温度、甲苯浓度和pH都有较好的适应性,这有助于该菌在生物过滤塔处理甲苯废气中的应用。章剑丽等[22]研究了吐温80的添加量对混合细菌降解苯系物的影响,发现吐温80的添加量能对苯系物的降解率产生明显影响。一定浓度的吐温80可以显著提高水相中苯系物的溶解度,增大微生物与底物的接触几率,增加生物可利用率,提高酶促反应。由于本实验选取的吐温80浓度的范围较窄,所以对甲苯的降解率没有极显著影响。
甲苯在微生物中的降解途径有多种,单加氧酶和双加氧酶是细菌降解甲苯的关键酶。在白腐真菌中,木质素酶系在白腐菌对污染物的降解中有非常重要的作用。然而,木质素酶系参与BTEX(苯系物)降解中的研究还非常少。Yadav等[24]发现P.chrysosporium在不产生木质素酶的条件下降解BTEX,而通过2,3-苯双加氧酶使单环芳烃开环。Elisabet Aranda等[25]首次发现T.versicolor中的漆酶等木质素酶通过产生·OH参与了BTEX的降解,木质素降解酶系和·OH在BTEX降解中的具体作用还有待进一步研究。本研究H1菌株以甲苯为唯一碳源降解甲苯时,漆酶的酶活为589 U/L,远远小于葡萄糖作为碳源时H1菌株的漆酶酶活。H1菌株的漆酶等木质素酶是否参与了甲苯的降解以及H1菌株降解甲苯途径的机制有待进一步研究。
[1] Xu Z,Mulchandani A,Chen W.Detection of benzene,toluene,ethyl benzene and xylenes(BTEX)using toluene dioxygenase-peroxidase coupling reactions[J].Biotechnol Prog,2003,19(6):1812-1815.
[2] 杨卫兵,朱润晔,张丽丽,等.1株BTEX降解新菌株的分离鉴定及其降解特性研究[J].环境科学,2010,31(3):821-827.
[3] 吴丹,李发云,陈晓阳,等.生物过滤法处理挥发性有机化合物研究进展[J].科技导报,2009,27(16):99-103.
[4] 王灿,席劲瑛,胡洪营.丝状真菌生物过滤塔对挥发性有机物的去除性能[J].环境科学与技术,2008,31(7):40-43.
[5] Francesc X.,Prenafeta-Boldu,Richard Summerbell,G.Sybren de Hoog.Fungi growing on aromatic hydrocarbons:biotechnology’s unexpected encounter with biohazard[J].FFMS Microbiol Rev,2006,30(1):109-130.
[6] Estévez Elenea,Veiga Maria C,Kennes Christian.Biofiltration of waste gases with the fungi Exophiala oligosperma and Paecilmyces variotii[J].Appl Microbiol Biotechnol,2005,67(4):563-568.
[7] García-Pena EI,Hernández S,Favela-Torres E,et al.Toluene biofiltration by the fungus Scedosporium apiospermum TB1.[J].Biotechnology and Bioengineering,2001,76(1):61-69.
[8] Stapleton R D,Bright N G,Sayler G C.Catabolic and Genetic diversity of degradative bacteria from fuel-hydrocarbon contaminated aquifers[J].Microb Ecol,2000,39(3):211-221.
[9] Kim D,Kim S Y,Kim S K,et al.Monocyclie aromatic hydrocarbon degradation by Rhodococcus sp.Strain DK17[J].Appl Environ Micobiol,2002,68(7):3270-3278.
[10] 侯晨涛,马广大,曹晓强,等.净化三苯废气生物滤池中微生物的初步鉴定[J].环境科学与技术,2006,29(11):37-38.
[11] 李慧蓉.白腐真菌生物学和生物技术[M].北京:化学工业出版社,2005:10-13.
[12] Qi B,Moe WM,Kinney KA.Biodegradation of volatile organic compounds by five fungal species[J].Appl Microbiol Biotechnol,2002,58(5):684-689.
[13] 徐淑霞,宋安东,张世敏.杂色云芝漆酶和发酵液降解对苯二酚研究[J].安全与环境学报,2007,7(6):54-57.
[14] 段传人,朱丽平,姚月良.三种白腐菌及其组合菌种木质素降解酶比较研究[J].菌物学报,2009,28(4):577-582.
[15] 郭晓芬,邓连英.微生物处理甲苯废气的菌种选育[J].食品与生物技术学报,2005,24(3):12-15.
[16] RENSKE L,PAULA L,THANW K,et al.Molecular identification of ectomycorrhizal mycelium in soil horizons[J].Appl Environ Micmhiol,2003,69(1):327-333.
[17] Demir G.Degradation of toluene and benzene by Trametes versicolor[J].Environ Biol.,2004,25(1):19-25.
[18] 司静,崔宝凯,戴玉成.栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J].微生物学通报,2011,38(3):405-416.
[19] 霍丹群,孙兴福,饶佳家.甲苯降解菌的分离、鉴定及其对甲苯的降解特性[J].化工环保,2005,25(5):337-340.
[20] 王琳,邵宗泽.4株苯系物降解菌株的筛选鉴定、降解特性及其降解基因研究[J].微生物学报,2006,46(5):753-757.
[21] 李闻,马静,张伟,等.高效甲苯降解菌的驯化及筛选方法研究[J].卫生研究,2008,37(2):129-132.
[22] 章剑丽,仵彦卿,张小凡,等.苯系化合物降解的微生物筛选及其特性初探[J].净水技术,2010,29(3):29-33.
[23] Barbara H,Howard J,Jolana V.Alternative primer sets for PCR deletion of genotypes involved in bacterial aerobic BTEX degradation:Distribution of the genes in BTEX contaminated industrial site[J].Microbiol Meth,2006,64:250-265.
[24] Yadav,J.S.,Reddy,C.A.Degradation of benzene,toluene,ethylbenzene,and xylenes(BTEX)by the lignin-degrading basidiomycete Phanerochaete chrysosporium[J].Appl.Environ.Microbiol,1993,59(3):756-762.
[25] Elisabet Arandaa,Ernest Marco-Urreab,Gloria Caminalc,et al.Advanced oxidation of benzene,toluene,ethylbenzene and xylene isomers(BTEX)by Trametes versicolor[J].Journal of Hazardous Materials,2010,181(1):181-186.

