L-缬氨酸高产菌诱变育种的研究
张伟国, 钱和
(1.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;2.江南大学生物工程学院,江苏无锡 214122;3.江南大学食品学院,江苏无锡 214122)
L-缬氨酸高产菌诱变育种的研究
张伟国1,2, 钱和3
(1.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;2.江南大学生物工程学院,江苏无锡 214122;3.江南大学食品学院,江苏无锡 214122)
以黄色短杆菌(Brevibacterium flavum)L-缬氨酸产生菌XQ-2为出发菌株,经硫酸二乙酯(DES)和亚硝基胍(N TG)逐级诱变处理,氨基酸结构类似物α-氨基丁酸(α-AB)、2-噻唑丙氨酸(2-TA)和α-氨基-β-羟基戊酸(AHV)定向筛选,获得一株L-缬氨酸高产菌 XQ-8(Leul(-ABhr2-TAhrA HVhr)。在以135 g/L葡萄糖为碳源和50 g/L硫酸铵为氮源的培养基中摇瓶发酵72 h,产酸达64~66 g/L。
L-缬氨酸;诱变育种;黄色短杆菌
L-缬氨酸是人体8种必需氨基酸之一,同时又是3种支链氨基酸之一,因其特殊的结构和功能在人类生命代谢中占有特别重要的地位,可广泛应用于食品和医药等方面,但由于其生产成本较高,价格较贵,目前主要用于配制复合氨基酸制剂,特别是应用于高支链氨基酸输液(如3H输液等)和口服液(肝安干糖浆等)。最近,人们发现L-缬氨酸是合成一种治疗高血压的特效药——缬沙坦的重要中间体,其年消耗量猛增到数千吨。
目前,国际上生产L-缬氨酸均采用发酵法。日本的松琦氏选育的厌气杆菌在100 g/L的葡萄糖培养基中产酸达15 g/L[1];Tsuchicla等选育的乳糖发酵短杆菌摇瓶产酸达31g/L[2];日本协和公司的L-缬氨酸产酸水平达40~50 g/L[3]。中国科学院微生物研究所于1975年在国内首次报道了L-缬氨酸产生菌北京棒杆菌突变株AS1.586的选育,产酸为26 g/L[4]。“七五”期间中国科学院微生物研究所进行了第二代缬氨酸高产菌的选育,摇瓶产酸提高到30g/L[5]。张伟国选育的黄色短杆菌XQ-2摇瓶产酸达42~45g/L[6];浦军平等选育L-缬氨酸产生菌种摇瓶产酸达45g/L[7]。张伟国等选育的黄色短杆菌XQ-6摇瓶产酸达58~62g/L[8]。赵丽丽等选育的缬氨酸高产菌TV2564,5 L罐补料分批发酵,产酸达50 g/L[9]。徐庆阳等选育的L-缬氨酸高产菌,10 L发酵罐补料分批发酵72 h,产酸可达53.4 g/L[10]。本试验对以前选育的L-缬氨酸产生菌 XQ-6定向育种,产酸进一步提高,摇瓶产酸64~66 g/L,50 L发酵罐补料分批发酵68 h产酸高达68.7 g/L。
1 材料与方法
1.1 菌种
出发菌株为L-缬氨酸产生菌XQ-2(Leul(-ABrAHVr2-TAr)。
1.2 培养基
1.2.1 完全培养基(g/L) 葡萄糖5、牛肉膏10、蛋白胨 10、NaCl 5、琼脂条 25。
1.2.2 基础培养基(g/L) 葡萄糖20、(NH4)2SO41.5、KH2PO41、K2HPO43、M gSO4·7H2O 0.5、M nSO4·4H2O 0.01、FeSO4·7H2O 0.01、VH 30μg/L、VB1·HCl 100μg/L、尿素 1.5、琼脂粉20。
1.2.3 种子培养基(g/L) 葡萄糖 25、(N H4)2SO45、KH2PO41、M gSO4·7H2O 0.5、玉米浆 35~40、尿素 2.5、CaCO310。
1.2.4 发酵培养基(g/L) 葡萄糖 120~150、(NH4)2SO435~50、KH2PO41、M gSO4·7H2O 0.5、M nSO4·4H2O 0.01、FeSO4·7H2O 0.01、VH 25~100μg/L、VB1·HCl 50μg/L、玉米浆5~10、CaCO340。
完全、基础和种子培养基均以20 g/dL NaOH调p H至7.5~7.6,0.1 M Pa压力下灭菌20 m in。发酵培养基以20 g/dL NaOH调p H值为7.5~7.6,0.07 M Pa压力下灭菌8 min。
1.3 主要试剂
硫酸二乙酯(DES)为上海试剂厂产品;亚硝基胍(N TG)为瑞士 Fluka公司产品;(-氨基丁酸((-AB)、α-氨基-β-羟基戊酸 (A HV)和 2-噻唑丙氨酸(2-TA)为美国Sigma公司产品。
1.4 诱变方法
常规化学诱变法[11]。
1.5 氨基酸结构类似物抗性株检出方法
将氨基酸结构类似物按一定浓度混合于基础培养基中,制成平板后,涂布上述经诱变处理过的菌体,置30℃恒温箱中培养3~5 d后长出的大菌落,即是氨基酸结构类似物抗性变异株。
1.6 分析方法
1.6.1 p H值测定 用酸度计测定法。
1.6.2 菌体生长 吸取样品菌液0.2 m L加到5 m L浓度为0.25 mol/L HCl溶液中,摇匀后测定A562nm值。
1.6.3 葡萄糖 采用SBA-4多功能谷氨酸-葡萄糖分析仪测定。
1.6.4 L-缬氨酸 纸上层析法、比色定量法[12]和氨基酸分析仪测定。
2 结果与讨论
2.1 L-缬氨酸高产菌 XQ-6的选育谱系
2.1.1 α-ABhr变异株的获得 从 XQ-2出发,经DES诱变,高浓度α-AB平板筛选,获得α-ABhr变异株215株,经摇瓶筛选获得一株L-缬氨酸高产菌V 5-128,产酸质量浓度为45~47g/L。
2.1.2 2-TAhr变异株的获得 在获得 V 5-128的基础上,经N TG诱变,高浓度2-TA平板筛选,获得2-TAhr变异株163株,其中有几株L-缬氨酸积累有不同程度的增加,代表性株V 6-56的产酸达55~56 g/L。
2.1.3 A HVhr变异株的获得 继续由N TG诱变,高浓度A HV平板筛选,获得AHVhr变异株98株,其中有几株L-缬氨酸积累有不同程度的增加,代表性株V 7-87的产酸达60~62 g/L,经单菌落分离发酵条件优化,产酸稳定在64~66 g/L。
2.1.4 L-缬氨酸高产菌XQ-8的选育谱系 从选育的L-缬氨酸产生XQ-2出发,经DES和N TG诱变处理,L-缬氨酸结构类似物定向选育,得到L-缬氨酸高产菌XQ-8,具体选育谱系见图1。
2.2 L-缬氨酸高产菌 XQ-8发酵条件的研究

图1 L-缬氨酸高产菌XQ-8的选育谱系Fig.1 Schematic chart of mutagensis procedure for L-valine producer XQ-08 Superscript l-leaky mutant r-resistance hr-high resistance
2.2.1 各种营养物质对产酸的影响 考察了生物素对XQ-8菌株L-缬氨酸发酵的影响。结果表明,生物素为XQ-8菌株生长和产酸的唯一必需因子,缺之,菌体不能生长和产酸 (见图2)。当生物素添加质量浓度为40~50μg/L时,可获得较高的L-缬氨酸积累。由于只添加纯生物素时前期菌体生长较慢,故进行添加生物素同时添加少量玉米浆发酵试验,结果表明,当添加40~50μg/L生物素和0.5 g/dL玉米浆时,L-缬氨酸积累最高,达64~66 g/L(见图 3)。

图2 生物素对L-缬氨酸发酵的影响Fig.2 Effect of biotin on L-valine production
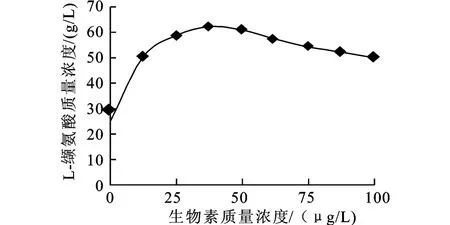
图3 添加玉米浆时生物素对L-缬氨酸发酵的影响Fig.3 Effect of the additional corn steep liquor and biotin on L-valine production at one time
添加支链氨基酸(L-亮氨酸和L-异亮氨酸),当浓度较低(≤2 g/L)时,对L-缬氨酸发酵的影响不大(如图4所示);只有当支链氨基酸的浓度较高(≥6 g/L)时,则影响较大(如图5所示)。
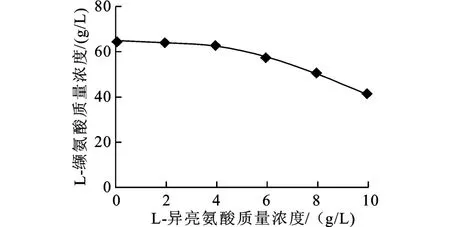
图4 L-亮氨酸对L-缬氨酸发酵的影响Fig.4 Effect of L-leucine on L-valine production

图5 L-异亮氨酸对L-缬氨酸发酵的影响Fig.5 Effect of L-isoleucine on L-valine production
2.2.2 XQ-8菌株L-缬氨酸最佳发酵条件 应用正交试验法综合考察了培养基成分、种龄、接种量等多种因素对菌株产酸的影响,得到的最佳发酵条件列于表1。
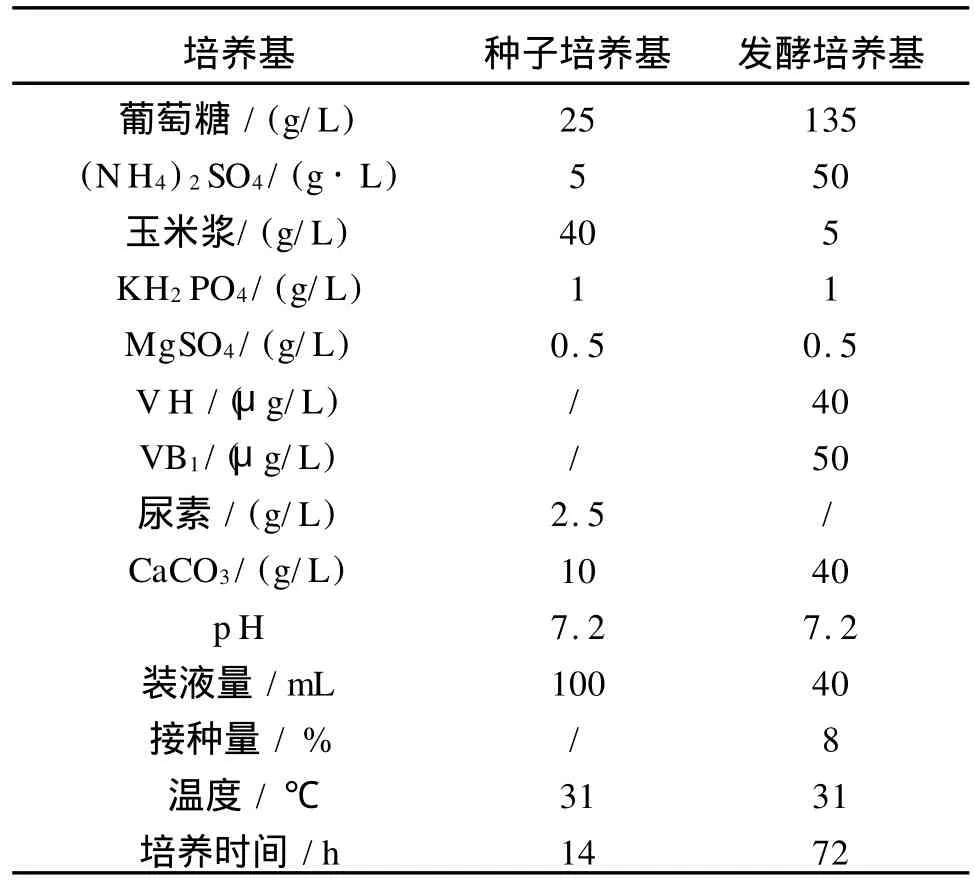
表1 L-缬氨酸摇瓶发酵的最佳条件Tab.1 Optimal fermentation condition for L-valine production
2.2.3 XQ-8菌株L-缬氨酸发酵进程曲线 图6为-缬氨酸高产菌XQ-8的典型发酵过程曲线。图6中,0~12 h为菌体生长延滞期,此时菌体耗糖速率较慢,主要用于长菌,基本不产酸;13~36 h为菌体生长对数期,此时生长速率达到并保持最大,耗糖速率明显加快,并开始产酸;37~64 h进入菌体稳态生长期,此间耗糖速率较快,L-缬氨酸大量合成;65~72 h为衰亡期,此间耗糖速率减慢,直到发酵结束。

图6 L-缬氨酸发酵过程曲线Fig.6 Time-course of L-valine production
3 结 语
L-缬氨酸与L-亮氨酸和L-异亮氨酸的生物合成途径是相关的,这3种氨基酸的生物合成,存在着共同的酶,因此代谢调节机制较为复杂。在合成途径中存在:(1)缬氨酸对α-乙酰羟基酸合成酶(AS)有抑制作用;(2)缬氨酸、异亮氨酸和亮氨酸对α-乙酰羟基酸合成酶(AS)有多价阻遏作用。
L-缬氨酸生物合成的限速酶为α-乙酰羟基酸合成酶(AS)。因此,如果要在培养基中积累大量L-缬氨酸,就必须解除正常的反馈调节,即解除L-缬氨酸对α-乙酰羟基酸合成酶(AS)的反馈抑制及L-异亮氨酸、L-缬氨酸和L-亮氨酸对α-乙酰羟基酸合成酶(AS)的多价阻遏。α-AB为L-缬氨酸的结构类似物,其高浓度抗性突变株可解除了L-缬氨酸对α-乙酰羟基酸合成酶(AS)的反馈抑制;2-TA为L-缬氨酸和L-亮氨酸的结构类似物,其高浓度抗性突变株也同样可解除了L-缬氨酸和L-亮氨酸对α-乙酰羟基酸合成酶(AS)的多价阻遏,使得AS的酶活极大幅度地提高,其结果在培养基中积累大量L-缬氨酸;AHV为苏氨酸的结构类似物,其抗性突变株为何能提高L-缬氨酸的积累?其机制尚没有解明,是否存在A HV抗性可解除异亮氨酸对AS的多价反馈调节,这一点值得进一步探讨。
(References):
[1]木下祝郎.L-缬氨酸菌种的选育[M].新版发酵工业,1974,(1):5.
[2]张克旭.氨基酸发酵工艺学[M].北京:中国轻工业出版社,1992,678.
[3]冯容保.氨基酸的工业生产[J].发酵科技通讯,2000,29:1.FENG Rong-bao.Industry production of amino acid[J].Fa Jiao Keji Tongxun,2000,29:1.(in Chinese)
[4]中国科学院微生物研究所氨基酸组.L-缬氨酸产生菌AS1.586的选育.微生物学报,1975,15(4):325~330.
Institute of Microbiology of CAS.Breeding of L-valine producer AS1.586[J].Acta Microbiol Sin.1975,15(4):325~330.(in Chinese)
[5]王秀岭,屈明波,黄和容.多重抗性突变株L-缬氨酸发酵[J].微生物学通报,1990,17(5):276~279.
WANG Xiu-ling,QU Ming-bo,HUANG He-rong.A multi-resistances mutant for L-valine producer[J].Microbiology.1990,17(5):276~279.(in Chinese)
[6]张伟国,钱和.L-缬氨酸菌种的选育[J].无锡轻工业大学学报,1995,(3):221-224.
ZHANGWei-guo,Q IAN He.Breeding of L-valine producer[J].Journal of Wuxi University of L ight Industry,1995,(3):221-224.(in Chinese)
[7]浦军平,肖泉,林学军.一次性高搪发酵L-缬氨酸菌种选育及发酵条件[J].大连轻工业学院学报,2001,20(4):264-267.
PU Jun-ping,XIAO Quan,L IN Xue-jun.Selective breeding process and fermenting condition of L-valine in highglucoside[J].Journal of Dalian Institute of Light Industry,2001,20(4):264-267.(in Chinese)
[8]张伟国,钱和.L-缬氨酸高产菌选育及营养需求研究[J].沈阳药科大学学报,2001,18(6):443-446.
ZHANG Wei-guo,Q IAN He.Study on the breeding of L-valine hyper-producer and its requirement for nutrients[J].Journal of Shenyang Pharmaceutical University.2001,18(6):443-446.(in Chinese)
[9]赵丽丽,张蓓,陈宁等.L-缬氨酸补料分批发酵的研究[J].南开大学学报:自然科学,2002,35(4):106-110.
ZHAO Li-li,ZHANG Pei,CHEN Ning.Studieson the feed batch fermentation of L-valine[J].Acta Scientiarum Naturalium University Nankaiensis.2002,35(4):106-110.(in Chinese)
[10]徐庆阳,刘树海,陈宁.L-缬氨酸的发酵工艺研究[J].生物技术通讯,2006,17(3):381-386.
XU Qing-yang,LIU Shu-li,CHEN Ning.Study on the fermentation process of L-valine produced by brevibacterium flavum[J].Letters in Biotechnology.2006,17(3):381-386.(in Chinese)
[11]章名春.工业微生物诱变育种[M],北京:科学出版社,1984
[12]潘家秀.蛋白质化学研究技术[M],北京:科学出版社,1962
Studies on the Breeding of L-Valine Hyper-Producing M utan t
ZHANGWei-guo1,2, Q IAN He3
(1.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi214122,China;2.School of Biotechnology,Jiangnan University,Wuxi214122,China;3.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
U singB revibacterium flavumXQ-2(Leul(-ABrA HVr2-TAr)as a starting strain for stepwise mutagenesis by diethylsulfate (DES),N-methyl-N’-nitro-soguanidine (N TG)treatment,a L-valine hyper-producing mutant XQ-8(Leul(-ABhr2-TAhrAHVhr)was obtained,w hich could be resistant to high concentrationα-amino-butyric acid(α-AB),2-thiazole-DL-alanaine(2-TA)andα-amino-β-hydroxy-valeric acid(AHV).A s a result,high L-valine concentration(64~66g/L)was obtained with shaking at 31±1℃for 72h in the medium containing 135g/L glucose and 50g/L(NH4)2SO4.
L-valine,breeding,brevibacterium flavum
TQ 922
A
1673-1689(2011)03-0394-04
2010-05-25
国家863计划项目(2008AA 02Z212)。
张伟国 (1963-),男,江苏张家港人,工学博士,教授,博士研究生导师,主要从事氨基酸生产菌选育和发酵工艺控制研究。Email:zhangw g168@126.com

