雌牙鲆CYP19A基因启动子“Cp G”岛区的单核苷酸多态性及与繁殖性能的关联分析*
何 峰,马瑞芹,赵 旭,张 宇,于锦涛,温海深,李吉方
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
雌牙鲆CYP19A基因启动子“Cp G”岛区的单核苷酸多态性及与繁殖性能的关联分析*
何 峰,马瑞芹,赵 旭,张 宇,于锦涛,温海深,李吉方
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
芳香化酶基因(CYP19)编码的芳香化酶是雄激素转化为雌激素的关键酶,在鱼类性腺发育及繁殖内分泌过程中起着重要的作用。本研究采用聚合酶链式反应-单链构象多态(PCR-SSCP)和放射性免疫方法(RA I)对61尾雌牙鲆进行了CYP19A基因启动子Cp G岛区多态性检测,并将其与繁殖性能进行了关联分析。Cp G岛区存在3种类型的基因型(pattern1、pattern2、pattern3),经测序发现Cp G岛区有以下突变:T-1927插入或缺失、C-1899插入或缺失、T-1772C、C-1766T、TGTCAAC-1752~-1744插入或缺失(11个SNPs连锁突变)。方差分析结果表明:此位点对雌二醇(E2)水平的效应达到显著(P<0.05)水平,经多重比较分析,具有pattern1基因型的个体的雌激素(E2)水平显著低于pattern2和pattern3基因型个体的雌激素水平(P<0.05),同时pattern1基因型的个体的m RNA表达量显著低于pattern2和pattern3基因型个体的m RNA表达量(P<0.05)。以上结果表明,CYP19A基因调控区甲基化位点突变可能导致芳香化酶的表达量,进而影响牙鲆繁殖内分泌过程;同时也阐明了这些与牙鲆繁殖性状相关的SNPs可以用于生产实践中进行标记辅助选择具有优良繁殖性能的牙鲆。
牙鲆;CYP19A基因;SNPs;繁殖性能
牙鲆(Paralichthys olivaceus)主要分布于中国、朝鲜半岛、日本和俄罗斯远东沿岸海区,是中国、日本的名贵海产鱼类之一。它肉质细嫩鲜美,营养丰富,深受消费者喜爱,是我国北部海区最早开发的海水养殖鱼类。牙鲆属于雄性异型染色体(XY)类型[1],遗传雌性鱼(XX)很容易在环境因子(特别是高温>27℃)诱导下转变为生理雄性个体,并且牙鲆遗传背景比较清晰[2-4]),是研究鱼类繁殖和性分化的优秀模型动物。
芳香化酶基因(CYP19A)是细胞色素P450基因家族重要的的一员,编码芳香化酶(A romatase,P450arom),其功能是催化雄激素转化为雌激素,控制着性激素的相对比率,对于硬骨鱼类卵巢的成熟和雌性的繁殖性能有决定性作用[5]。Kitano等[2-3]详细研究了牙鲆P450芳香化酶基因的表达及作用,P450芳香化酶(CYP19A)在牙鲆性分化过程中起着重要的角色;Toshiya[4]报道了FoxL 2基因与CYP19A基因在不同温度下,CYP19A基因的表达发生变化,而引起性别的转化。因此,P450芳香化酶基因可作为牙鲆繁殖性能的重要功能候选基因。
单核苷酸多态性(Single nucleo tide po lymo rphism s,SNP)即单个碱基突变(包括缺失、插入及替换),它可能对基因的表达和蛋白质的功能具有重要的影响。CYP19A基因调控区甲基化位点可控制CYP19A基因的表达,将会影响性类固醇激素的合成。先前,作者已经对牙鲆CYP19A基因编码区[6](Gen-Bank Accession No.AB017182)和部分调控区序列[7](GenBank Accession No.AB303853)(-720bp~-34bp)进行单核苷酸多态性(Single Nucleotide Polymorphism,SNP)检测并进行关联分析。然而,对新克隆获得的CYP19A基因调控区(GenBank Accession No.AB304921)(-2242bp~-721bp)的SNP检测未见报道,并且此区域存在1个Cp G岛区(-1969bp~-1689bp),Cp G岛区含有一些转录调控因子。
因此,本研究以61尾牙鲆为试验材料,采用PCRSSCP(Single Strand Conformation Polymo rphism)技术对CYP19A基因中的Cp G岛区序列(-1969~-1689bp)进行SNP检测,并与其性激素水平进行关联分析,旨在从分子水平上揭示CYP19A基因Cp G岛区突变与繁殖性能之间是否存在紧密连锁,从而为牙鲆繁殖性能的标记辅助选择研究提供理论基础。
1 材料和方法
1.1 试验动物
从青岛市郊区养殖场,选择同一批次的61尾牙鲆((239.23±74.93)g)[7](均健康),在实验室水族箱里暂养2~3 d,流水充氧,满足自然光照,自然水温。性腺取出后,一部分组织迅速用Bouin氏液固定用于组织学研究,另一部分存放在-80℃用于RT-PCR半定量表达和基因组DNA的提取。
1.2 繁殖性能的测定
1.2.1 放射免疫测定(RIA)方法测定血浆性激素含量
根据温海深[8]等激素测定方法,采用I125标记的放射免疫分析法测定(RIA)方法测定雌鱼血浆中睾酮(T)和雌二醇(E2)含量。
1.2.2 性腺指数和肝重指数 生物学指标包括体长,体质量,性腺质量,去内脏质量。计算性腺成熟系数:(GSI)=[GW/(BW-VW)]×100,肝质量指数HSI=[LW/(BW-VW)]×100。(BL:体长;BW:体质量,LW:肝质量;GW性腺质量;BW-VW:去内脏质量;GSI:性腺指数;HSI:肝脏指数)
1.3 主要试剂
所有试剂有RNA iso Reagent(Ta KaRa公司)、RNA酶抑制剂(TaKaRa公司)、M-MLV逆转录酶(Promega公司)、Taq酶(TaKaRa公司)、dN TPs和PCR产物回收试剂盒等从北京天根公司购买,克隆子测序由华大基因公司完成。
1.4 引物设计
根据Genbank公布的牙鲆CYP19A基因调控区序列(No.AB304921),利用http://www.urogene.org/methp rimer/来预测Cp G岛,利用Oligo6.0软件对Cp G岛区域设计特异性引物序列上游引物序列:5-GCTGCTCA GGAAA TTCCCAGA T-3,下有引物序列:5-GGGAACA TTCCACAAGCGTCTT-3,片段长度为280 bp。半定量RT-PCR上游引物为:5-TGTGAGA TTCA TCTGGACGGGT-3,下有引物为:5-A TACA TGCCGA TGCAGCTCAGT-3。18 s内参上游引物为:5-CCTGAGAAACGGCTACCACA TC-3,下游引物为:5-CCAA TTACAGGGCCTCGAAAG-3。所有引物均由上海生物工程技术服务有限公司合成。
1.5 PCR-SSCP检测和RT-PCR半定量
1.5.1 PCR-SSCP检测 PCR扩增反应体系为25 μL:ddH2O 17.5μL,10×PCR buffer 2.5μL,10 pmol/L上下游引物各0.5μL,10μmol/L dNTPs2.0μL,Taq酶10U,50 ng/μL DNA模板1μL。PCR反应程序为94℃5 min;94℃35 s,61℃35 s(引物1)或者63℃35 s(引物2),72℃35 s,35个循环;72℃延伸10 min;4℃保温。PCR产物在2%琼脂糖凝胶中电泳。
取CYP19A基因的PCR产物2与8μL上样缓冲液(98%的甲酰胺,0.025%的溴酚蓝,0.025%的二甲苯青,10 m M EDTA(p H=8.0),2%甘油)混合,98℃变性10 m in,迅速插入碎冰中至少5 m in,然后加样于8%非变性聚丙烯酰胺凝胶中,电泳条件为20℃、120 V过夜。电泳结束后,取胶切去加样孔的毛刺进行银染。先用超纯水将凝胶洗1次,然后用硝酸银溶液染色30~35 m in;倒掉染色液,并用超纯水洗2次;加入显色液,直至出现清晰的条带。
1.5.2 RT-PCR半定量 牙鲆卵巢组织总RNA提取按照Trizol试剂盒说明书进行。然后利用Oligo d T18来合成cDNA第一链,再用筛选好的特异性引物进行RT-PCR半定量。
1.6 序列分析
PCR产物经SSCP分型后,分别取3种不同基因型的PCR产物用DNA回收试剂盒回收纯化。然后,把回收片段连接到p GEM-T Easy载体上,转化到DH5α大肠杆菌中,用菌液PCR进行片段大小的初步验证。对每1种基因型的个体挑取独立的单个克隆子进行双向测序,对各种基因型进行测序验证。
1.7 统计方法
数据利用SAS(8.02)软件进行方差分析和邓肯氏多重比较,分析CYP19A基因型效应对牙鲆繁殖性能的影响,由于这些雌牙鲆是在同一饲养管理条件下,所以统计分析时不考虑场年季效应和性别效应。
2 结果
2.1 PCR扩增和PCR-SSCP结果
对61尾牙鲆CYP19A基因的PCR扩增产物无杂带,只有特异条带,直接用于SSCP分析。图1为CYP19A基因的1对引物的PCR扩增产物的SSCP结果。检测到3种基因型,分别命名为pattern1(泳道1、2、3、5、7、8、10和11)、pattern2(泳道4和泳道9)、pattern3(泳道6)。

图1 CYP19A基因调控区SNP的SSCP电泳图Fig.1 SSCP electropho resis result of SNP in CYP19A gene p romo ter
2.2 SNPs测序分析
对SNP的不同基因型纯合子的PCR产物进行回收,同时采用克隆测序和PCR产物直接测序方法对其进行测序,二者结果一致。克隆测序采用3次重复测序得到同样的结果,加以验证,测序图见图2。
将本研究得到的序列与GenBank公布的序列GenBank Accession No.AB304921相比较,突变位置和性质分别为:T-1927插入或缺失、C-1899插入或缺失、T-1772C、C-1766T、TGTCAAC-1752~-1744插入或缺失,可知11个SNPs紧密连锁。
2.3 启动子突变位点转录因子和甲基化位点的变化
本研究采用网站(http://www.cbrc.jp/research/db/TFSEARCH.htm l)的TFSEARCH(version 1.3)软件分析预测CYP19A基因5’非编码序列的11个SNPs是否引起潜在的调控元件及蛋白结合位点改变的预测,结果如下(预测分值大于90有效)(见图2)。比较预测结果发现pattern1基因型个体5’侧翼调控序列中增加1个Cp G甲基化位点和TGTCAAC序列,增加了2个转录因子CREB和c-Myb;pattern2基因型个体5’侧翼调控序列中增加1个Cp G甲基化位点;pattern3基因型个体5’侧翼调控序列中减少1个CpG甲基化位点,同时减少1个CREB转录因子,在-1752~-1744处删除TGTCAAC序列,也减少1个转录因子c-Myb。

图2 突变位点测序图和转录因子的预测Fig.2 Sequencing of mutation site and prediction fo r transcrip t facto rs of 5′-untranscrip t domain of CYP19A gene
2.4 RT-PCR半定量表达分析
在3种基因型群体中,根据每种基因型各随机选择4个样本的卵巢,半定量RT-PCR检测,电泳结果采用Tanon GIS凝胶图像处理系统进行分析。将CYP19A基因型m RNA的表达量和18s的表达量比值作为CYP19A基因mRNA相对表达量。结果pattern1基因型mRNA相对表达量显著低于其它两种基因型,pattern3基因型m RNA相对表达量最高(见图3)。
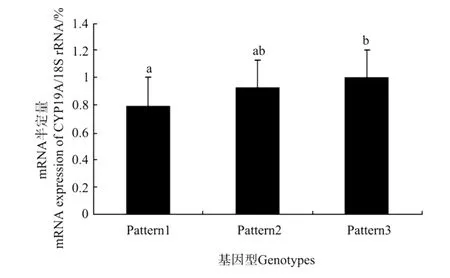
图3 牙鲆CYP19A基因在卵巢中的相对表达量Fig.3 Relative expression level of CYP19A gene in ovary
2.5 基因型频率分析
从表1可以看出,pattern3基因型频率占绝对优势,高达78.7%,而这pattern1和pattern2基因型频率相对较低,分别为11.5%、9.8%。

表1 CYP19A基因突变位点基因型频率Table 1 Genotypes frequencies of mutation site of CYP19A gene
2.6 SNP和3种基因型与激素水平的关联分析
此位点与4个繁殖性能之间的关联分析果见表2。

表2 SNPs与繁殖性能的关联分析结果Table 2 Association between two SNPs and reproductive perfo rmance
关联分析结果表明(见表2):此位点对雌激素(E2)水平的效应达到显著效应(P<0.05),其余3个性状无显著相关。
3种基因型间各性状的均值的多重比较结果表明(见表3):pattern1基因型个体的雌激素含量显著低于pattern2和pattern3基因型个体(P<0.05),pattern2和pattern3基因型个体之间的雌激素含量无显著差异(P>0.05)。

表3 CYP19A基因不同基因型的繁殖性能的关联分析Table 3 Association between reproductive performance and different genotypes of CYP19A gene
3 讨论与结论
动物机体内存在着各种各样的对基因转录表达的调解机制,其中DNA甲基化是对生物体内的众多基因有调控作用的机制之一,DNA甲基化位于转录调控区或附近。本研究在预测的CYP19A基因调控区Cp G岛上设计了1对引物,经PCR-SSCP和测序表明该区域具有较丰富的多态,共检测到11个SNPs。
鱼类CYP19A基因主要在性腺组织中表达,CYP19A基因调控区存在大量的转录因子结合位点,Tchoudakova[9]报道了金鱼3个CYP19A基因调控区差异在9%~15%区间内,这说明金鱼可能有3个CYP19A基因调控区序列。Galay-Burgos[10](2006)克隆了狼鲈(Sea Bass)CYP19A基因调控区,3尾鱼的cDNA序列进行比较,发现了3个SNPs,其调控区序列有多个转录因子结合位点:SF-1、FoxL 2和Sox等。因此如果CYP19A基因调控区突变可影响CYP19A基因的表达,这将会可能调控胆固醇新陈代谢,影响性类固醇激素的合成。在鱼类方面,文献[6-7]已经以牙鲆CYP19A基因为候选基因,报道了外显子7和部分调控区突变可能与繁殖性状有关。然而,在本研究中,作者新发现的突变位点与雌激素浓度呈显著相关水平(P<0.05),并且此突变导致甲基化位点发生改变,这暗示了此位点可能影响雌激素的合成,但是此位点的遗传效应还需在大群体中进一步验证。
牙鲆P450芳香化酶调控区上有多个转录因子结合位点,且影响CYP19A基因m RNA表达[4]。本研究利用网站http://www.cbrc.jp/research/db/TFSEARCH.htm l TFSEARCH(ver 1.3)软件分析CYP19A基因5’侧翼调控区甲基化序列,预测结果发现在pattern1基因型个体5’侧翼调控序列中增加了2个转录因子CREB和c-Myb(见图3),预测的sco re值均高于90。一般认为预测score值为85以上表示预测结果比较可信。因此本文的预测结果可信度较大,但是需要进一步的实验证明。转录因子CREB是cAM P应答元件结合蛋白质,被磷酸化后结合于许多基因调控区中的cAM P应答元件(CRE),以激活靶基因的表达[11-12]。c-Myb是癌症基因的转录调控因子,是家禽白血病病毒逆转录酶V-Myb的变种,它在未成熟细胞分化过程中起着重要的调控作用[13]。在本实验结果中发现突变位点pattern1对雌激素性状的效应达到显著(P<0.05)水平。因此,本文认为CREB和c-Myb可能对CYP19A基因的表达有调控作用,从而影响CYP19A基因以及牙鲆繁殖内分泌的功能;但需要用凝胶阻滞实验来验证突变点是否能和转录因子CREB和c-Myb结合以及后续的验证工作。
一般认为DNA甲基化与基因表达呈负相关,启动子区低甲基化可以促进转录活性的增加,而基因本身的甲基化水平增加也可以降低基因的表达水平。Timme-Laragy[14]分析了大西洋锵(Atlantic killifish)CYP1A调控区甲基化;Contractor[15]对日本青鳉(Oryzias latipes)P450芳香化酶基因家族调控区甲基化与抗病有关。牛CYP19基因外显子3有1个共同的甲基化位点[16],这个甲基化位点在表观调控下影响牛的CYP19基因表达[16]。这些研究表明DNA甲基化在CYP19基因表达过程中起着重要的调控作用。本研究中,预测的Cp G岛区域含有8个甲基化位点,在CYP19基因调控区上-1766bp处由“T”向“G”转换,产生1个新的甲基化位点,并增加1个转录因子CREB。而且有趣的是,从3种类型的基因型来看,pattern2和pattern3基因型中在-1752~-1744处缺少TGTCAAC,pattern1和pattern2基因型中在-1766处一个甲基化位点。从方差分析结果看,pattern3基因型个体的E2含量显著高于pattern1基因型个体,pattern3中没有Cp G岛和TGTCAAC序列,并且从RT-PCR半定量分析,pattern3基因型个体m RNA表达显著高于pattern1个体的,所以作者推断CYP19A基因启动子区低甲基化可以促进转录活性的增加,提高芳香化酶的活性,将大量睾酮催化生成雌二醇,雌激素进而影响牙鲆繁殖发育内分泌过程。
本研究在280bp的片段中发现11个SNPs紧密连锁,分布在3种基因型中(pattern1、pattern2和pattern3)。Power认为利用几个SNPs构建二倍型(diplotype)进行关联分析可以弥补单个SNP提供信息量不足的缺点,不考虑群体遗传学因素,二倍体型具有降低在相关性分析时更多问题的出现,提高相关性分析的效力[17]。因此,作者将3种基因型可看作为3个二倍型,其中有的二倍型(pattern3基因型)个体的雌激素浓度明显高于其他个体,但是由于该二倍型组合的牙鲆个体较少,数据较少,缺乏一定的说服力,还有待于在大群体中进一步验证其对雌激素浓度的影响效应。
总之,在CYP19A基因调控区甲基化区域检测到了11个SNPs,其中pattern3基因型(T-1766G和-1752~-1744TGTCAAC)对雌激素浓度的效应呈显著(P<0.05)水平,m RNA相对表达量也呈显著(P<0.05)高于含有甲基化位点的个体。以上结果表明,作者推断CYP19A基因可能是影响牙鲆繁殖内分泌的主效基因或与控制这些性状的主效基因连锁,可以作为牙鲆繁殖性能的候选基因。
[1] Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthysolivaceus(Temminck et Schlegel)[J].Aquaculture,1999,173:235-246.
[2] Kitano T,Takamune K,Kobayashi T,et al.Suppression of P450 aromatase gene expression in sex-reversed males produced by rearing genetically female larvae at a high water temperature during a period of sex differentiation in the Japanese flounder(Paralichthys olivaceus)[J].JMol Endocrinol,1999,23:167-176.
[3] Kitano T,Takamune K,NagahaM y,et al.Aromatase inhibitor and 17-alpha-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder(Paralichthys olivaceus)[J].Mol Reprod Dev,2000,56:1-5.
[4] Toshiya Y,Sakiko Y,Toshiaki H,et al.Follicle-stimulating hormone signaling and Foxl2 are involved in transcriptional regulation of aromatase gene during gonadal sex differentiation in Japanese flounder,Paralichthysolivaceus[J].Bioc and Bioph Res Commu,2007,359:935-940.
[5] Guiguen Y,Baroiller J F,Ricordel M J,et al.Involvement of estrogens in the process of sex differentiation in two fish species:the rainbow trout(Oncorhynchus Mykiss)and a tilapia(Oreochromis niloticus)[J].Mol Reprod Dev,1999,54(2):154-62.
[6] He F,Wen H S,Dong SL,et al.Identification of Single Nucleotide Polymorphism Cytochrome P450-c19a and its Relation to Reproductive Traits in Japanese flounder(Paralichthys olivaceus)[J].Aquaculture,2008,279:177-181.
[7] He F,Wen H S,Dong SL,et al.Identification of a single nucleotide polymorphism within promoter of Japanese flounder(Paralichthys olivaceus)ovary cytochrome P450-c19(CYP19A)and its effect on reproductive traits[J].Fish Physiol and Bioch,2009,35:333-340.
[8] 温海深,宋海霞,杨立廷.外源激素对养殖牙鲆血浆睾酮和雌二醇含量的影响研究[J].海洋学报:中文版,2006,28(4):115-120.
[9] Tchoudakova A,Kishida M,Wood E,et al.Promoter characteristics of two cyp19 genes differentially expressed in the brain and ovary of teleost fish[J].J Steroid Biochem Mol Biol,2001,78(5):427-39.
[10] Galay-Burgos M,Gealy C,Navarro-Martn L,et al.Cloning of the promoter from the gonadal aromatase gene of the European sea bass and identification of single nucleotide polymorphisms[J].Com Biochem Physio,Part A,2006,145:47-53.
[11] Fung H,Liu P F,Demple B.ATF4-dependent oxidative induction of the DNA repair enzyme Ape1 counteracts arsenite cytotoxicity and suppresses arsenite-mediated mutagenesis[J].Mol Cell Biol,2007,27:8834-8847.
[12] Shaulian E,Karin M.AP-1 in cell proliferation and survival[J].Oncogene,2001,20:2390-2400.
[13] Ramsay R G,Gonda T J.MyB function in normal and cancer cells[J].Nat Rev Cancer,2008,8(7):523-34.
[14] Timme-Laragy A R,Meyer JN,Waterland R A,et al.Analysis of Cp Gmethylation in the killifish CYP1A promoter[J].Comp Biochem and Physio,Part C,2005,141:406-411.
[15] Contractor R G,Foran CM,Li S,et al.Evidence of gender-and tissue-specific promoter methylation and the potential for ethinylestradiol-induced changes in Japanese medaka(Oryzias latipes)estrogen receptor and aromatase genes[J].J Toxicol Environ Health A,2004,67(1):1-22.
[16] Vanselow J,Pohland R,Furbass R.Promoter-2-derived CYP19 expression in bovine granulose cells coincided with gene-specific DNA hypo-methylation[J].Mol Cell Endocrinol,2005,233:57-64.
[17] Clark A G.The role of hap lotypes in candidate gene studies[J].Genet Epidem,2004,27:321-333.
Polymo rphisms in Cp G Island Region of CYP19A Gene Promoter Associated with Reproductive Performance in Japanese Flounder(Paralichthys olivaceus)
HE Feng,M A Rui-Qin,ZHAO Xu,ZHANG Yu,YU Jin-Tao,W EN Hai-Shen,L IJi-Fang
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
Cytochrome P450arom,encoded by the CYP19 gene,is an important component of the enzymatic aromatase comp lex converting androgens to estrogens,which has been shown to play key role in ovarian development and reproductive endocrinology in fish.In this study,single nucleotide polymorphisms(SNPs)within CpGisland region of the CYP19A gene promoter were tested and the associations between their genotypes and four reproductive traits were analyzed in 61 Japanese flounder individuals with polymerase chain reaction and single-stranded conformational polymorphism(PCR-SSCP).Results indicated that three patterns in the promoter of CYP19A gene were identified,which were T-1927 insertion or deletion,C-1899 insertion or deletion,T-1772C,C-1766T,TGTCAAC-1752~-1744 insertion or deletion(11 SNPs linkaged)by sequencing.Statistic results showed that the pair of p rimer was significantly associated with 17β-estradiol(E2)(P<0.05).Individuals with genotype pattern1 had significantly lower serum E2levels(P<0.05)than those of genotype pattern2 or pattern3.In addition,m RNA expression of CYP19A gene in pattern1 was significantly low er than those of pattern1 and pattern3.The evidence of the associations between genetic variants with serum E2levelmay help exp lain that mutation in methylation site of CYP19A gene could change aromatase expression and further affect reproductive endocrinology of Japanese flounder.At the same time,these results imp lied that those SNP smight be used as molecular marker selection for Japanese flounder with super reproductive performance.
Japanese flounder;CYP19A gene;SNPs;reproductive performance
S917
A
1672-5174(2011)09-019-06
教育部博士点新教师基金项目(20090132120006);国家大学生创新性实验项目(091042331);山东省自然科学基金项目(ZR2009DQ011);山东省博士后创新基金项目(200702039)资助
2010-10-27;
2011-03-20
何 峰(1974-),男,博士,讲师,研究方向:鱼类分子生理与分子数量遗传。E-mail:hefengouc@ouc.edu.cn
责任编辑 王 莉

