运动性免疫抑制中胸腺IL-7和TGF-β1应答性特征
张琳,郝选明
(华南师范大学,广东 广州 510006)
运动性免疫抑制中胸腺IL-7和TGF-β1应答性特征
张琳,郝选明
(华南师范大学,广东 广州 510006)
通过胸腺细胞因子IL-7和TGF-β1及其mRNA进行研究,探讨运动性免疫抑制发生发展过程中胸腺细胞发育的调节机制。将128只8周龄雄性SD大鼠随机分为运动组和对照组,运动组进行递增负荷跑台训练6周,每周6次,周日休息,每次30 min。第1周负荷为10 m·min-1,第2周负荷为20 m·min-1,此后每周增加5 m·min-1,至6周时达40 m·min-1。分别于第0、2、4、6周利用ELISA和FQ-RT-PCR技术测相对安静状态、运动后即刻和运动后3 h IL-7和TGF-β1及其mRNA的表达水平。结果显示:6周递增负荷跑台运动过程中,IL-7和TGF-β1呈现几乎相反的应答性变化:IL-7及mRNA第0周、第2周末运动后明显降低,恢复3 h后升高,呈“V”型应答曲线;第4周末,运动前后没有显著性变化;第6周末,在运动后持续下降。TGF-β1在各周呈现倒“V”型变化,TGF-β1 mRNA对负荷初次应答时运动前后没有明显变化,其它各周呈倒“V”型变化。以上结果说明运动性免疫抑制发生发展中胸腺IL-7下降和TGF-β1升高可能导致胸腺微环境紊乱,从而影响胸腺细胞发育。
运动生物化学;运动性免疫抑制;白介素-7;转化生长因子-β;胸腺;应答性特征
T细胞在胸腺内的发育分化是细胞免疫应答所必需的重要过程。胸腺细胞分化是一个受严格调控的过程,不仅依赖于早期T细胞前体与基质细胞的相互作用,而且细胞间的相互作用以及细胞因子在胸腺细胞分化过程中也发挥关键作用。白介素-7(interleukin-7,IL-7)和转化生长因子-β1 (transforming growth factor beta 1,TGF-β1)是具有生长因子样作用的细胞因子,具有调控多种免疫应答的作用[1-2]。IL-7促进早期胸腺细胞的分化和增殖,在胸腺细胞发育中起正性调节作用[3]。TGF-β超家族对T细胞的发育具有负调控作用,抑制早期胸腺细胞的增殖分化[4]。因此,本研究通过观察SD大鼠6周递增运动负荷后,胸腺组织中的生长因子IL-7、TGF-β1的应答性变化,探讨长期运动对胸腺细胞发育调节机制,为运动性免疫抑制的调控提供依据。
1 材料与方法
1.1 实验动物
8周龄雄性SD大鼠128只(购自广东中医药大学实验动物中心,许可证号:SCXK(粤)2008-0020;NO:0043379,粤监证字F2008A002),随机分为实验组和对照组。实验组96只进行6周递增强度训练,对照组32只,正常喂养,不进行运动干预,分别于第0、2、4、6周末采样,用于判别大鼠生长对测试指标的影响。结果发现,对照组各指标各周之间没有显著性差异(P>0.05),表明6周生长对这些指标没有显著影响。
1.2 运动模型
采用我们通过反复实验性探索获得的运动性免疫抑制的动物模型[5-7]。运动性免疫抑制的建立条件是:模拟运动训练安排,长时间、大强度且负荷递增。因此,采用低强度适应性运动(10 m/min)训练1周后,负荷递增至20 m/min。随后,每周递增负荷增量5 m/min。至第6周,达到40 m/min,基本达到大鼠最大负荷强度。分别在第0、2、4、6周最后一次运动后48 h采样。采样日进行与上周相同负荷的跑台运动,分别在安静状态(A)、运动后即刻(J)和运动后3 h(3 h)无菌取胸腺。
1.3 测试指标及方法
ELISA和实时荧光定量RT-PCR分别测定生长因子IL-7、TGF-β1及mRNA表达水平。ELISA试剂购自武汉华美公司,RNAiso Plus 和SYBR Green I Real time PCR反应试剂购自(TaKaRa)大连宝生物公司。引物由上海生工生物工程技术服务有限公司合成,序列如下:
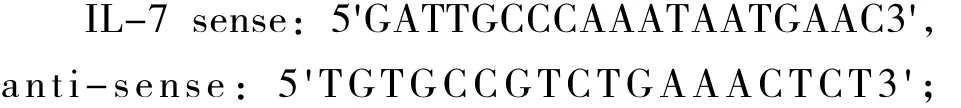

1.4 数据的统计学处理
2 结果与分析
2.1 各周运动负荷及恢复过程中IL-7及mRNA的变化
图1显示,第0周J组大鼠胸腺组织IL-7及mRNA表达与A组相比下降(P<0.05),运动后3 h组恢复,与A组比较,无显著性意义(P>0.05)。J组和3 h组在第2、4和6周IL-7质量分数和IL-7 mRNA表达均低于A组(P<0.05或P<0.01)。在第2、4周J组与A组比较均显著性下降(P<0.01),3 h组与J组比较上升,但低于A组(P<0.01)。在第6周J组低于A组,且3 h组与J组相比差异无显著性(P>0.05)。
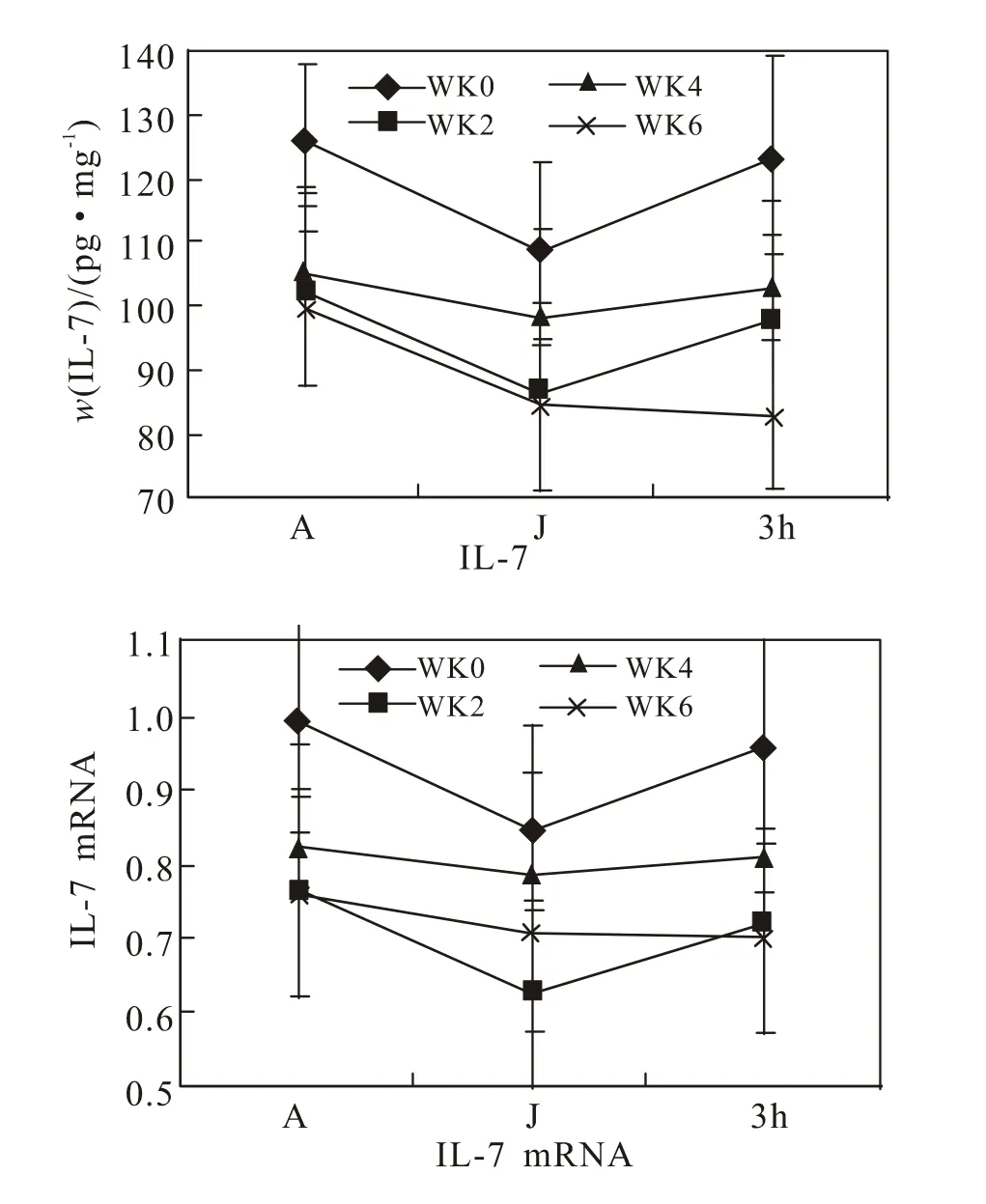
图1 胸腺IL-7及mRNA各周应答性变化情况
2.2 各周运动负荷及恢复过程中TGF-β1及mRNA的变化
图2显示,第0周J组大鼠胸腺组织TGF-β1表达水平与A组相比上升(P<0.01),运动后3 h组略高于对照组。第 0周各组 mRNA表达无显著性变化(P>0.05)。J组、3 h组在第2、4和6周TGF-β1质量分数均高于A组(P<0.05或P<0.01)。在第2周和第4周J组与A组比较均显著性上升(P<0.01),3 h组与J组比较下降(P<0.01),但均高于A组(P<0.01)。在第6周J组、3 h组均高于A组,其中TGF-β1质量分数差异无显著性(P>0.05),TGF-β1mRNA差异显著(P<0.01),J组、3 h组两组间差异有非常显著性(P<0.01)。

图2 胸腺TGF-β1及mRNA各周应答性变化情况
3 讨论
3.1 运动性免疫抑制发展中胸腺IL-7的应答及调控机制
为探讨运动性免疫过程中胸腺细胞的调控机制,我们研究了递增负荷运动过程中胸腺组织 IL-7及其mRNA的表达变化。从实验结果来看,IL-7及 mRNA在胸腺组织中表达,且表达量随运动负荷的增加和时间的延长出现应答性的波动:IL-7及mRNA第0、2周末运动后明显降低,恢复3 h后升高,呈“V”型应答曲线;第4周末,运动前后没有显著性变化;第6周末,则在运动后持续下降。总之,IL-7在第4周时虽然没有继续下降,但表现出随着运动负荷的增加而逐渐下降,出现下调趋势。
IL-7表达下调影响了IL-7对细胞生长信号需求的应答能力,而使机体无法充分利用IL-7的生长调控信号,进而导致进行性胸腺细胞发育异常以及随后的成熟淋巴细胞的失调控。其可能的机制是:首先,IL-7是胸腺双阴性(double-negative,DN)祖细胞发育的重要信号,IL-7的下调直接影响 DN及下游双阳性(double-positive,DP)、单阳性(single-positive,SP)细胞的发育。其次,运动状态下,神经、内分泌以及内环境的改变都会对免疫系统产生不同影响,免疫抑制类调节物质如促肾上腺皮质激素释放激素、促肾上腺皮质激素、糖皮质激素等在运动刺激作用下明显增加,再加上交感神经兴奋所产生的免疫抑制效应,对免疫系统会产生强烈的抑制作用。研究表明,IL-7通过影响细胞内的生长因子水平,保护T细胞免受糖皮质激素、细胞因子下降以及辐射等诱导的细胞损伤[8]。第三,Fas介导的细胞凋亡在运动免疫抑制发展中起了重要的作用,而其中IL-7可能与这一凋亡机制有关。IL-7通过上调Bcl-2的信号传导能够加强发育中的胸腺细胞和成熟T细胞的存活[9]。因此,IL-7水平的下降,Fas等对胸腺细胞的致凋亡作用的保护能力下降是导致在运动性免疫抑制过程中T淋巴细胞发育分化异常的机制之一。
3.2 运动性免疫抑制发展中胸腺 TGF-β1应答及调控机制
TGF‐β在胸腺细胞本身和胸腺上皮细胞中都有表达,主要是作为一个免疫抑制因子,负性调节T细胞的发育。最初观察TGF-β1影响T细胞成熟的特异信号的是Plum J等[10],他报道外源性的TGF-β1剂量依赖性地抑制FTOC胸腺细胞的生长,胸腺细胞总数下降95%以上,DN、DP和CD4+SP胸腺细胞的分化也受影响,但CD8+SP不受影响。进一步对DN细胞亚群的研究表明,外源性加入 TGF-β1时 DN1亚群为81%,而未经处理时为30%,表明TGF-β1抑制DN亚群的增殖主要在DN1阶段。Takahama Y等[11]报道,TGF-β1阻止DN细胞的增殖,控制CD4 CD8low-DP细胞的转变,但诱导DN细胞表达CD8。Mossalayi MD等[12]研究表明,TGF-β1在 TN细胞表达,激活后抑制 TN的增殖,通过自分泌途径负性调节胸腺细胞成熟。也有证据表明 TGF-β影响人类胸腺上皮细胞(thymic epithelial cells,TECs):TGF-β1 调控 TECs细胞因子表达影响T细胞发育[13]。Christ M等[14]对TGF-β1缺失小鼠的研究中,观察到胸腺细胞CD4+SP增加。Boivin GP等[15]的TGF-β1缺失小鼠研究也表明,胸腺细胞中DP亚群减少,DN和CD4+SP T细胞增加,提示,TGF-β1可能促进DP细胞向CD8+SP分化,和/或抑制CD4+SP分化。
为了研究 TGF-β1在运动性免疫抑制发生发展过程中对胸腺T细胞发育的作用,我们分析了TGF-β1在递增负荷跑台训练 SD大鼠胸腺中的水平及mRNA表达的动态变化。结果显示,TGF-β1在各周运动后明显升高,恢复3 h下降,呈现倒∨型变化,TGF-β1 mRNA对负荷初次应答时运动前后没有明显变化,其它各周呈倒∨型变化。这表明运动应激诱导了TGF-β1在胸腺细胞中的变化,而且随着运动负荷的增加TGF-β1水平逐渐升高,出现上调趋势。
TGF-β1水平上升直接可能抑制胸腺细胞的发育成熟,导致胸腺细胞发育分化异常。因此可导致机体免疫功能紊乱,引起运动性免疫抑制。其可能的机制为:TGF-β1与调节DN1到DN2的过渡有关,促进DP细胞向 CD8+定型,抑制 CD4+分化。因此,TGF-β1的上调可能直接抑制了DN细胞的扩增,DP细胞的分化,引起 DN、CD8+细胞的积聚和(或)CD8+代偿性扩增,同时CD4+细胞增殖数量下降。另外,Suda T等[16]报道,TGF-β1抑制 IL-7依赖的胸腺细胞的增殖作用。提示本研究中,IL-7下调以及TGF-β1的上调可能与胸腺细胞的分化发育异常相关联,共同调控了免疫抑制的发生发展。但它们的信号通路彼此间的相互作用以及在T细胞发育中的详尽历程等都需要进一步研究证实。
[1]Schlenner S M,Madan V,Busch K,et al. Fate mapping reveals separate origins of T cells and myeloid lineages in the thymus[J]. Immunity,2010,32(3):426-436.
[2]Diener K R,Need E F,Buchanan G,et al. TGF-beta signalling and immunity in prostate tumourigenesis[J].Expert Opin Ther Targets,2010,14(2):179-192.
[3]张琳,郝选明,邓树勋,等. IL-7/IL-7在T淋巴细胞发育中的作用及对运动免疫的意义[J]. 国际免疫学杂志,2010,33(5):447-450.
[4]张琳,郝选明. TGF-β对T细胞发育分化的影响与运动性免疫抑制[J]. 中国运动医学杂志,2011,30(1):104-108.
[5]唐亮. 大鼠细胞免疫功能对六周递增负荷运动的应答性和适应性特征[D]. 广州:华南师范大学,2007.
[6]王雪芹. T细胞活性与巨噬细胞吞噬能力对长期递增负荷运动的应答和适应特征[D]. 广州:华南师范大学,2005.
[7]李杰. 大鼠脾淋巴细胞分泌IL-2和sIL-2R对长期递增负荷运动的应答和适应特征[D]. 广州:华南师范大学,2007.
[8]Hernández-Caselles T,Martínez-Esparza M,Sancho D,et al. Interleukin-7 rescues human activated T lymphocytes from apoptosis induced by glucocorticoesteroids and regulates bcl-2 and CD25 expression[J]. Hum Immunol,1995,43(3):181-189.
[9]Carini C,McLane M F,Mayer K H,et al. Dysregulation of interleukin-7 receptor may generate loss of cytotoxic T cell response in human immunodeficiency virus type 1 infection[J]. Eur J Immunol,1994,24(12):2927-2934.
[10]Plum J,De Smedt M,Leclercq G,et al. Influence of TGF-beta on murine thymocyte development in fetal thymus organ culture[J]. J Immunol,1995,154(11):5789-5798.
[11]Takahama Y,Letterio J J,Suzuki H,et al. Early progression of thymocytes along the CD4/CD8 developmental pathway is regulated by a subset of thymic epithelial cells expressing transforming growth factor beta[J]. J Exp Med,1994,179(5):1495-1506.
[12]Mossalayi M D,Mentz F,Ouaaz F,et al. Early human thymocyte proliferation is regulated by an externally controlled autocrine transforming growth factor-beta 1 mechanism[J]. Blood,1995,85(12):3594-3601.
[13]Schluns K S,Cook J E,Le P T. TGF-beta differentially modulates epidermal growth f actor-mediated increases in leukemia-inhibitory factor,IL-6,IL-1 alpha,and IL-1 beta in human thymic epithelial cells[J]. J Immunol,1997,158(6):2704-2712.
[14]Christ M,McCartney-Francis N L,Kulkarni A B,et al. Immune dysregulation in TGF-beta 1-deficient mice[J]. J Immunol,1994,153(5):1936-1946.
[15]Boivin G P,O'Toole B A,Orsmby I E,et al. Onset and progression of pathological lesions in transforming growth factor-beta 1-deficient mice[J]. Am J Pathol,1995,146(1):276-288.
[16]Chantry D,Turner M,Feldmann M. et al. Interleukin 7 (murine pre-B cell growth factor/lymphopoietin 1) stimulates thymocyte growth: regulation by transforming growth factor beta[J]. Eur J Immunol,1989,19(4):783-786.
Responsive Characteristics of IL-7 and TGF-β1 in thymus during Exercise-induced Immunosuppression
ZHANG Lin,HAO Xuan-ming
(South China Normal University,Guangzhou 510006,China)
To investigate the regulatory mechanism of thymocyte development during exercise-induced immunosuppression, IL-7 and TGF-β1 as well as their mRNA of rats in thymus were tested. A total of 128 Sprague–Dawle male rats, aged 8 weeks, were divided into Control Group and Exercise Group. Incremental ergomitry Exercise protocol (10 m·min-1in week1, 20 min week2, 5 m·min-1increased per week, successive 6 weeks, 6 d per week, 30 min per day). Samples were taken in week 0, week 2, week 4 and week 6 before exercise, just after exercise and 3 h after exercise, respectively. IL-7 and TGF-β1 as well as their mRNA of rats in thymus were calculated by ELISA and FQ-RT-PCR. Results:1) During six weeks incremental exercise: The responsive tendency of IL-7 and its mRNA presented the shape of “V” letter during week 0 and week2,while there was no distinguished changes during week4,and last decreased in week6. TGF-β1 and its mRNA presented that of inversed “V” letter during every week, except its mRNA was no prominent change in week0. Conclusion: The decrease of IL-7 and increase of TGF-β1 during Exercise-induced immunosuppression could be resulted the disorder of thymic microenvironment which effected thymocyte development.
exercise biochemistry;exercise-induced immunosuppression;interleukin-7(IL-7);transforming growth factor beta 1(TGF-β1);thymus;responsive characteristics
张琳(1971-),女,在站博士后,研究方向:运动免疫学。通讯作者:郝选明教授。
G804.7
A
1006-7116(2011)04-0137-04
2010-12-05
广东省自然科学基金(9151063101000059);第49批中国博士后科学基金面上资助项目(20110490909)。
·民族传统体育·

