云南萝芙木内生放线菌分离研究
洪亮,解修超,陈绍兴,张永丽,陶宏征,杨建*
(1.红河学院生命科学与技术学院,云南 蒙自 661100;2.陕西理工学院陕西省资源生物重点实验室,陕西 汉中 723000;3.中国科学院西双版纳热带植物园,云南 勐腊 666303)
云南萝芙木内生放线菌分离研究
洪亮1,解修超2,陈绍兴1,张永丽3,陶宏征1,杨建1*
(1.红河学院生命科学与技术学院,云南 蒙自 661100;2.陕西理工学院陕西省资源生物重点实验室,陕西 汉中 723000;3.中国科学院西双版纳热带植物园,云南 勐腊 666303)
对药用植物云南萝芙木进行内生放线菌的分离.使用酒精和次氯酸钠对样品的根、茎、叶和果实进行表面消毒.采用两种分离培养基和三种分离方法并且分别添加重铬酸钾进行分离.共分离到17株内生放线菌.
云南萝芙木;内生放线菌;分离
云南萝芙木(Ranvolfia Yunnanensis Tsiang)喜高温湿润气候,能耐短期霜冻,在我省海拔900~1300m山地灌丛或山坡密林、溪边潮湿肥沃的地方广有分布,尤以西双版纳、思茅等地区多见,是我省珍贵的药用植物之一.其根含利血平、阿马里斯、萝芙木碱等多种生物碱,其味苦、性寒、有微毒,具有降血压、泻肝火、镇静、解瘀等功效.自1952年Muller等人从萝芙木植物中提取出利血平并发现它具有降压和安定作用,且有较高的疗效后,引起医学界和药学界的高度重视.萝芙木是生产利血平和降压灵的植物原料,国外以印度开发利用比较成功,其他国家和地区虽有生产,但规模比较小.长期以来,各国都是利用野生资源生产利血平,资源已逐年减少,远不能满足生产的需求[1].
植物与微生物之间存在着一种复杂的微生态关系,在这个微生态中发挥重要作用的成员之一是植物内生菌.研究表明,内生菌具有多种生物学功能.另外一些研究表明药用植物中一些内生菌能产生与宿主植物相同或相似的生理活性成分以及其它特殊的生理活性物质,为解决药用植物的资源危机提供了新的思路,己经成为新的抗菌抗癌、抗植物病虫害物质的资源宝库[2].
本研究以云南药用植物萝芙木为材料,通过不同的样品预处理方法及不同的分离培养基对萝芙木不同部位进行内生放线菌的分离,以获得适合其分离的方法,为研究和应用药用植物内生放线菌奠定基础.
1 材料与方法
1.1 材料
1.1.1 样品药用植物云南萝芙木
1.1.2 培养基S M2培养基,OA培养基,ISP2培养基
1.1.3 抑制剂分离培养基中加入抑制剂:重铬酸钾50mg/L,以抑制内生真菌与细菌的生长.
1.2 方法
1.2.1 表面消毒
取萝芙木的根、茎、叶、果,按下列程序进行表面消毒:自来水冲洗,75%酒精处理5min,无菌水冲洗3-4次,有效氯含量为5%的次氯酸钠处理3-8 min(根、茎、叶、果处理时间不同),无菌水冲洗5次[3].
1.2.2 内生放线菌的分离
在无菌的条件下,将已完成表面消毒的样品放入研钵中,先取一部分用无菌小刀切成边长为5mm左右的正方形小块放入两种分离培养基上培养(直接贴片法),剩余的样品加无菌水在研钵中研磨,取100ul研磨后的匀浆与未凝固的分离培养基进行混匀培养(混匀法),再取100ul匀浆于分离培养基上涂布培养(涂布法).培养温度为28℃,培养时间为1-3周,以待放线菌的长出[4].
1.2.3表面消毒可靠性的检验
为了检查表面消毒是否彻底,进行了对照实验.将上述消毒处理最后一遍清洗的无菌水直接置于分离平板上,于相同的条件下培养,以平板是否有菌生长,证实分离菌是否为内生放线菌[3].
2 结果与分析
2.1 表面消毒的可靠性
在用最后一次处理植物样品的无菌水涂布的平板上,看不到有放线菌菌落的长出,偶尔只有零星的芽孢杆菌长出,而在对照的平板上,放线菌的生长占据优势.由此可以看出,一般放线菌在经过我们的表面消毒程序后不能存活;尽管芽孢杆菌表现出一定的耐受性,但是它对内生放线菌的分离不造成影响.
2.2 不同培养基内生放线菌分离情况
采用两种不同分离培养基对萝芙木进行植物内生放线菌分离,分离结果见图1.

图1 不同培养基分离到的内生放线菌数目
由图1结果表明,使用两种不同分离培养基,共分离得到17株内生放线菌,并且全部由S M2培养基分离得到,分离效果明显好于OA培养基.
2.3 不同样品处理方法内生放线菌分离情况
采用三种不同样品处理方法对萝芙木进行植物内生放线菌分离,分离结果见图2.
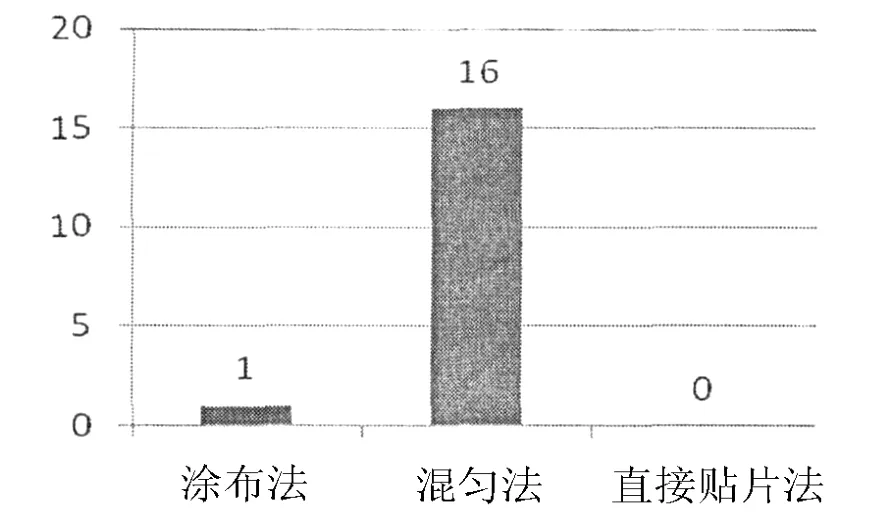
图2 不同样品处理方法分离到的内生放线菌数目
由图2结果表明,混匀法分离到的内生放线菌明显多于涂布法和直接贴片法,可能是因为采用涂布法和贴片法的时候内生菌未能从植物组织内释放出来,而混匀法能使植物组织内生菌较好释放出来.
2.4 萝芙木不同部位内生放线菌分离情况
对萝芙木不同部位进行内生放线菌分离,分离结果见图3.

图3 萝芙木不同部位分离到的内生放线菌数目
由图3结果表明,从萝芙木不同部位分离得到的内生放线菌数目是果实最多,其次是根部,最后是叶和茎.这与以往的研究基本相符,只是在果实中分离到较多的内生放线菌,具有一定的开发利用潜力.
3 讨论
从植物中分离放线菌,表面消毒是一个关键的步骤.植物的表面通常附着有比较多的真菌,培养时可能快速布满整个平板,不利于放线菌的分离[5].酒精和次氯酸钠作为表面消毒剂已经广泛用于分离植物内生菌[6].实验表明,我们采用的消毒方法能有效去除表面杂菌的污染,从植物中分离出内生放线菌.
通常认为,植物体内的内生放线菌会因为植物种类、地域分布的不同而不同;也就是说,植物种类和分布的多样性决定了植物内生放线菌的多样性[7].我国有着丰富的植物多样性,尤其是民族药用植物,以及广阔的地域分布,因而在我国开展植物内生放线菌的研究有着巨大的潜力.
[1]杜应甲.漫谈云南萝芙木的开发利用[J].云南林业,2007,28(1):21.
[2]洪亮.不同生境中稀有放线菌的研究进展[J].红河学院学报,2009,7(2):27-30.
[3]陈华红,徐丽华等.植物内生放线菌的分离方法[J].微生物学通报,2006,33(4):182-185.
[4]洪亮.红树林环境稀有放线菌的分离、初步鉴定及活性评价[D].华南热带农业大学,2007.
[5]古强,刘志恒,黄英等.植物叶片内生放线菌的分离、分类与拮抗活性[J].微生物学报,2006,46(5):778-782.
[6]Bacon CW,White JF.Microbial endophytes[M].New York:Marcel Dekker Inc.,2000.
[7]Strobel GA.Endophyte as sources of bioactive products[J].Microbes Infect,2003,5(6):535-544.
Study on Isolation of Endophytic Actinomycetes from Ranvolfia Yunnanensis Tsiang
HONGLiang1,X I E X iu-chao2,CHEN Shao-xing1,ZHANG Yong-li3,TAO Hong-zheng1,YANG Jian1*
(1.College ofLife Sciences and Technology,Honghe University,Mengzi,661100,China;2.Shaanxi Key Laboratory of Resource Biology,ShaanxiUniversity of Technology,Hanzhong 723001,China;3.Xishuangbanna TropicalBotanical Garden,Chinese Academy of Sciences,Mengla 666303,China)
The aims of this study are to isolate endophytic actinomycetes from medicinal plant Ranvolfia Yunnanensis Tsiang.Root,stem,leaf,and friut of the sample was surface-sterilized by using ethanol and Sodium hypochlorite prior to the isolation of the actinomycetes.Two kindsof isolation medium named S M1 and OA and three kinds of isolation method were used to isolate and respectively supplemented with potassium dichromate.Seventeen strains were isolated.
Ranvolfia Yunnanensis Tsiang;endophytic actinomycetes;isolation
Q93
A
1008-9128(2010)02-0052-03
2010-03-28
云南省教育厅科研基金项目(07C11183),红河学院博硕科研启动项目(XSS07007、XSS07013)
洪亮(1982-),男,江西景德镇人,硕士.研究方向:应用微生物.
杨建(1980-),女,贵州遵义人,硕士.研究方向:应用微生物.
[责任编辑 姜仁达]

