溶解—研磨法制备羊毛角蛋白粉末
刘让同,李 亮,李 锐
(中原工学院,郑州,450007)
溶解—研磨法制备羊毛角蛋白粉末
刘让同,李 亮,李 锐
(中原工学院,郑州,450007)
探讨溶解—研磨法制备羊毛角蛋白粉末的工艺流程及羊毛角蛋白粉末的特性.制得的平均粒径为191.267 μm的羊毛角蛋白粉末中含有大量的酰胺键,属于二硫键已经破裂的多肽;当使用温度低于220℃时,羊毛角蛋白粉末具有热稳定性;羊毛角蛋白粉末形态不规则,颗粒大小不匀且表面不光滑,团聚现象严重.
溶解—研磨法;角蛋白粉末;羊毛
羊毛角蛋白粉末可以用于很多人工材料的改性,如人造皮革、涂料、油墨、橡胶、塑料、合成纤维、合成树脂、织物整理等,能改善这些材料的吸湿性和保湿性,而且羊毛角蛋白质粉末富有滑润性,使其表面产生天然纤维的触感,这个特性也使其可作为化妆品原料[1-3];由于羊毛富含多种氨基酸,也可经过特殊的粉末制备方法,得到各方面性能都很好的粉末,用于医疗、医药领域;另外,羊毛角蛋白中富含赖氨酸、蛋氨酸、组氨酸、色氨酸等13种氨基酸,羊毛角蛋白粉末可代替鱼粉配制动物、鱼类等饲料,因此利用废弃羊毛制备羊毛角蛋白粉末有比较好的应用前景.用羊毛制备羊毛角蛋白粉末的研究始于日本,目前制备方法主要有3种:机械法、化学-机械联合法及溶解-研磨法.对于纯净的羊毛集合体,用这3种方法均能制备出羊毛角蛋白粉末,但当羊毛与其他材料混合在一起时,溶解-研磨法的优势就凸显出来了.本文主要探讨溶解-研磨法制备羊毛角蛋白粉末的有关问题.
1 羊毛角蛋白粉末的制备
要把羊毛角蛋白从其与其他材料的混合体中提取出来,溶解-研磨法是一种比较好的选择.羊毛角蛋白粉末的制备流程如下:
羊毛→溶解→过滤→再过滤→透析→烘干→研磨→羊毛角蛋白粉末.
1.1 羊毛溶解
羊毛角蛋白大分子是由各种α氨基酸通过肽键构成的多肽长链,这些长链又通过二硫键、氢键、盐式键、酯键、范德华力等相互联系,形成曲折交联的α-螺旋三维结构,并形成纤维的结晶区和非晶区,其结构极其复杂致密,因此羊毛角蛋白的溶解是很有难度的[4-5].羊毛角蛋白粉末制备的关键之一在于角蛋白溶液的制取.
本文选用以硫化钠(分析纯,Na2S,分子质量为70.04)为主,以尿素(分析纯,(NH2)2CO,分子质量为60.06)、十二烷基硫酸钠 SDS(分析纯,CH3(CH2)10OSO3Na,分子质量为288.38)为辅的溶剂体系实施对羊毛的溶解.表面活性剂SDS能够加速润湿羊毛,其与角蛋白也能够形成胶束,制得较高分子量的蛋白质溶液.实验中利用尿素可以破坏氢键、盐式键、酯键等横向联系,造成蛋白质变性,羊毛的空间螺旋结构发生变化,使二硫键暴露出来.硫化钠与水反应产生硫氢化钠,硫氢化钠与蛋白质发生反应,将羊毛中的二硫键打断.由于羊毛鳞片层有较强的化学惰性和疏水性,即使溶剂直接接触也不能完全破坏,溶剂只能通过破坏的部位和空隙等进入其内部,完全溶解需要一定的时间.羊毛的内部结构则较鳞片层松散,溶剂会很快将其溶解,最终鳞片层会慢慢溶解.
采用普通国产羊毛作为研究对象,与含有一定量的尿素、硫化钠、SDS的溶液体系以1∶20的浴比进行混合,温度控制在50℃,反应时间为6h,实现溶解.溶解过程的相关反应如下:
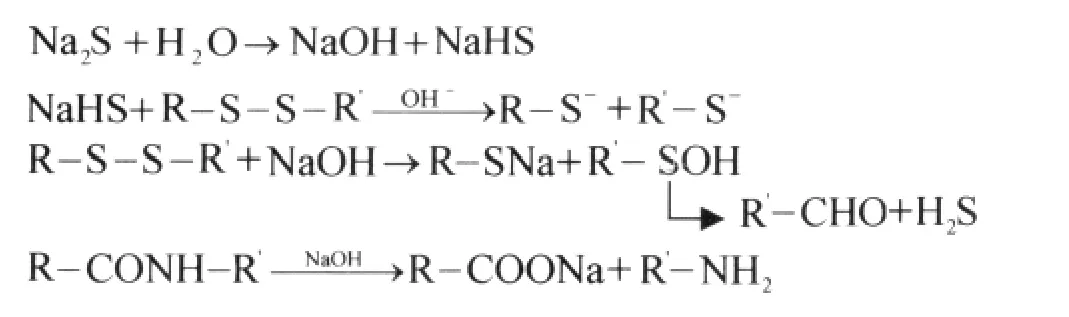
1.2 羊毛角蛋白粉末制备
通过对反应体系反复过滤,去除体系中的未溶物,再将该溶液进行透析,去除反应体系中的各种溶剂,得到羊毛角蛋白溶液.
然后将羊毛角蛋白溶液置于50℃的烘箱中进行烘干,经研磨得到羊毛角蛋白粉末.制备羊毛角蛋白粉末时烘干温度以50℃为佳,温度过高,羊毛角蛋白溶液易变性,过低,效率较慢.一般羊毛角蛋白溶液在50℃时烘干8h,得到结晶的羊毛角蛋白.研磨时间与羊毛角蛋白粉末的粒径相关,本文采用的研磨时间为4h.
2 羊毛角蛋白粉末观察与性能测试
2.1 红外光谱测试
把羊毛制成羊毛角蛋白粉末是利用其吸湿性和保湿性好、富有滑润性等优点.为了了解羊毛角蛋白粉末是否还具有角蛋白的特性,需要通过红外光谱来分析.本文采用Nicolate公司的670型FT-IR红外光谱仪对羊毛和羊毛角蛋白粉末进行测试.测试结果如图1、图2所示.

图1 羊毛角蛋白粉末红外光谱图

图2 羊毛红外光谱图
2.2 热重分析
热重分析是在程序控制温度下测量待测样品的质量与温度变化关系的一种热分析技术,可以用来研究材料的热稳定性和组分.本文采用NETZSCH公司的STA-409PC/PG型热分析仪对羊毛角蛋白粉末的热稳定性进行测试分析,测试结果如图3所示.

图3 羊毛角蛋白粉末热重分析曲线
2.3 羊毛角蛋白粉末的特性
羊毛角蛋白粉末是否能够推广应用与粉末的粒度和形状关系很大,因此有必要了解溶解-研磨方法所制角蛋白粉末的这些特性.本文采用MS2000激光粒度分析仪来测定粉末的粒度情况,测试结果见表1和图4;采用SEM-6360LV扫描电镜观察颗粒的形状,结果如图5所示.
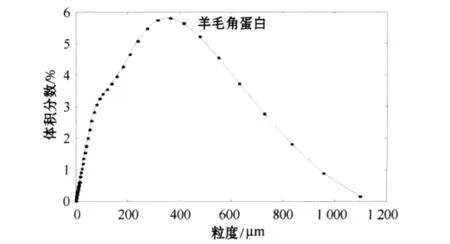
图4 羊毛角蛋白粉末粒度分布图

表1 羊毛角蛋白粉末粒度分析报表

图5 羊毛角蛋白粉末的微观形态
3 结果与分析
3.1 羊毛角蛋白粉末红外光谱及构象
一般蛋白质的IR光谱的谱带主要有三大类[6-8]:①氢键化的各类特征吸收带;②由组成蛋白质的氨基酸侧基性质所决定的各类吸收;③各酰胺带中,酰胺I谱带一般在1690~1 600cm-1处,是由酰胺的羰基C=O伸缩振动产生的,它会因测定条件不同而不同;酰胺Ⅱ谱带在带主有~1 480cm-1处,是由于N-H弯曲振动和C-N伸缩振动的组合吸收,以N-H弯曲振动为主;酰胺Ⅲ谱带一般在般在1~1 229cm-1处,也是由于N-H弯曲振动和C-N伸缩振动的组合吸收,以C-N伸缩振动为主;酰胺V谱带位于800~640cm-1处,归 属 于 N-H 弯曲振 动,在3 000cm-1处左右有C-H 的伸缩振动谱带,在3 300cm-1和3 100cm-1二处都有NH伸缩与酰胺II的共振吸收.
图1和图2所示分别为羊毛角蛋白粉末与羊毛的红外光谱,都属于典型的蛋白质类红外光谱图,即都具有明显的氢键、酰胺I、酰胺Ⅱ、酰胺III谱带的特征.图1中1654.83cm-1处的强吸收峰和图2中1654.62cm-1处的强吸收峰是酰胺I谱带的强特征吸收,说明羊毛角蛋白粉末和羊毛二者分子基团及振动种类没有什么变化.在酰胺Ⅱ带上羊毛和羊毛角蛋白粉末有细小差别,即由C—N伸缩、N—H弯曲形成的酰胺II谱带吸收峰产生了一定的偏移,羊毛角蛋白粉末在1532.20cm-1、1450.05cm-1处产生强吸收,而羊毛在1535.41cm-1、1450.32cm-1处产生强吸收.一方面酰胺Ⅱ谱带说明在羊毛溶解时,由于较好的温度控制,羊毛大分子链间的化学键保持完整,N—H键振动变化不明显;另一方面,由于溶解的形成致使羊毛角蛋白大分子的空间结构变化和二硫键断裂,使C—N伸缩、N—H弯曲自由度更大,波数下移.羊毛酰胺III谱带吸收峰在1236.87cm-1处,羊毛角蛋白粉末吸收峰在1238.28cm-1处,酰胺III谱带吸收峰也是由 C—N 伸缩、N—H 弯曲形成.在3 330cm-1处附近伯酰胺伸缩振动产生,羊毛角蛋白粉末和羊毛在此处均有吸收峰,说明羊毛角蛋白粉末与羊毛一样具有伯酰胺基团.
羊毛在2876.04cm-1、2958.99cm-1处附近由烷烃伸缩振动产生强吸收,羊毛角蛋白粉末则在2 853cm-1、近烷烃伸.25cm-1处产生,主要是二硫键在溶解过程发生断裂,烷烃伸缩振动谱带发生低波偏移,说明该方法制得的羊毛角蛋白粉末二硫键已经破裂.
根据红外光谱图和前人研究的结果,可以定性地分析大分子链的特征基团和分子构象.以酰胺I特征谱带来表征蛋白质的结构,根据多肽的红外研究结果[6-8],酰胺I谱带的1660~1 650cm-1吸收归属于α-螺旋结构,构以性~1 630cm-1吸收归属于β-折叠结构.酰胺I谱带的谱峰目前较成熟的有:有:1~1 650cm-1为α-螺旋;旋;1~1 640cm-1为无规卷曲;曲;1~1 610cm-1为β-折叠.结合以上分析可看出,羊毛在1 653cm-1处有强吸收峰,即酰胺I谱带的强特征吸收,在1 532cm-1、1 520cm-1、1 237cm-1三处有较强吸收峰,说明羊毛中以α-螺旋型构象为主,并同时存在β-折叠构象;由图1可见,我们所制备的羊毛角蛋白粉末在1 654cm-1、1 535cm-1(分别为α-螺旋型构象的酰胺I谱带和酰胺II谱带的强特征吸收)二处出现了强吸收峰,说明羊毛角蛋白粉末中含有大量的α-螺旋型构象.
由此可见,本文所制得羊毛角蛋白粉末中含有酰胺键,虽二硫键已经破裂,但具有多肽特征,应属蛋白质,并且是以α-螺旋型构象为主的蛋白质.
3.2 羊毛角蛋白粉末热重分析
羊毛角蛋白粉末热重分析曲线如图3所示.羊毛角蛋白粉末在氮气中加热,试样重量7.06mg,升温速度与范围30℃/20(K/min)/300℃.羊毛角蛋白粉末中水分随温度升高而蒸发,粉末的重量逐渐减少,蒸发速率在97.13℃处达到最大,这一阶段出现的馒头峰主要是纤维中的水分在升温过程中不断吸热而逐渐蒸发所形成的吸收峰,然后,重量变化速率逐步减小,热重曲线在182.13℃处出现拐点,到190℃左右,粉末重量基本不变化,水分蒸发过程结束.在此变化过程中,粉末重量损失9.96%,所以该粉末的含水率为9.96%.然后,从220℃左右开始,材料的重量又减少,粉末的热裂解从242.2℃开始,重量急剧下降,热裂解在287.2℃时达到高峰,此后,材料继续裂解,重量缓慢减少,到300℃时,整个裂解过程的重量变化率达到-24.75%.由此可知,当使用温度低于220℃时,羊毛角蛋白粉末是稳定的.
3.3 羊毛角蛋白粉末粒度分析
粒度就是颗粒的大小,常见的测试方法有激光法、筛分法、图像法、电阻法、显微图像法、刮板法、透气法、超声波法和动态光散射法等.本文采用MS2000激光粒度分析仪(干法)对羊毛角蛋白粉末进行检测.由表1可知,羊毛角蛋白粉末的平均粒径为191.267μm,比表面积为0.010435 7m2/g,粒度相对比较大,粒径分布也不是很均匀,主要是研磨时间较短,只有4h;若延长研磨时间并对粉末进行过滤,可以制得粒径小于10μm的颗粒.
3.4 羊毛角蛋白粉末微观形态
将羊毛角蛋白粉末置于扫描电镜下观察,其微观形态如图5所示.由图5可知,采用的溶解-研磨法得到的羊毛角蛋白粉末,其细度可以达到微米数量级,其形态为不规则的无定形粉末,颗粒大小不匀且表面不光滑,由于粉末较强的表面能,大部分粉末都凑合在一起,呈团聚状态.这主要是由于研磨时间不够,研磨不均匀造成,且拍电镜照片时未做适当分散处理.
4 结 语
本文选用以硫化钠为主,以尿素、十二烷基硫酸钠SDS为辅的溶剂体系实施对羊毛的溶解,然后通过过滤、透析、干燥和研磨等工序,可以制得平均粒径为191.267μm的羊毛角蛋白粉末.该粉末具有以下特点:
(1)羊毛角蛋白粉末含有大量的酰胺键,二硫键已经破裂,具有多肽特征,属于以α螺旋为主的蛋白质;
(2)当使用温度低于220℃时,羊毛角蛋白粉末具有热稳定性;
(3)粉末形态不规则,颗粒大小不匀且表面不光滑,团聚现象严重.
[1] XU Wei-lin.Development and Characterizations of Super-fine Wool Powder[J].Powder Technology,2004,140:136-140.
[2] 国锋,马兴元.皮革固体废弃物的综合利用技术[J].皮革化工,2001,18(1):4-5.
[3] 刘建勇.羊毛粉末及其性能与应用[J].印染助剂,1999,16(2):4-6.
[4] 刘让同,徐博.巯基乙醇还原法溶解羊毛角蛋白[J].毛纺科技,2004(2):5-7.
[5] 刘让同.羊毛价值提升技术及羊毛角蛋白的纤维化再生[J].毛纺科技,2004(10):8-11.
[6] 陈莉萍,于伟东.羊毛及其角朊膜显微傅立叶红外光谱分析对比[J].东华大学学报,2006(8):105-109.
[7] 彭显能,陈新,邵正东.二维相关红外光谱研究再生蚕丝蛋白膜的构象与温度之间的关系[J].化学学报,2004,62(21):2127-2130.
[8] 吴玉清,尾崎幸洋.二维相关红外光谱研究溶液中蛋白质的结构[J].红外与毫米波学报,2003,22(3):161-168.
Preparation of Wool Keratin Powder by Dissolution-grinding
LIU Rang-tong,LI Liang,LI Rui
(Zhongyuan University of Technology,Zhengzhou 450007,China)
The process of dissolution-grinding for preparing wool keratin powder is discussed,and the characteristics of the powder is examined in this paper.The mean diameter of wool keratin powder obtained from the dissolution-grinding process is 191.267μm.It is found that the keratin powder consist of many peptides with a large number of amido linkage and disulfide broken,the keratin powder keep stable when the working temperature is below 220℃;and the powder have characteristics of irregular shape,uneven particle size,unsmooth surface and the serious phenomenon of reunion.
dissolution-grinding;keratin powder;wool
TS102.1
A
10.3969/j.issn.1671-6906.2010.05.011
1671-6906(2010)05-0042-04
2010-09-26
刘让同(1966-),男,湖南新化人,教授,博士.

