分子成像技术及应用
杨 阔,张小琴,宋 永,秦天莺
(1.阿坝师范高等专科学校电子信息工程系,四川成都 611741;2.电子科技大学物理电子学院,四川成都 610054; 3.西南民族大学生命科学与技术学院,四川成都 610041)
分子成像技术及应用
杨 阔1,2,张小琴3,宋 永1,秦天莺3
(1.阿坝师范高等专科学校电子信息工程系,四川成都 611741;2.电子科技大学物理电子学院,四川成都 610054; 3.西南民族大学生命科学与技术学院,四川成都 610041)
分子成像是近年来出现的一个将分子生物学与在体成像相结合的新领域.它可以使细胞功能可视化,并且能在生物活体内部无创地跟踪分子过程.该领域的技术还可以用于许多疾病诸如癌症、神经和心血管疾病的早期诊断.同时,这项技术还可以通过优化新药物的临床前和临床测试来改进临床治疗,这将会由于其早期和准确的诊断而带来很大的经济影响.可以预见分子成像技术的迅速发展可能导致临床医疗的重大变革.该文就分子成像技术及其应用作一综述.
分子成像;分子探针;荧光成像;核磁成像;量子点
医学影像技术的发展可以分成结构成像、功能成像和分子成像三个阶段.分子成像,广义地可定义为在分子与细胞层次上对活体状态下的生物过程进行定征和测量.这一定义强调“活体状态”(in vivo),强调对“生物过程”的定量测量,强调在“分子与细胞层次上”的测量而不强调对分子或细胞本身的测量.也有人给出了另一个对生物医学工作者来说更完善的定义:“利用体外成像检测器在细胞和分子层次上对活体动物、模型系统和人体的生物学过程进行定征和测量”[1].相对于传统的活检,分子成像的特点是:无创检测,动态采集和全面反映.分子成像技术涉及信息科学、放射医学、化学物理学、生物学、核医学和临床医学等多个学科[1-7],它是一门新兴的交叉学科.近年来,由于红偏移光蛋白、感应荧光底物、近红外靶标荧光造影剂等具有较高组织穿透力的荧光探针技术有了长足的发展,荧光成像技术开始用于小动物模型内部特异生物大分子活动规律的在体跟踪和测量.光学分子成像技术是整个领域新的热点研究方向,核素标记的分子成像是当今分子成像的主流,核素标记的分子成像虽然已经应用于临床,但是仍然存在大量需要解决的基础科学问题.荧光标记的光学分子成像正处于发展的初期,是分子影像学领域面临突破的重点研究方向.在以上提到的分子成像技术中,光学成像技术具有其他模态无法同时兼有的优点而在此领域备受关注,因为它在特异性、灵敏性、实时性和安全性等一系列重要指标上具有明显的优势.尽管光学分子成像理论和技术在很多方面远未成熟,但它在生命科学研究中却具有重要的应用价值,已经引起了研究人员的广泛重视.
1 分子成像的关键技术
分子成像的关键技术主要包括分子探针技术、系统测量技术以及数据分析与处理技术三个方面.
1.1 分子探针技术
分子探针是一种特殊的分子,它是分子成像技术的关键,它将特殊分子引入组织体内与特定的分子(被称为靶分子)特异性结合时产生信号,在体外可采用核磁共振 (MR I)[8-9],正电子发射计算机层析 (PET)[10-11]、CT和单光子发射计算机层析(SPECT)、超声[12-13]以及光学设备进行成像[14-15].表 1列出了各种分子成像设备中的分子探针特性.
对小分子荧光探针来说,一般由两部分组成:荧光团以及与受体专一性高亲和力结合的配体.受体与目标蛋白质融合,通过受体与配体的相互作用来标记蛋白质.在分子成像中,对小分子荧光探针的要求是:能够与受体专一性稳定结合,使其在进行监测的较长时间(几个小时)内保持稳定性;应该可以穿过细胞膜并且无毒;探针尽可能地设计成一定的模式,使得多种荧光团能够方便地结合,背景噪音水平尽可能低.选择合适的受体可以实现对蛋白质位点专一性结合.对于受体的选择有以下两个要求:①受体与目标蛋白质融合后必须能够被基因表达;②受体应该尽可能小,以致不干扰目标蛋白质的正常生理功能,因此较理想的受体是一段短序列的肽链并且能够插入目标蛋白质的许多位点.而选择适合的受体—配体对可以实现对蛋白质高灵敏度高亲和力结合.一般说来,受体与配体的结合应当尽可能快速进行,有利于监测时间敏感性的生理过程.受体—配体的作用一般包括半抗原—抗体、生物素—抗生物素蛋白、酶—底物、联砷荧光物质与富含半胱氨酸的肽链之间的作用等.常见的荧光分子探针有:FLASH型探针、AGT型探针、Halo Tag型探针、PCP、ACP型探针、F36V型探针、“Click”反应型探针等[9,16-19].

表1 各种分子成像设备的分子探针特性
1.2 分子成像技术
分子成像技术包括超声、正电子发射断层成像、CT、单光子发射断层成像、光学成像和核磁共振.超声成像利用超声微泡造影剂介导来发现疾病早期在细胞和分子水平的变化[20-21].传统 CT和超声成像技术是基于成像对象的理化特性,反映的是疾病的终末期状态,无法反映疾病早期发生、发展的分子变化和疾病的性质.随着具有更高的分辨率与灵敏度的微 CT出现,这项传统技术也进入分子成像领域,主要用于肿瘤学和骨科方面的研究[22].
1.2.1 核磁成像
核磁共振的基本原理是原子核能够自旋从而产生自旋磁场.原子核带正电并有自旋运动,其自旋运动必将产生磁矩,称为核磁矩.在外磁场中,原子核自旋角动量的空间取向是量子化的.依据核磁矩与自旋角动量的关系,核磁矩在外磁场中的取向也是量子化的.在外磁场中,具有磁矩的原子核具有相应的能量.可见,原子核在外磁场中的能量也是量子化的.由于磁矩和磁场的相互作用,自旋能量分裂成一系列分立的能级,相邻的两个能级之差Δ Ε=γhB.用频率适当的电磁辐射照射原子核,如果电磁辐射光子能量hv恰好为两相邻核能级之差ΔE,则原子核就会吸收这个光子,发生核磁共振的频率条件是:hv= γhB=γhB/2π.对于确定的核,旋磁比γ可被精确地测定.可见,通过测定核磁共振时辐射场的频率ν,就能确定磁感应强度;反之,若已知磁感应强度,即可确定核的共振频率.当有外加磁场时,原子核的磁场发生变化从而对外表现出磁性.当没有外加磁场时,原子核的磁场方向杂乱无章,所以被检测目标呈磁中性.当停止外部磁场,被磁化的原子核把吸收的能量释放出来,恢复到它以前的状态,这一恢复过程为弛豫过程.磁共振成像的最大优点是它是目前少有的对人体没有任何伤害的安全、快速、准确的临床诊断方法.
1.2.2 核素成像
核素成像主要有两种模式,即单光子发射断层成像(SPECT)和正电子发射断层成像(PET),常用于追踪小量标记基因药物和进行基因治疗中载体的传送研究,发现易于为核素标记的既定靶目标底物的存在等方面,在目前的分子影像学研究中占据着极其重要的地位.由于伽玛射线具有很强的组织穿透性,较高的探测灵敏感性不会因为分子探针深度的增加而减弱.核素成像最显著的优点是具有较高的灵敏度,
PET的不足之处是需要回旋加速器产生放射性同位素,而同位素的半衰期较短,且不宜同时检测多种探针,且设备价格昂贵.相对 PET来说,SPECT最大的缺点就是只能够进行半定量分析.
1.2.3 光学分子成像技术(Optical Imaging)
活体动物体内光学成像主要有荧光成像 (Fluorescence Imaging)和生物体自发光成像 (Bioluminescence Imaging)两种技术[23].
荧光技术则采用荧光报告基团(GFP、RFP),或 Cyt及Dyes等荧光染料进行标记,利用报告基因产生的生物发光、荧光蛋白质或染料产生的荧光就可以形成体内的生物光源,利用灵敏的光子成像技术可以从动物体表检测到组织内部的生物光源,使研究人员能够直接监控活体生物体内的细胞活动和基因行为.常用的有红色荧光蛋白(DsRed)、绿色荧光蛋白 (GFP)及其他荧光报告基团,标记方法与体外荧光成像相似.荧光成像的优点是费用低廉和操作简单.红光的穿透性在体内比蓝绿光的穿透性要好得多,因此观测生理指标的最佳选择为近红外荧光.目前的技术采用不同的原理来尽量降低背景信号,从而获取机体中荧光的准确信息,这以 GE-ART公司的时域(Time-Domain,TD)光学分子成像技术及精诺真公司和 CR I公司采用的光谱分离技术为荧光成像的主要代表[24].对于生物体自发光成像和荧光成像来说,后者的缺点是自荧光背景相当程度地限制了探测灵敏度,优势在于多数荧光探针具有设计上的高度特异性和较高的量子效率,因而可产生适合现有探测技术的稳健信号;而生物体自发光成像的成像物体不需要外源激发,无自荧光背景干扰问题,具有超高的灵敏度,但微弱的自发光信号对探测技术提出了极高的要求,并且该模态原则上不能用于临床应用,仅限于基因工程细胞或转基因类动物.总的来说,光学成像价格较低廉且具有一个显著优点,即它允许具有不同光谱特征的探针进行多通道成像.
生物发光是用荧光素酶基因标记细胞或DNA.目前应用较多的报告基因是萤火虫荧光素酶 (Firefly Luciferase)基因,其基因表达产物萤火虫素酶可以和从体外导入的萤火虫素(Luciferin)发生反应而发出近红外荧光,并可被 CCD相机捕获.自 1997年 Contag首次观察到表达 Fluc基因的转基因小鼠在注入荧光素酶底物后的生物发光现象[25-26]以来,荧光素酶被广泛应用于小动物成像技术.由于生物组织一般在红外线范围(>900 nm)及可见光范围(350~600 nm)有较高的光吸收;而在近红外区域(600~900 nm)生物分子的光吸收降到最低,大量的光可以穿过组织和皮肤而被检测到.生物发光的最大特点是极高的灵敏度[27-28].
表 2和表 3分别列举了各分子成像设备的探测特性以及各分子成像方法的应用领域和优缺点.
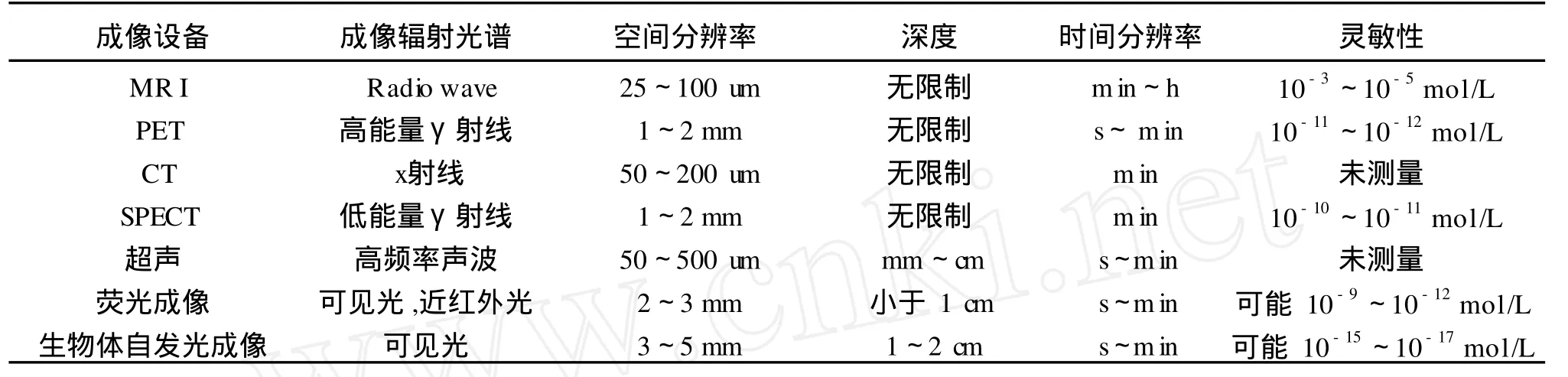
表2 各分子成像设备的探测特点

表 3 各分子成像方法的应用领域及优缺点
2 荧光分子成像技术
荧光分子成像技术[29]一直是生物医学研究中的一个重要工具.随着基因和蛋白质高通量筛选技术的广泛应用、基因病理学研究的深入以及组合化学技术的成熟,人们逐渐能够准确辨识与特种疾病关联的异常基因及其表达蛋白模式,进而设计和合成具有靶分子绑定或激活功能的特异荧光探针.荧光成像的应用也从一般的对比度增强功能迅速延伸至生物医学研究的分子层面,如蛋白质功能剖析、基因表达模式描述、蛋白质相互作用测定和细胞生理通道辨明等.
2.1 荧光分子成像研究现状
近年来,由于光电子技术的飞速发展和光学测量的直接性,更重要的是荧光分子成像所具有的超高的探测灵敏度和生化特异性,荧光成像技术开始用于小动物模型内部特异生物大分子活动规律的在体跟踪和测量[10].现有的荧光分子成像主要采用基于反射光强度测量的平面模式[30-31],所测光强直接反映探针与靶标分子的作用程度.荧光成像技术的发展一直遵循着两个基本趋势:①结合近红外荧光探针技术和近红外扩散光学层析(DOT)理论以实现生物活体内特异大分子生化过程的无损三维定量观测,即荧光扩散光层析(FDOT).②研究面向荧光寿命测量的成像方法以增强成像对比度和有效扩展靶分子及其环境信息,即荧光寿命成像(FL I).FDOT技术已经在频域和连续光两种测量模式上获得原理性实现并成功用于离体测试和在体蛋白酶获得观测[32-33],而时域 FDOT模式研究则处于基本测量技术和理论体系建立阶段,但该测量模式在 DOT应用中已经显示出的明显技术优势以及高灵敏时间分辨测量技术的快速进步而使其备受重视,它在本质上提供了有效分离荧光发射率和寿命图像的多参数同时重建能力和多组分分析能力[34-35].可以预计,时域 FDOT技术将成为该领域未来的研究重点和发展趋势.
2.2 荧光分子成像研究的意义
荧光分子层析技术在细胞和分子生物学、功能基因组和蛋白组学、肿瘤诊断学以及制药学等诸多重要科学领域具有广泛的应用前景.目前 FDOT的应用因为受探测深度和探针效率的限制,主要定位于小动物模型,相信随着探针性能和成像技术的提高,它有望直接应用于人体器官.与常规的离体检测和细胞培养技术相比,活体小动物 FDOT技术具有以下独特的应用优势.
(1)可潜在地作为转基因和基因标志动物模型显型筛选的有力工具:生存期内的重复成像使变异调查变得简单易行;支持复杂显型分析所需的多探针成像策略;允许同时进行显型观测和分析;排除了动物致死进行显型确定的极端方式.
(2)在药物开发的早期阶段可极为有效地用于靶标蛋白分子的验证、候选化合物评估、靶标与化合物的毒性反应测试和疗效评估等,从而在显著发生显型变化之前即可排除副作用明显的候选药物,大大缩短药物开发的临床前实验周期.
(3)可在体确定与生物学过程相关联的特异分子探针在无损生物体内的时空分布,能真实反映复杂生物结构和整体生命系统的动力学过程,使得基因/蛋白质功能和交互作用的测定更加容易.
(4)可实现所调查生物过程的定量分析,而动态分子层析的实现将使生物现象的四维信息获取变得简便、快速;能实现同一动物模型的重复实验,有效揭示生物参数的动态演变规律和评估治疗时间反应特征,大幅减少实验所需动物的数量,从而降低研究成本.
3 分子成像的发展前景
近年来出现的量子点(Quantum Dots)新技术发展为分子成像的新领域.量子点又称为半导体纳米微晶体,是一种理想的新型荧光探针.QDs与传统的染色分子相比,有许多优点[36]:QDs的色彩非常丰富 (这是它最大的优点)、光化学稳定性好、光强度高;能够承受多次的激发和光发射,有持久的稳定性;具有良好的生物相容性和无毒或低毒性;如果将 QDs与配体、抗体或药物偶联起来,可以对体内特定肿瘤进行跟踪,甚至达到摧毁癌细胞的目的.因此,量子点技术有望推动分子成像技术和生物制药技术的迅猛发展,给疾病的早期诊治提供先进的工具.但是,量子点在生物学中的应用研究才刚刚起步,还有许多领域有待开拓和发展,存在一些待解决的问题.例如提高QDs性能、研制新型QDs、了解QDs在体内的降解或排泄过程、QDs细胞毒性和体内长期存在的毒性、更好地解决QDs与各类生物大分子的偶联问题等.
总之,分子成像技术正在快速发展,已经逐渐呈现出多种图像技术整合的趋势,如 PET/光学成像、PET/CT、SPECT/MR I、PET/MR I、SPECT/CT等,在空间分辨率、检测的灵敏度、探针的多样性、定量化程度、图像重建技术等方面均取得了很大进步.有专家预测 10年后医院的诊疗方式会发生根本性的变化.
[1] Herschman H R.Molecular imaging:looking at problems,seeing solutions[J].Science,2003,302(5645):605-608.
[2] Weissleder R,Tung C H,MahmoodU,et al.In vivo imagingwith protease-activated near-infrared fluorescentprobes[J].NatBiotechnol,1999, 17(4):375-378.
[3] NtziachristosV,Tung C H,Bremer C,et al.Fluorescence molecular tomography resolves protease activity in vivo[J].NatMed,2002,22(8): 757-760.
[4] Achilefu,Dorshow R,Bugaj J,et al.Novel receptor-targeted fluorescent contrast agents for in vivo tumor imaging[J].Invest Radiol,2000,35 (8):479-485.
[5] Massoud T F,Gambhir S S.Molecular imaging in living subjects:seeing fundamental biological processes in a new light[J].GenesDev,2003, 17(5):545-580.
[6] NtziachristosV,Bremer C,Graves E E,et al.In vivo tomographic imaging of near-infrared fluorescent probes[J].Molecular Imaging,2002(1): 82-88.
[7] Weissleder R,NtziachristosV.Shedding light onto live molecular targets[J].NatureMedicine,2003(9):123-128.
[8] Benveniste H,Blackband S.MR microscopy and high resolution small animalMR I:applications in neuroscience research[J].Prog Neurobiol, 2002(67):393– 420.
[9] Louie A Y,HuberM M,Ahrens E T,et al.In vivo visualization of gene expression usingmagnetic resonance imaging[J].NatBiotechnol,2000, 18(3):321– 325.
[10]Blasberg R.PET imaging of gene expression[J].Eur J Cancer,2002,38(16):2137– 2146.
[11]Cherry S R,Shao Y,Siegel S,et al.MicroPET:A high resolution PET scanner for imaging small animals[J].IEEE TransNucl Sci,1997,44(3): 1161– 1166.
[12]Dayton P A,Ferrara KW.Targeted imaging using ultrasound[J].J Magn Reson Imaging,2002(16):362– 377.
[13]Foster F S.A new ultrasound instrument for in vivo microimaging ofmice[J].UltrasoundMed Biol,2002,28(9):1165– 1172.
[14]Contag C H,BachmannM H.Advances in vivo bioluminescence imaging of gene expression[J].Annu RevBiomed Eng,2002(4):235– 260.
[15]王飞,邝菲.肿瘤分子影像学研究进展[J].实用肿瘤杂志,2006,21(3):206-208.
[16]ChanW CW,MaxwellD J,Gao X H,et al.Luminescent quantum dots formultiplexed biological detection and imaging[J].CurrOpin Biotechnol,2002(13):40-46.
[17]Cherry S R.In vivo molecular and genomic imaging:new challenges for imaging physics[J].PhysMed Biol,2004(49):13-48.
[18]蒋星军,任彩萍.分子成像及其应用[J].生命科学,2005,17(5):456-460.
[19]Aime S,Cabella C,Colombatto S,et al.Insights into the use of paramagnetic Gd(III)complexes inMR-molecular imaging investigations[J].J Magn Reson Imaging,2002,16(4):394-406.
[20]PaulusM J,Sari S H,Gleason S S,et al.A new x-ray computed tomography system for laboratory mouse imaging[J].IEEE Trans Nucl Sci, 1999,46(3):558– 564.
[21]Arbeille P,EderV,CassetD,et al.Real-time 3D ultrasound acquisition and display for cardiac volume and ejection fraction evaluation[J].UltrasoundMed Biol,2000(26):201– 208.
[22]Leong P H,Christiansen J,KlibanovA L,et al.Noninvasive assess ment of angiogenesis by ultrasound and microbubbles targeted to alpha(v)-integrins[J].Circulation,2003(107):455– 460.
[23]GreerL F,SzalayA A. Imaging of light emission from the expression of luciferases in living cells and organisms:a review[J].Luminescence, 2002,17(1):43-74.
[24]MaggiA,Ciana P.Reportermice and drug discovery and development[J].Nat RevDrugDiscov,2005,4(3):249-255.
[25]Contag C H,Contag P R,Mullins J I,et al.A Photonic detection of bacterialpathogens in living hosts[J].Molecularmicrobiology,1995,18(4): 593-603.
[26]Contag C H,Spilman SD,Contag P R.Visualizing gene expression in living mammals using a bioluminescent reporter[J].Photochemistry and photobiology,1997,66(4):523-531.
[27]EdingerM,Cao YA,VernerisM R,et al.Revealing lymphoma growth and the efficacyof immune cell therapies using in vivo bioluminescence imaging[J].Blood,2003,101(2):640-648.
[28]张怡,韩彧,赵春林.活体动物内光学成像技术的研究进展[J].生命科学,2006,18(1):25-30.
[29]朱建新,宋小磊,汪待发,等.荧光分子成像技术概述及研究进展[J].中国医疗器械杂志,2008,32(1):1671-7104.
[30]Graves E E,Ripoll J,Weissleder R.A submillimeter resolution fluorescence molecular imaging system for small animal imaging[J].Am Assoc PhysMed,2003,30(5):901-911.
[31]Kepshire D,Davis S C,Dehghani H.Fluorescence tomography characterization for sub-surface imaging with protoporphyrin IX[J].Opt Exp, 2008,16(12):8582-8593.
[32]Milstein B,Oh S,Kevin J W.Fluorescence optical diffusion tomography[J].ApplOpt,2003,42(16):3081-3094.
[33]Milstein B,Stott J J,Oh S,et al.Fluorescence optical diffusion tomography using multiple-frequency data[J].Opt Soc Am A,2004,21(6): 1035-1049.
[34]Keren S,GheysensO,Levin C S,et al.A comparison between a time domain and continuouswave small animal optical imaging system[J].IEEE TansMed Imaging,2008,27(1):58-63.
[35]Han S H,HallD J.Estimating the depth and lifetime of a fluorescent inclusion in a turbidmedium using a simple time-domain opticalmethod[J]. OptLett,2008,33(9):1035-1037.
[36]Ebenstein Y,Gassman N,Kim S,et al.Lighting up individual DNA binding protein swith quantum dots[J].Nano Lett,2009,9(4): 1598-1603.
Molecular I maging Technology and Application
YANG Kuo1,2,ZHANG Xiao-qin3,SONG Yong1,Q IN Tian-ying3
(1.Departm ent of Electrical Infor m ation Engineering,Aba Teachers College,Chengdu611741,China;2.School of Physical Electronics,University of Electric Science and Technology of China,Chengdu610054,China;3.College of Life Sciences and Technology,Southwest University forNationalities,Chengdu610041,China)
Molecular imaging emerged in recent years as a new field with the combination ofmolecular biology and in vivo imaging.It enables the visualization of the cellular function and the follow-up of the molecular process in living organismswithout perturbing them.The technology of this field is applicable to the diagnosis of diseases such as cancer,neurological and cardiovascular diseases.It also contributes to improving the trea tmentof these disorders by optimizing the pre-clinical and clinical tests of new medication.It is also expected to have a major economic impact due to earlier and more precise diagnosis.Promisingly,it can be predicted that the rapid development ofmolecular imaging can lead to great changes of clinicalmedicine in the near future.In this review,molecular imaging technology and its applications are summarized.
molecular imaging;molecular probes;fluorescence imaging;MR I;quantum dots
O436
A
1007-0834(2010)04-0017-05
10.3969/j.issn.1007-0834.2010.04.007
2010-08-29
四川省教育厅科研项目(10ZC059);阿坝师范高等专科学校科研课题资助项目(ASA10-15)
杨 阔(1980—),男,四川安岳人,阿坝师范高等专科学校电子信息工程系讲师,电子科技大学物理电子学院在读博士研究生,研究方向:物理电子学、生物电磁学.

