乳腺可疑微钙化灶的立体定位真空辅助活检中金属标记夹放置的适应条件
刘 芳, 韩 萍, Roman Sokiranski
1 华中科技大学同济医学院附属协和医院放射科,武汉 430022
2 乳腺诊断中心, 慕尼黑 82008
目前,随着乳腺筛查计划的开展发现了更多临床上隐匿的乳腺病灶,多为不可触及的微钙化灶。乳腺微钙化灶的诊断仍是一个难题,立体定位乳腺真空活检技术(stereotactic vacuum assisted biopsy ,SVAB)因为准确率高、创伤小,已经取代了手术开放活检,成为乳腺微钙化灶诊断的首选手段[1-3]。但对于活检后是否有必要放置金属夹标记活检部位,用于随访和手术定位仍有争论,有些学者认为只是对乳腺片上显示取干净的病例有必要放置标记夹[4-6];有的主张常规放置[7];有些学者倾向于采用其他方式标记病灶,如Kass 等[8]用活检产生的血肿来标记原活检部位。但在活检过程中受到视野局限和血肿的干扰,判断微钙化灶是否被取干净以及是否有必要放置标记夹是有困难的[4]。这些认识上的分歧和操作中的困难,使得标记夹的放置有些盲目。我们回顾分析一组常规放置标记夹的病例,评价放置标记夹的适应条件。
1 资料与方法
1.1 患者和病灶
在德国慕尼黑乳腺诊断中心,自2005 年7 月至2007 年3 月期间共107 名35 ~85 岁的女性患者,平均年龄(63.0±12.3)岁,因筛查或其他原因发现乳腺内不可触及的微钙化灶,对其中的122 处可疑微钙化灶行立体定位乳腺真空活检。其中12 名患者为同侧乳腺2 处病灶分别进行活检,3 名患者为双侧乳腺各有1 处病灶各活检1 次。按乳腺图像报告和数据系统(breast imaging reporting and data system ,BI-RADS)对病灶进行分类,5 个病灶为BIRADS Ⅲ级, 114 个为BI-RADS Ⅳ级,3 个为BIRADS Ⅴ级。活检为恶性和不典型导管增生的病灶在2 周之内进行了手术切除,活检为良性的病灶随访复查3 ~29 月(平均6.8 个月)。所有病例活检前都被告知,并签署同意书,得到许可。
1.2 活检过程
活检前拍摄常规2 个体位(内外位和头尾位)的乳腺片(Mammomat 3000 Nova,Siemens,Germany)用于术前定位。
患者取侧卧位,常规消毒准备。用立体定位系统(Mammomat 1000/3000 Nova Opdima digital biopsy and spot imaging system unit,Siemens-Elema,Sw eden)定位病灶,指导活检针插入。我们用真空抽吸系统辅助的11-gauge 活检针(E thicon Endo-S urgery INC, USA)切取组织。对于小簇状钙化灶,活检针取材窗口放在钙化灶中心;对于大范围钙化灶,活检目标定在可疑恶性的区域。活检针插入时放在12 点钟位置,每隔60°旋转1 次切取组织,因此,活检针旋转1 周获取6 块组织。常规旋转2 周取12 块组织。取出的组织块放在玻片上用X 线检查有无钙化,随后送病检。
钙化灶活检结束后,每一处活检部位放入1 枚金属标记夹,我们采用Gel M ark Ultra 标记夹(SenoRx INC,USA,n=40,从2005 年7 月到2005 年12 月)或MicroM ark Ⅱ标记夹(Ethicon Endo-Surgery INC,USA,n=82,从2005 年7 月到2007 年3月)。所有操作结束后,拍摄内外位和头尾位的乳腺片(体位同活检前乳腺片),用于观察有无并发症和标记夹的位置,然后乳房绷带固定压迫24 h。
1.3 定义和评价
由2 名放射科医生单独对患者活检前和活检后乳腺摄影片所显示的钙化灶的BI-RADS 分类、钙化的大小、分布、钙化灶有无取净和血肿等情况进行回顾评价并记录。2 名医生意见不同处进行讨论,取得一致意见。
单簇性钙化灶:小簇状或节段分布的单一范围内钙化;多簇性钙化:至少1 个体位上可以分开的多范围钙化灶,可分布在相同或不同象限。
钙化簇大小的测量:单簇性钙化灶测量内外位片(该平面是活检取材压迫平面)上钙化簇的最长径;多簇性钙化灶测量取活检的那一处钙化簇,即目标簇的大小,测量方法同单簇性钙化灶。钙化簇大小按<10 mm,10 ~20 mm 和>20 mm 分级统计数目。
按钙化灶的大小和分布特点,将所有病灶分成4 组:A 组,直径<10 mm 的单簇钙化;B 组,直径在10 ~20 mm 之间的单簇钙化;C 组,直径>20 mm的单簇钙化;D 组,多簇性钙化(图1)。在活检后的头尾位和内外位两个体位的乳腺片上均未能观察到目标钙化簇,则认为目标灶在影像学上被“取净”。
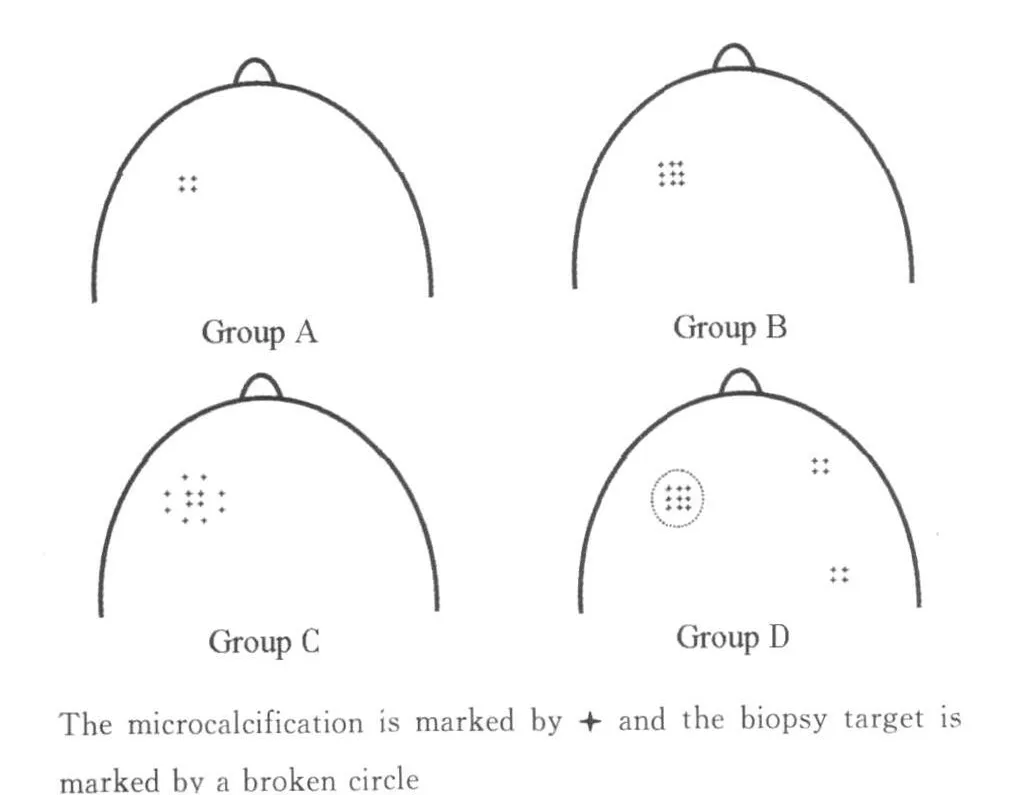
图1 根据钙化簇的直径和分布分组Fig.1 G rouping of microcalcifications in the breast according to their diam eters and distribution
1.4 统计方法
用SPSS 10.0 统计软件进行双尾t 检验,比较乳腺片上目标钙化簇取净的病灶与未能取净病灶大小有无差异。以P <0.05 为差异具有统计学意义。
2 结果
2.1 122 个微钙化灶活检病理结果
恶性病灶有27 个(22.1%,27/122),其中导管原位癌18 个(66.7%,18/27),浸润性乳腺癌9 个(33.3%,9/27)。不典型导管增生2 个(1.6%, 2/122)。良性病灶93 个(76.2%,93/122)。
2.2 活检前后的乳腺摄影片结果
66 处病灶(54.1%,66/122)是单簇性微钙化。在A 组中(直径<10 mm 单簇钙化,n=26),23 处(88.5%)病灶被取净;B 组中(直径10 ~20 mm 单簇钙化,n=22),15 处(68.2%)病灶被取净(图2);而在C 组中(直径>20 mm 单簇钙化,n=18)没有病灶能被取净(图3,表1)。将单簇钙化灶和多簇钙化的目标灶一起统计,直径<20 mm 的钙化簇中78%(64/82)被取净。
钙化簇的最长径平均为13 mm(范围3 ~50 mm)。乳腺摄影片显示钙化被取净的病灶明显小于未取干净的钙化簇,前者的平均长径为(8.1±4.3)mm, 后者的平均长径(19.3±9.8)mm(t=1.98,P <0.01)。
多簇性钙化灶56 个(D 组), 占病灶总数的45.9%(56/122)。在每个乳房的多簇性钙化灶中,我们选择最可疑的病灶为活检目标。12 个患者在一侧乳房内分别对2 处可疑钙化灶进行了活检,其中6 个患者的2 处活检结果均为良性,3 个患者2处活检结果为1 良1 恶,3 个患者2 处活检结果均为恶性(图4)。

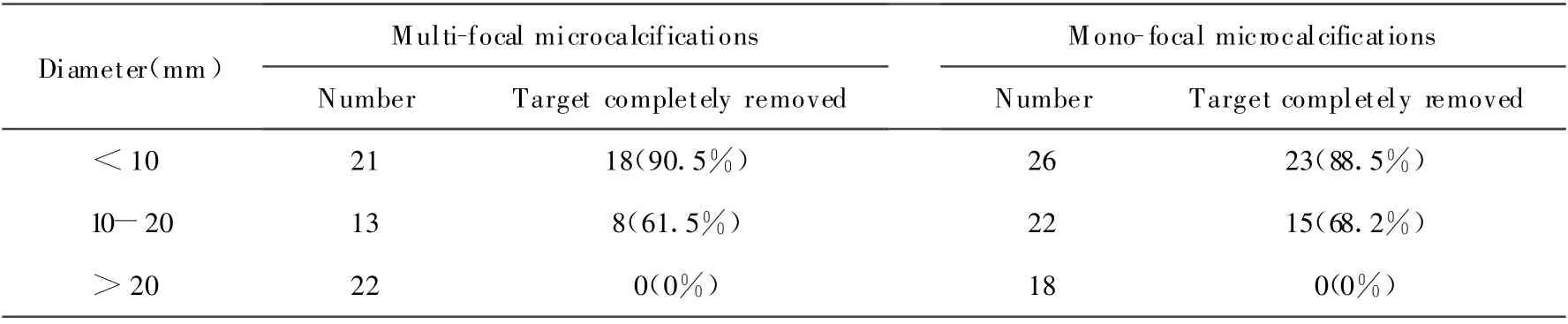
表1 122 个乳腺微钙化簇活检后乳腺摄影片上显示病灶清除的情况Table 1 Outcome of breast microcalcifications m am mographically rem oved in biopsy from 122 lesions
图4 64 岁女性患者右乳多簇性微钙化灶活检Fig.4 64-year-old w oman undergoing SVAB for m ulti-focal microcalcifications in the right breast
2.3 并发症
所有患者都能耐受检查,唯一的并发症是活检带来的血肿,其中只有4 例患者的血肿直径>20 mm。发生血肿的患者经过保守治疗后血肿吸收,未手术治疗。
3 讨论
本研究所用的Gel M ark Ultra 和MicroM arkⅡ两种标记夹都具有美国食品药品监督管理局(FDA)的安全许可,是可以长期安全放置体内的标记物。金属标记夹与其他的方法,如炭标记[9]、放射性种子置入[10]和血肿[8]相比,具有显像简便、清晰,安全又持久的优点。乳腺定位活检后,如果活检病理结果是恶性,即使乳腺片显示钙化灶被取净或化疗后病灶消失,标记夹仍能有效标明活检区域,有助于准确切除, 减少切缘阳性率和降低术后复发率[11-12]。而且在活检术后的X 线片中,标记夹能标记病灶部位,对病理医生也很有帮助。如果活检病理结果是良性,标记夹能显示原病灶的部位,用于长期随访,判断病灶的稳定性,以防活检假阴性的发生。
从最早的文献报道[6],标记夹放置的目的就是标记那些影像学上活检取干净的病灶。11-gauge真空辅助活检针较以往的活检技术可以取得更多的组织量,小病灶在活检后失去影像学踪迹的发生率提高到46%~89%[3,13]。但是影像学上的“取净”并不代表组织的完全清除,有报道称50%~80%的影像学上清除的恶性病灶在手术切除的组织中仍可看到残余癌[14-15],因此活检病理结果恶性的病灶仍需要进一步手术切除。一方面是因为乳腺摄影片不能确定病灶的边缘,恶性病变可以存在于非钙化区[13-14]。另一方面乳腺摄影片只能显示大于150 μm 的钙化,那些乳腺片中没有钙化的肿瘤,显微镜下41%在肿瘤或邻近组织内可见到钙化[16]。本组病例,57.5%的目标钙化灶在活检后钙化消失,在直径小于20 mm 的病灶中钙化被取净的比例更高达78%。换言之, 如果不放置标记夹,则有可能高达78%的小钙化簇在活检后不能识别病灶部位,给手术定位和复查带来困难。
但是在活检过程中受到视野的局限和血肿的干扰判断钙化灶是否被取干净有一定难度,我们可以从活检前的乳腺片病灶的大小和分布特点预测该病灶是否有必要放置标记夹,以减少操作中的盲目性。为了更确切的识别原病灶的部位,我们推荐在直径小于20 mm 的单簇性微钙化灶(第一组和第二组)活检中常规放置标记夹。
标记夹也不需要每个活检处都放置,我们的结果显示对于直径大于20 mm 的钙化簇,11-gauge 活检针不能将整个钙化簇取净,可以根据残留的钙化灶定位病变,没有必要放置标记夹。
乳房多簇性钙化是常见的X 线征象,除了血管的轨道状钙化、规则圆形、环形钙化和爆米花样钙化可以肯定是良性钙化灶外,很多钙化单从影像学特征很难判断其病理性质。在我们的资料中,45.9%的病灶为多簇钙化。这些多簇钙化的性质也不尽相同。我们有12 例患者在同一侧乳房的2 处钙化灶分别活检,其中6 个(50%)患者的2 处活检结果中至少1 处为恶性。因此,对于多簇性钙化灶,尤其是位于同一象限的多簇性钙化灶,不管钙化灶有无取净,我们都推荐常规放置标记夹,最好是不同形状的标记夹。这样,标记夹可以更准确地指示活检部位是具体哪一处钙化,有助于精确的手术切除。
为了更有效率、有目的地放置标记夹,我们推荐对于直径<20 mm 的钙化簇和同乳多簇性钙化灶,在活检时放置标记夹标识病灶部位用于长期随访或手术定位。
[1] Kettritz U,M orack G,Decker T.Stereotactic vacuum-assisted breast biopsies in 500 w om en w ith microcalcifications:radiological and pathological correlations[J] .Eur J Radiol,2005,55(2):270-276.
[2] Kettritz U,Rotter K,Schreer I,et al.Stereotactic vacuum-assisted breast biopsy in 2 874 patients:a multicenter study[J] .Cancer,2004,100(2):245-251.
[3] Rotter K,H aentschel G,Koethe D,et al.Evaluation of m ammographic and clinical follow-up after 755 stereotactic vacuum-assisted breast biopsies[J] .Am J Surg,2003,186(2):134-142.
[4] Rosen E L, Vo T T .Metallic clip deployment during stereotactic breast biopsy :retrospective analy sis[J] .Radiology,2001,218(2):510-516.
[5] Margolin F R,Kaufm an L, Denny S R, et al.Metallic marker placement after stereotactic core biopsy of breast calcifications:com parison of tw o clips and deployment techniques[J] .AJR,2003,181(6):1685-1690.
[6] Burbank F, Forcier N.Tissue marking clip for stereotactic breast biopsy :initial placem ent accuracy ,long-term stability,and usefulness as a guide for w ire localization[J] .Radiology,1997,205(2):407-415.
[7] Schulz-Wendtland R,Heyw ang-Kobrunner S H ,Aichinger U,et al.Verbessert die Clipmarkierung im Rahmen der sonographischen oder stereotaktischen Brustbiopsie die Verlaufsbeurteilung kleiner Mam maläsionen und Lokalisation von Tumoren nach Chemotherapie?[J] .Fortschr Rö ntgenstr,2002,174(5):620-624.
[8] Kass R,Kumar G,Klim berg V S,et al.Clip migration in stereotactic biopsy[J] .Am J Surg,2002,184(4):325-331.
[9] Mullen D J,Eisen R N,Newm an R D,et al.The use of carbon marking after stereotactic large-core-needle breast biopsy[J] .Radiology,2001,218(1):255-260.
[10] Gray R J,Salud C, Nguyen K, et al.Randomized prospective evaluation of a novel technique for biopsy or lumpectomy of nonpalpable breast lesions:radioactive seed versus w ire localization[J] .Ann Surg Oncol,2001,8(9):711-715.
[11] Dash N,Chafin S H,Johnson R R,et al.Usefulness of tissue marker clips in patients undergoing neoadjuvant chemotherapy for breast cancer[J] .AJR,1999,173(4):911-917.
[12] Nurko J, Mancino A T, Whitacre E, et al.Surgical benefits conveyed by biopsy site marking system using ultrasound localization[J] .Am J Surg,2005,190(4):618-622.
[13] Lee C H, Carter D, Philpotts L E,et al.Ductal carcinom a in situ diagnosed w ith stereotactic core needle biopsy:can invasion be predicted?[J] .Radiology,2000,217(2):466-470.
[14] Liberman L,Kaplan J B,Abramson A F,et al.To excise or to sample the mammographic target:w hat is the goal of stereotactic 11-gauge vacuum-assisted breast biopsy?[J] .AJR,2002,179(3):679-683.
[15] Liberman L,Dershaw D D, Rosen P P,et al.Percutaneous removal of malignant mammog raphic lesions at stereotactic vacuum-assisted biopsy[J] .Radiology,1998,206(3):711-715.
[16] Koskela A K,Sudah M, Berg M H, et al.Add-on device for stereotactic co re-needle breast biopsy :how many biopsy specimens are needed for a reliable diagnosis? [J] .Radiology,2005,236(3):801-809.
