黑松冠层节肢动物群落的组成与结构
武海卫,骆有庆,石 娟,陈卫平,严晓素,蒋 平
(1.广东省林业科学研究院,广东 广州 510520;2.北京林业大学 省部共建森林培育与保护教育部重点实验室北京 100083;3.浙江省林业有害生物防治检疫局,浙江 杭州 310020)
黑松Pinus thunbergii生长快,抗风力强,抗海雾,耐干旱瘠薄,对于恶劣气候抗性较强,具有防风沙和保持水土的效能,是中国东部沿海营造海岸林和沿海荒山、荒滩造林的先锋树种。但是,由于该树种是松材线虫病Bursaphelenchus xylophilus的主要感病树种[1],因此,自松材线虫病发生以来,黑松遭到毁灭性的破坏。围绕松材线虫的种群形成机制,关于媒介昆虫(主要是松褐天牛Monochamus alternatus)在黑松树上的发生规律[2-7]、黑松内栖真菌区系[8]已有大量的研究,但有关黑松冠层节肢动物群落的组成和结构特点的探讨少有报道。在我国松材线虫病的主要媒介昆虫——松褐天牛通常选择树势衰弱的林木危害[9],而黑松冠层部分节肢动物的取食危害对树势的影响也未见报道。作者曾对马尾松Pinus massoniana冠层节肢动物群落的组成和结构进行过报道[10],现在又以受松材线虫危害的黑松为研究对象,探讨了黑松冠层的节肢动物群落及各功能集团的组成和结构特点,为研究松材线虫种群形成机制提供一定的理论依据,同时对黑松松材线虫病的生物防治具有重要意义。
1 材料和方法
1.1 试验地概况
试验地设在浙江省舟山市,处于浙江省滨海岛屿地带,属丘陵地貌,北亚热带南缘季风海洋型气候,冬暖夏凉,热量较丰,年平均气温为16.0℃,年降水量在1 500 mm左右,年相对湿度大于80%。舟山丘陵山地以松林、松栎混交林为主。土壤分布具有岛屿的特殊性,从滨海到丘陵顶部,呈环状分布。土壤类型多样,主要有红壤滨海盐土、水稻土、粗骨土、黄壤等。

表1 黑松冠层节肢动物群落的组成Table 1 Composition of canopy arthropods of Pinus thunbergii
1.2 抽样调查方法
分别在浙江省舟山市的定海区大沙村茶苓茗山和普陀区龙新村林场设立了2块30 m×30 m固定标准地,在每块标准地中,按棋盘式取样法选取黑松各30株进行标记,自2006年5月至9月,隔30 d调查1次。调查方法用武海卫等[10]的方法。
1.3 群落功能集团的划分
群落功能集团的划分采用 Ødegaard[11]和Thiago等[12]的方法,并依据节肢动物的取食特点,将收集的物种鉴定为生态种(特别是蜘蛛类,因为其幼蛛难以鉴定),同时,将所有的种类划分为5个类群:食叶害虫、枝梢害虫、捕食性昆虫、蜘蛛类和游走性类群。游走性类群包括多数腐生性的并且明确不寄居在植被上或和寄住植物无明确关系的种类。
1.4 节肢动物群落物种丰富度估计方法
节肢动物群落物种丰富度估计采用 Chao 1指数[13-14]。Chao 1指数采用EstimateS 8.0软件经50次随机化运算求得[15]。
2 结果与分析
2.1 黑松冠层节肢动物群落的组成
经系统调查,黑松冠层节肢动物的主要害虫种类有浙江黑松叶蜂Nesodiprion zhejiangensis(约占总个体数的45.01%),草履蚧 Drosicha corpulenta(约占总个体数的21.68%),松沫蝉 Aphrophora flavipes(约占总个体数的3.54%),松褐天牛(约占总个体数的3.48%)等。黑松冠层节肢动物群落的组成见表1,可以看出,供调查的黑松冠层中,节肢动物共有12目45科95种,共计3 077个个体。优势类群为蜘蛛目、鞘翅目、鳞翅目和半翅目,其累计物种数量达到总物种数量的80%。经50次随机化运算估计共有(146.57±22.84)种(Chao 1指数)。从功能集团的组成上看,食叶害虫11科16种1 477个,枝梢害虫8科18种1 186个,捕食性昆虫10科17种89头,蜘蛛类11科33种287只,游走性类群5科13种38个,可见食叶害虫和枝梢害虫等传统松林害虫仍是黑松冠层的主要组成部分。
2.2 黑松冠层节肢动物群落的空间结构
2.2.1 黑松冠层节肢动物的垂直结构 黑松冠层节肢动物各功能集团的垂直分布见图1。总体上看,除游走类群外,总群落及其他4个功能集团的物种多样性指数和物种丰富度指数波动性都不显著,但同一层次中各功能集团的多样性指数有着较大的差异。物种多样性指数和物种丰富度指数在上中下3个层次中均为蜘蛛类>捕食性昆虫>枝梢害虫>食叶害虫,而优势集中性指数则表现出相反的趋势,即蜘蛛类<捕食性昆虫<枝梢害虫<食叶害虫。可见,捕食性类群(包括蜘蛛和捕食性昆虫)在各个层次上对于冠层害虫均有较高的跟随控制能力。对于各功能集团的垂直分布而言,蜘蛛类和捕食性昆虫的物种多样性指数以树冠中层最高,在下层的优势集中性最高;枝梢害虫以上层的物种多样性指数最高,在下层优势集中性最高;食叶害虫和游走性类群则是在下层的物种多样性指数最高而以上层的优势集中性最高。综合全部多样性指数的变化可以看出,黑松冠层有着丰富的捕食性天敌类群,主要分布在树冠的中下层。害虫类群(包括食叶害虫和枝梢害虫)同样主要分布在树冠的中下层,其物种数量虽不及捕食性类群多,但优势集中性较高,不利于群落的自我调控。
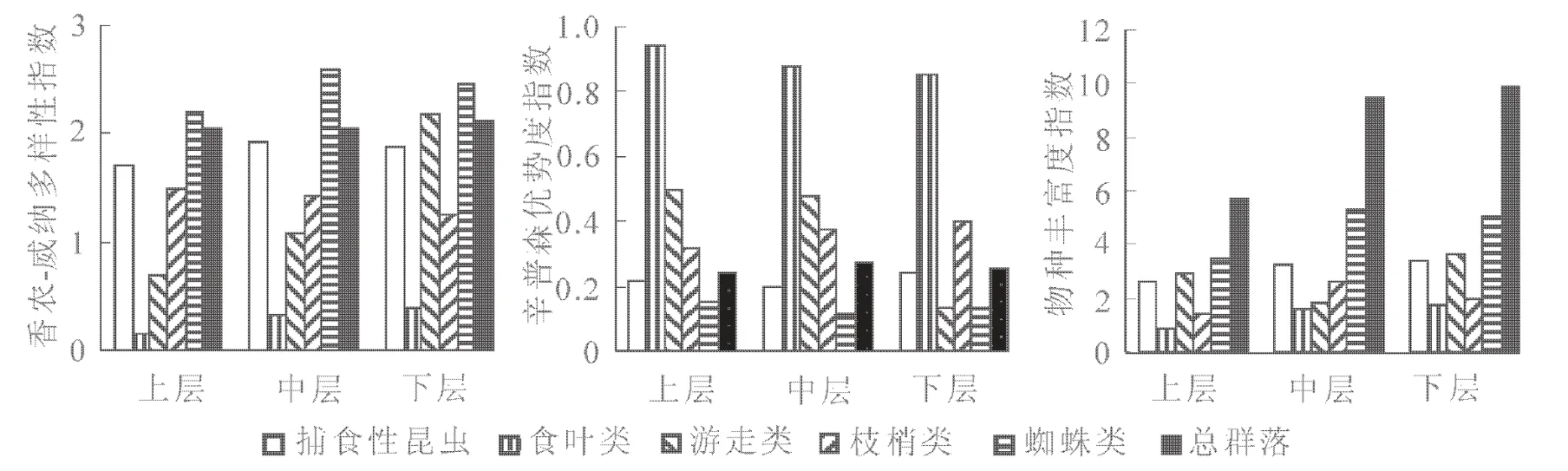
图1 黑松冠层节肢动物垂直分布Figure 1 Vertical distribution of canopy arthropods of Pinus thunbergii

图2 黑松冠层节肢动物水平分布Figure 2 Horizontal distribution of canopy arthropods of Pinus thunbergii
2.2.2 黑松冠层节肢动物群落的水平结构 黑松冠层节肢动物各功能集团在黑松树冠东西南北4个方位的水平分布见图2。可以看出,在4个方位上,蜘蛛类的物种多样性指数和丰富度指数均高于其他类群,而食叶害虫在优势集中性上均高于其他类群,但多样性指数和物种丰富度指数均低于其他类群。这说明在不同方位上,蜘蛛类群对于减少冠层食叶害虫的取食压力发挥着极为重要的生态效能。从物种多样性指数的波动情况看,除捕食性昆虫外,总群落及其他各类群的多样性指数和优势集中性指数波动行均比较平缓,说明这些类群对方位的选择性较小。从捕食性昆虫物种丰富度的分布情况来看,其主要分布在向阳的东部、南部和西部。这估计与其生活习性有关。
2.3 黑松冠层节肢动物群落的时序动态
黑松冠层节肢动物群落的时序动态见图3。从群落的物种多样性指数的变化趋势可以看出,黑松冠层节肢动物群落在7月物种多样性达到最高值并在随后的2个月中均保持较高的多样性水平。蜘蛛类在整个调查期的物种多样性指数均高于其他类群,并在5月和8月出现2个峰值,以9月最低。捕食性昆虫的物种多样性指数在8月达到最高,6月最低。枝梢害虫在7月的物种多样性最高,并在8月和9月均保持在较高的水平。食叶害虫则在6月就达到了峰值,并在随后的3个月中均有较高的物种多样性。而冠层的游走性类群在8月的多样性最高。

图3 黑松冠层节肢动物群落的时序动态Figure 3 Temporal dynamic of canopy arthropods of Pinus thunbergii in different months
从群落的优势集中性指数的变化趋势可以看出,冠层总群落在5月的优势集中性最高,7月降至最低,8月和9月保持在较为稳定的水平,可能与食叶害虫和枝梢害虫在5月较高的优势集中性有关。食叶害虫在其后的4个月中优势集中性较为稳定,枝梢害虫在7月降至最低后继而重新增加,至9月又达到1个较高的峰值。而蜘蛛类和捕食性昆虫等捕食性类群在调查的各个月份中的优势集中性均比较稳定,两者的变化趋势相似,仅在8月有所降低。游走性类群的优势集中性则是在7月达到峰值,8月降至低谷后在9月重新有所增加。
从群落的物种丰富度指数的变化趋势可以看出,冠层总群落的物种丰富度以7月最高,6-8月是整个冠层节肢动物物种最为丰富的阶段。对于各功能集团,以食叶害虫和枝梢害虫为主的害虫类群在7月物种丰富度最高,6-8月是其危害最为严重的时期。而以捕食性昆虫和蜘蛛类为主的捕食性类群在各个月份的物种丰富度均高于害虫类群,这对于压低害虫的虫口密度,控制冠层害虫的成灾具有重要作用。
3 小结与讨论
从黑松冠层节肢动物各功能集团的个体数量组成可以看出,食叶害虫和枝梢害虫等传统松林害虫仍是黑松冠层节肢动物群落的主要组成部分。调查中发现的优势种类如浙江黑松叶蜂和松褐天牛均对黑松林的健康构成巨大的威胁,特别是松褐天牛,其在冠层嫩梢的补充营养有致使松材线虫再度浸染的可能[16-17],今后应加强对这 2种害虫的监测。
黑松冠层节肢动物的垂直结构表明。除游走性类群外,总群落及其他4个功能集团的垂直分布差异性不大,但同一层次中各功能集团的多样性指数有着较大的差异。捕食性天敌类群(包括蜘蛛和捕食性昆虫),主要分布在树冠的中下层。害虫类群(包括食叶害虫和枝梢害虫)同样主要分布在树冠的中下层。从水平结构上看,除捕食性昆虫外,总群落及其他各类群对方位的选择性较小,捕食性昆虫主要分布在向阳的东部、南部和西部。这可能与其生活习性有关。
节肢动物群落的时序动态表明,以食叶害虫和枝梢害虫为主的害虫类群在5月的优势集中性最高,在7月物种丰富度最高,6-8月是危害最为严重的时期。而蜘蛛类和捕食性昆虫等捕食性类群在调查的各个月份中的优势集中性均比较稳定,两者的变化趋势相似,仅在8月有所降低。害虫类群的物种数量虽不及捕食性类群多,但优势集中性较高,今后需加强对黑松林的抚育管理,合理利用捕食性天敌的自然控制作用,同时严防优势种类的害虫种群扩张,将其控制在成灾水平以下。
目前,单一植物上的节肢动物物种丰富度的研究已有很多报道[10,18-21],但是很少有涉及物种丰富度和取样样本大小之间的关系。Novotny等[22]对15个种类共6 800株榕树Ficus microcarpa上节肢动物群落的调查研究证实,在种内和种间,物种丰富度和样本大小存在着明显的相关性。笔者仅调查了不同林龄的60株黑松,获取节肢动物共95种,采用Chao 1指数经50次随机化运算估计有(146.57±22.84)种,实测物种数量仅占估计值的64.82%,估计这与冠层微生境被取样的比例有关。调查中微生境被取样的比例是一个很难确定的参数,尽管许多研究限定在活立木上,但仅冠层就有很多的微生境[23],比如Ødegaard[19]曾在巴拿马森林中一种藤蔓植物的卷须上发现了65种未知种类。所以,今后在更大生境尺度上黑松冠层节肢动物群落的组成和结构特点需做进一步探讨。
致谢:感谢北京林业大学李镇宇教授和中国林业科学研究院张培毅研究员在标本鉴定中提供的大力帮助。
[1]杨宝君,潘宏阳,汤坚,等.松材线虫病[M].北京:中国林业出版社,2003.
[2]来燕学,张世渊,黄华正,等. 松墨天牛在松树枯萎中的作用[J].浙江林学院学报,1996,13(1):75-81.LAI Yanxue,ZHANG Shiyuan,HUANG Huazheng,et al.Monochamus alternatus withered pine[J].J Zhejiang For Coll,1996,13(1):75-81.
[3]宋世涵,崔锡明,刘德禄,等.松墨天牛发生规律的调查[J].广东林业科技,1993(2):40-45.SONG Shihan,CUI Ximing,LIU Delu,et al.Survey on occurrence regularity of Monochamus alternatus Hope[J].J Guangdong For Sci Technol,1993(2):40-45.
[4]聂绍芳,林仲桂,彭珍宝.南岳景区松墨天牛的发生规律[J].中南林学院学报,2000,20(4):96-98.NIE Shaofang,LIN Zhonggui,PENG Zhenbao.The occurrence law of Monochamus alternatus Hope in scenic area of Nanyue Mountain[J].J Central South For Univ,2000,20(4):96-98.
[5]陈顺立,王玲萍.松墨天牛幼虫在马尾松树上垂直分布的研究[J].福建林学院学报,2001,21(4):297-300.CHEN Shunli,WANG Lingping.Study on the vertical distribution of Monochamus alternatus Hope larvae on Pinus massoniana[J].J Fujian Coll For,2001,21(4):297-300.
[6]崔鹏程,高大海,童永久,等.松褐天牛补充营养时在岱山黑松树上发生规律的调查[J].浙江林业科技,2001,21(3):22-24.CUI Pengcheng,GAO Dahai,TONG Yongjiu,et al.Investigation on the maturation feeding in Pinus thunbergii in Mountain Dai[J].J Zhejiang For Sci Technol,2001,21(3):22-24.
[7]孔祥贵.松褐天牛为害黑松的调查及防治试验[J].安徽林业科技,2003(3):31-32.KONG Xianggui.Investigation and control on Monochamus alternatus Hope in Pinus thunbergii[J].J Anhui For Sci Technol,2003(3):31-32.
[8]曾凡勇,骆有庆,吕全,等.松材线虫入侵的黑松内栖真菌区系初步研究[J].林业科学研究,2006,19(4):537-540.ZENG Fanyong,LUO Youqing,LÜ Quan,et al.Studies on the Mycoflora of Pinus thunbergii infected by Bursaphelenchus xylophilus[J].For Res,2006,19(4):537-540.
[9]丁玉洲,吕传海,韩斌,等.树木生长势与松墨天牛种群密度及松材线虫发病程度关系[J].应用生态学报,2001,12(3):351-354.DING Yuzhou,LÜ Chuanhai,HAN Bin,et al.Relationship between growth potential of pine,population density of Monochamus alternatus and pathogenicity of Bursaphelenchus xylophilus[J].Chin J Appl Ecol,2001,12(3):351-354.
[10]武海卫,骆有庆,石娟,等.不同林龄马尾松冠层节肢动物群落组成和结构[J].生态学报,2009,29(2):599-605.WU Haiwei,LUO Youqing,SHI Juan,et al.Composition and structure of canopy arthropods in young and old Pinus massoniana stands[J].Acta Ecol Sin,2009,29(2):599-605.
[11]ØDEGAARD F.Species richness of phytophagous beetles in the tropical tree Brosimum utile(Moraceae):the effects of sampling strategy and the problem of tourists[J].Ecol Entomol,2004,29:76-88.
[12]THIAGO J I,HERALDO L V.Ants and plant size shape the structure of the arthropod community of Hirtella myrmecophila,an Amazonian ant-plant[J].Ecol Entomol,2005,30:650-656.
[13]CHAO A.Non-parametric estimation of the number of classes in a population[J].Scand J Statist,1984,11:265-270.
[14]COLWELL R K,CODDINGTON J A.Estimating terrestrial biodiversity through extrapolation[J].Philos Trans Royal Soc:B,1994,345:101-118.
[15]COLWELL R K.Estimate S:Statistical Estimation of Species Richness and Shared Species from Sample[EB/OL].(2006-10-26)[2007-08-25]http://purl.oclc.org/estimates.
[16]李广武,邵桂英,俞伯能.松墨天牛的初步观察[J].昆虫知识,1986,23(4):169-170.LI Guangwu,SHAO Guiying,YU Boneng.Primary observation on Monochamus alternatus[J].Chin Bull Entomol,1986,23(4):169-170.
[17]朱克恭.松材线虫病研究综述[J].世界林业研究,1995,8(3):28-33.ZHU Kegong.Studies on pine disease caused by Bursaphelenchus xylophilus:a review[J].World For Res,1995,8(3):28-33.
[18]BARONE J A.Host-specificity of folivorous insects in a moist tropical forest[J].J Anim Ecol,1998,67:400-409.
[19]ØDEGAARD F.The relative importance of trees versus lianas as hosts for phytophagous beetles(Coleoptera)in tropical forests[J].J Biogeogr,2000,27:283-296.
[20]BASSET Y.Invertebrates in the canopy of tropical rain forests-how much do we really know?[J].Plant Ecol,2001,153:87-107.
[21]NOVOTNY V,BASSET Y,MILLER S E,et al.Host specialization of leaf-chewing insects in a New Guinea rainforest[J].J Anim Ecol,2002,71:400-412.
[22]NOVOTNY V,MISSA O.Local versus regional species richness in tropical insects:one lowland site compared with the island of New Guinea[J].Ecol Entomol,2000,25:445-451.
[23]LOWMAN M,TAYLOR P,BLOCK N.Vertical stratification of small mammals and insects in the canopy of a temperate deciduous forest:a reversal of tropical forest distribution[J].Selbyana,1993,14:25.

