Labrasol对葛根素角膜透过性的研究*
舒乐新,赵启铎,刘志东,李 琳,宋西卫,李 楠
(1.天津中医药大学现代中药发现与制剂技术教育部工程研究中心研究生,天津 300193;2.天津中医药大学,天津 300193)
角膜上皮是药物眼部吸收的主要屏障,角膜上皮的渗透性较差。常规滴眼剂存在滞留时间短、生物利用度低(仅为1%~10%)、患者顺应性差等问题。应用渗透促进剂能够改善角膜的透过性,增加药物的跨膜吸收[1]。
葛根素(PUE)是一种异黄酮类化合物,可从豆科植物野葛[Puerarialobata(Willd.)Ohwi]的干燥根中提取得到。葛根素具有β受体阻滞作用和改善微循环作用,近年来在青光眼的治疗中得到了广泛地应用。辛酸癸酸聚乙二醇甘油酯(Labrasol)是一种新型的吸收促进剂,被广泛用于口服和经皮给药系统[2]。
实验主要考察将Labrasol作为渗透促进剂应用于眼用制剂,前期实验考察了Labrasol在质量浓度为0.5%~3%内没有刺激性[3]。采用离体角膜透过技术,研究其对葛根素的角膜透过率的影响,并对Labrasol的作用机制进行探讨,从而明确Labrasol作为一种新型的吸收促进剂是否有好的眼用促渗作用,为以后的眼用促渗剂提供基础。
1 仪器与试药
TK-20A型透皮扩散试验仪(上海锴凯科技贸易有限公司),改良的Franz扩散池(上海锴凯科技贸易有限公司),Milli-Q 超纯水系统(Millipore,美国),AX205电子天平(METTLER TOLEDO,瑞士),高效液相色(HPLC)谱仪(岛津,SPD-10AvpUV-VIS DETECTOR,LC -10ATvp,LIQUID CHROMATOGRAPH,日本)。葛根素对照品(天津马克生物技术有限公司纯度99%),葛根素原料药(纯度>90%,西安赛帮医药有限公司),Labrasol(Gattefosse,法国),其他试剂均为分析纯。
2 方法
2.1 扩散介质 以谷胱甘肽一碳酸氢钠林格溶液(GBR)为扩散介质。文献[4]报道,该生理溶液可保存离体角膜达6 h。它由2部分溶液组成,一部分含氯化钠12.400 g/L、氯化钾0.716 g/L、磷酸二氢钠0.206 g/L、碳酸氢钠4.908 g/L;另一部分含氯化钙0.230 g/L、氯化镁 0.318 g/L、葡萄糖 1.800 g/L、谷胱甘肽(氧化型)0.184 g/L。上述2溶液低温储存,用前等量混合。
2.2 Labrasol对葛根素角膜透过率的影响 将家兔耳缘静脉注射空气致死。在死后20 min内用眼科手术剪和镊子小心分离出角膜,除去巩膜、虹膜、睫状体等多余组织。将新鲜离体角膜小心固定在Franz扩散池的供给池和接受池之间,使上皮层面向供给池,在接受池中加入新鲜配制的GBR溶液4.5 mL,在供给池中加入含0.2%药物的不同浓度的Labrasol溶液0.5 mL。装置置于透皮扩散实验仪中,温度控制在(37±1)℃。实验开始后,分别在 40、80、120、160、200、240 min从接受池中取样4.5 mL,同时补充等体积同温的GBR溶液,样品经0.45 μm微孔滤膜过滤后,用HPLC测定。
2.3 数据处理 单位面积累积透过量Q可由下式求算:
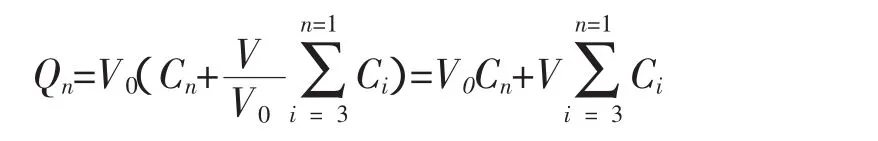
其中Cn为时间药物的测定浓度,Ci为时间前的测定浓度,V0为接受池中溶液体积,V为取样体积。表观渗透系数(Papp,cm/s)定义为:其中C0为供给池初始药物浓度;A为有效透过面积;△Q/△t可由累积透过量—时间曲线稳态部分的斜率求得。
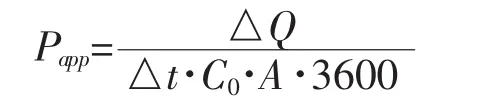
表观渗透系数以两独立样本t检验进行统计学分析。
2.4 角膜水化值的测定 将体外实验后暴露于扩散介质的角膜区域称其质量,记为m;60℃干燥15 h后再次称其质量,记为ma。角膜水化值按下式计算:
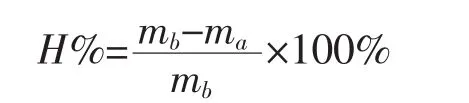
2.5 样品的测定
2.5.1 色谱条件 HPLC法测定样品中葛根素含量。色谱柱:Diamond DIKMA ODS-C18(200 mm×4.6 mm,5 μm),流动相:甲醇:1%(质量分数)柠檬酸溶液(体积比 35∶65),流速:1 mL/min,检测波长:250 nm,进样量:20 μL,柱温:30 ℃,色谱图见图1。

2.5.2 专属性考察 取不加药物的空白角膜内容物GBR溶液20 μL,注入高效液相中,色谱图见图2。

如图可见空白角膜内容物对葛根素无干扰。
2.5.3 方法学考察 精密配制一系列质量浓度分别为0.016~0.8 mg/L和0.8~16 mg/L的葛根素GBR溶液,进样20 μL,记录峰面积。样品质量浓度与峰面积的标准回归方程分别为 A=1.1061×104C+552.33(r=0.9999)和 A=1.16259×105C- 2.0998×103(r=0.9999)。由相关系数可知样品质量浓度与峰面积线性关系良好。分别在2个范围内配低、中、高3个质量浓度的葛根素GBR溶液0.032、0.128、0.560mg/L和1.6、8.0、16.0 mg/L。测得日内精密度峰面积的相对标准偏差分别为2.0%、1.2%、0.1%和0.5%、0.7%、0.5%。日间精密度RSD分别为1.2%、0.9%、0.6%和0.4%、1.0%、0.7%,说明仪器精密度良好。
3 结果
3.1 Labrasol对葛根素角膜透过性的影响 本实验以0.2%的葛根素GBR液为对照,分别考察了0.5%、1%、1.5%、2%、3%的 Labrasol为促渗剂时葛根素的角膜透过性。葛根素离体角膜透过参数见表1,透过曲线方程图见图3。
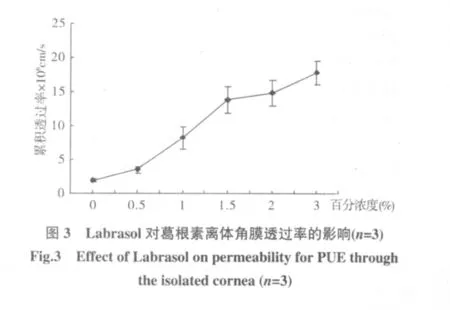
如图3,葛根素的表观渗透系数随着Labrasol浓度的升高而增大,Labrasol浓度为 0.5%、1%、1.5%、2%、3%时,葛根素的表观渗透系数分别是对照组的 1.87倍、4.41倍、7.42倍、8.02倍、9.60倍,与对照组比都有显著性差异。
3.2 Labrasol对角膜水化值的影响 角膜水化值是体外评价物质对该组织刺激性的重要指标,以此来考察促渗剂对角膜的损伤,正常的角膜水化值为76%~80%,超过83%,即可判定角膜受到一定程度的损伤[5]。实验中葛根素不同浓度的Labrasol对角膜水化值没有显著影响,表明实验过程中没有对角膜上皮细胞和内皮细胞造成损伤,见表1。
表1 Labrasol对葛根素离体角膜透过参数影响(±s,n=3)Tab.1 The Effect of Labrasol on the transcorneal permeability coefficient of PUE(±s,n=3)
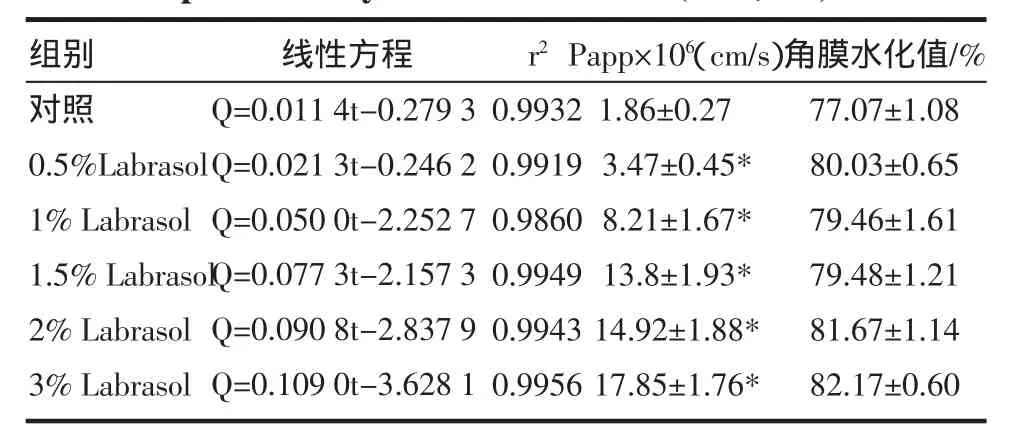
表1 Labrasol对葛根素离体角膜透过参数影响(±s,n=3)Tab.1 The Effect of Labrasol on the transcorneal permeability coefficient of PUE(±s,n=3)
注:与对照组比较,*P<0.01。
r2组别对照0.5%Labrasol 1%Labrasol 1.5%Labrasol 2%Labrasol 3%Labrasol线性方程Q=0.011 4t-0.="tb Q=0.021 3t-0.21 t Q=0.050 0t-2.50 t Q=0.077 3t-2.77 t Q=0.090 8t-2.90 t Q=0.109 0t-3.09 t 0.99320.99190.98600.99490.99430.9956 Papp×106(cm/s)1.86±0.273.47±0.45*8.21±1.67*13.8±1.93*14.92±1.88*17.85±1.76*角膜水化值/%77.07±1.0880.03±0.6579.46±1.6179.48±1.2181.67±1.1482.17±0.60
4 讨论
实验考察了0.5%~3%的Labrasol对葛根素的角膜透过性,结果葛根素的表观渗透系数随着Labra sol浓度的增加而增大,是对照组的1.87倍到9.60倍,与空白比都有显著性差异(P<0.01),表明Labrasol对葛根素有很好的促渗作用。
Labrasol增加药物角膜渗透性的机制主要有两种。第1种,通过破坏角膜细胞膜,或者通过渗透进入细胞膜,或者通过从细胞膜提取脂溶性的物质如胆固醇和磷脂来增加药物的角膜透过量。第2种,作为药物载体,通过保持药物在溶液中的亲水性,经过黏蛋白层将药物传递到角膜表面,然后以扩散的方式透过角膜进入眼组织。
由实验结果可知,葛根素的表观渗透系数随着Labrasol浓度的升高而增大,当Labrasol的浓度为1.5%时达到一个平台区,统计学比较组间差异1.5%、2%与 3%,这 3组间没有差异(P>0.05),表明在统计意义上没有增大,达到了平衡。因此,Labrasol的作用机制可能是两种作用机制共同作用的结果。当Labrasol的浓度较低时,葛根素的表观渗透系数随Labrasol浓度的增加而增加,第1种作用机制可能起主要作用。当Labrasol的浓度较高时,第2种作用机制可能起主要作用。当存在过量的Labrasol时,葛根素的表观渗透系数随Labrasol浓度的增加而不再增加,达到平衡。
由此表明一定浓度的Labrasol可显著提高葛根素的角膜透过率,且对角膜无刺激性,因此在实践中可被广泛应用。
[1]ASHIM K.Ophthalmic Drug Delevery Systems[M].2nd Missouri,USA:Marcel Dekker,Inc,2000:218-220.
[2]Sateesh K,Ramesh P.Nanoemulsions as Versatile Formulations for Paclitaxel Delivery:Peroral and Dermal Delivery Studies in Rats[J].J Invest Dermatol,2007,127(1):154-159.
[3]张欣华,刘志东,张伯礼,等.Labrasol对兔眼刺激性评价[J].医药导报,2009,28(7):838-840.
[4]ROJANESEKUL Y,ROBINSON JR.Transport mechanisms of the cornea.Characterizatim of barrier permselectivity[J].Int J Pharm,1989,55(2-3):237-239.
[5]Saettone MF,Chetom P,Cerbai R,etal.Evaluation of ocular permeation enhancers in vitor effects on corneal transport of four blockers,and in ivtro/in vivo toxic activity[J].Int J Pharm,1996,142:103-109.

