止喘汤对哮喘大鼠气道炎症和气道重塑的影响*
张占锋,霍博雅
(1.河南省鄢陵县人民医院内科,鄢陵 461200;2.辽宁医学院第三医院中医科,锦州 121001)
哮喘是由多种细胞及细胞因子参与的慢性气道炎症性疾病,其发病率、病死率均呈逐年上升的趋势。哮喘反复发作可引起气道重塑,导致不可逆性气流阻塞及持续性气道高反应性,只有控制或者逆转了气道重塑,哮喘才可能得到真正意义上的控制。中医治疗哮喘有着丰富的临床经验,本实验通过对致敏大鼠反复雾化吸入抗原建立慢性哮喘模型,观察中药复方早期干预对哮喘大鼠气道炎症和重塑的影响。
1 材料与方法
1.1 实验动物分组及模型制备 8周龄SPF级雄性SD大鼠40只,体质量(200±20)g(辽宁医学院实验动物中心提供),随机分成4组随机分为4组:正常组、哮喘组、布地奈德(BUD)组和止喘汤组,每组10只。参照Holgate等[1]的方法复制大鼠慢性哮喘模型。第1、8天腹腔注射10%的卵蛋白(OVA)(GradeⅢOVA,SigmaA5378)混悬液1mL(内含OVA 100 mg、氢氧化铝100 mg)致敏,自15 d始分别将各组大鼠鼠置于30 cm×30 cm×40 cm有进出两口的有机玻璃箱内,以1%OVA溶液雾化吸入,0.5 mL/min,30 min/次,1次/d,共6周。止喘汤组:每次激发前30 min中药灌胃(取生药500 g,分别加8倍量的水,分别提取2次,每次1 h,过滤,常压浓缩至500mL,由辽宁医学院第三医院中药制剂室提供),按大鼠体质量(10 mL/kg)给予。BUD组:激发前30 min生理盐水灌胃及5 mL∶1 mg BUD(阿斯利康制药有限公司,批号国药准字 H20030410,规格 5 mL∶20 mg)雾化吸入。哮喘组生理盐水灌胃;正常组腹腔注射、灌胃及雾化吸入分别以生理盐水代替。以大鼠呼吸急促、口唇发绀、点头呼吸及站立不稳等表现为模型建立成功的标志。
1.2 标本采集 各组大鼠均于末次激发24 h内取材。20%乌拉坦5 mL/kg腹腔麻醉,剪开颈部皮肤,钝性分离颈动脉,取血2 mL置于乙二胺四乙酸(EDTA)抗凝管中,采用常规计数法测定白细胞总数及其分类。打开胸腔,结扎右主支气管,分离出颈部气管,参考文献[2]方法进行左侧支气管肺泡灌洗,将收集的支气管肺泡灌洗液(BAL)盛入15 mL塑料离心管(置于冰浴中),重复上述操作4次,收集全部 BAL(回收率>85%)计量后取少量在改良的Neubauer计数台上计数BAL中白细胞总数,余下的BAL 4℃离心(1500 r/min)10 min,取细胞沉淀涂片、瑞氏染色后在油镜下作白细胞分类计数。放血后取右肺中叶肺组织置于4%的多聚甲醛中抽气固定48 h后,进行脱水,透明,垂直于气道取材,石蜡包埋,切片,片厚4 μm,切片按HE常规染色步骤染色。
1.3 气道炎症和气道壁厚度测定 苏木精-伊红(HE)染色后,每组随机抽取10张切片,400倍光镜下选择内径100~200 μm的细支气管区,采集5处视野,计数单位气道面积(2200 μm2)的炎性细胞数,以评估气道炎症[3];每张切片选取3支内周长(支气管基底膜周径)为1000~3000 μm的膜性大、中级小支气管,在100倍光镜下参照文献[4]用病理图像分析系统,测定支气管基底膜周径(Pbm)、总管壁面积(Wat)、平滑肌面积(Wam),并用Pbm将测量值标准化,分别以Wat/Pbm、Wam/Pbm表示,代表相应管壁层的厚度。
2 结果
2.1 各组大鼠血、BAL中嗜酸性细胞计数的变化情况 哮喘组与正常组比较外周血、BAL中嗜酸粒细胞(EOS)明显升高(P<0.01);应用药物干预后,治疗组与哮喘组相比较,上述指标明显下降(P<0.01);止喘汤与BUD组比较上述指标间无统计学差异(P>0.05)。结果见表1-表2。
表1 各组间外周血白细胞总数及分类计数的比较(±s)Tab.1 Comparison of total and differential counts of Leukocyte in PB in different groups(±s)×109个/L
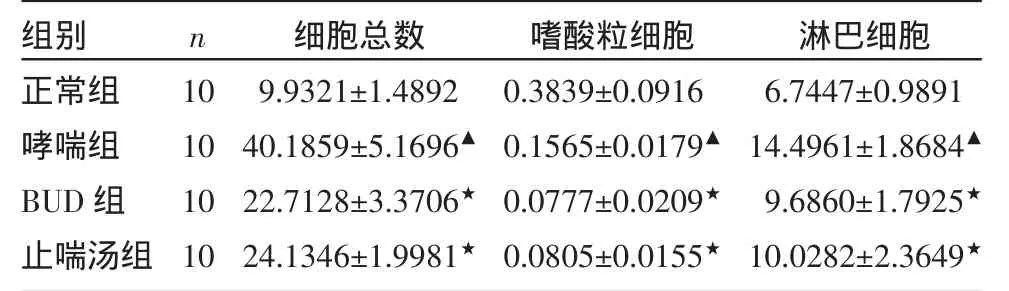
表1 各组间外周血白细胞总数及分类计数的比较(±s)Tab.1 Comparison of total and differential counts of Leukocyte in PB in different groups(±s)×109个/L
注:与正常组比较▲P<0.01,与哮喘组比较★P<0.01,与BUD组比较▼P>0.05。
组别正常组哮喘组BUD组止喘汤组n 10101010细胞总数9.9321±1.489240.1859±5.1696▲22.7128±3.3706★24.1346±1.9981★嗜酸粒细胞0.3839±0.09160.1565±0.0179▲0.0777±0.0209★0.0805±0.0155★淋巴细胞6.7447±0.989114.4961±1.8684▲9.6860±1.7925★10.0282±2.3649★
表2 各组间BAL白细胞总数及分类计数的比较Tab.2 Comparison of total and differential counts Leukocyte of BAL in different groups(±s)×109个/L

表2 各组间BAL白细胞总数及分类计数的比较Tab.2 Comparison of total and differential counts Leukocyte of BAL in different groups(±s)×109个/L
注:与正常组比较▲P<0.01,与哮喘组比较★P<0.01,与BUD组比较▼P>0.05。
组别正常组哮喘组BUD组止喘汤组n 10101010细胞总数3.6521±0.335910.5212±1.0067▲6.3331±0.7999★6.9139±0.4488★嗜酸粒细胞0.0133±0.00210.0379±0.0039▲0.0243±0.0025★0.0261±0.0028★淋巴细胞0.7481±0.06953.2847±0.3895▲1.8291±0.1799★1.9740±0.1604★
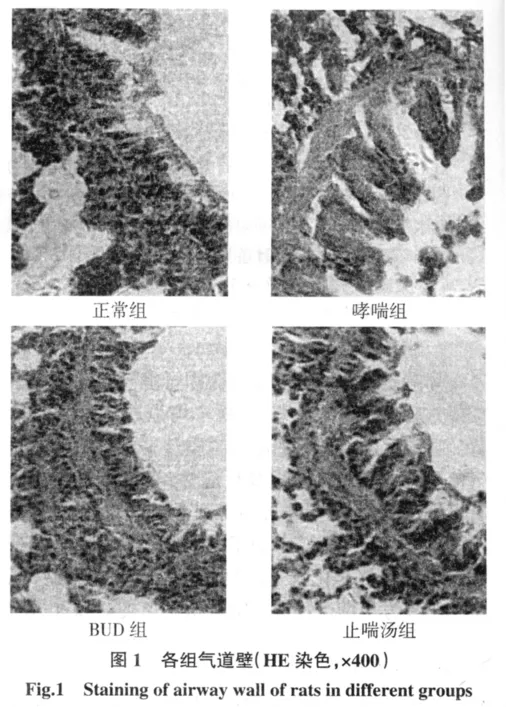
2.2 病理形态学观察 HE染色显示,正常组支气管、肺组织结构正常,各级支气管上皮完整,肺泡间隔正常,无明显炎性细胞浸润;哮喘组支气管黏膜上皮大片坏死和脱落,管壁以嗜酸粒细胞和淋巴细胞为主的炎性细胞浸润明显,肺泡间隔、平滑肌和基底膜增厚;治疗组支气管黏膜上皮部分脱落,少量炎性细胞浸润,肺泡间隔、平滑肌和基底膜较空白对照组略有增厚。见图1。
2.3 气道炎性细胞计数和形态学指标测定结果单位气道面积内,哮喘组和治疗组炎性细胞计数高于正常组,哮喘组高于治疗组(均P<0.01)。但治疗组间炎性细胞计数无明显差异(P>0.05)。形态学指标显示,哮喘组较对照组和治疗组气道壁厚度明显增加(均 P<0.01),BUD 组与止喘汤组间比较无统计学差异(P>0.05)。结果见表3。
表3 气道炎性细胞计数和形态学指标测定结果(±s)Tab.3 Counts of airway inflammatory cell and Morphological Indexes in different groups(±s)
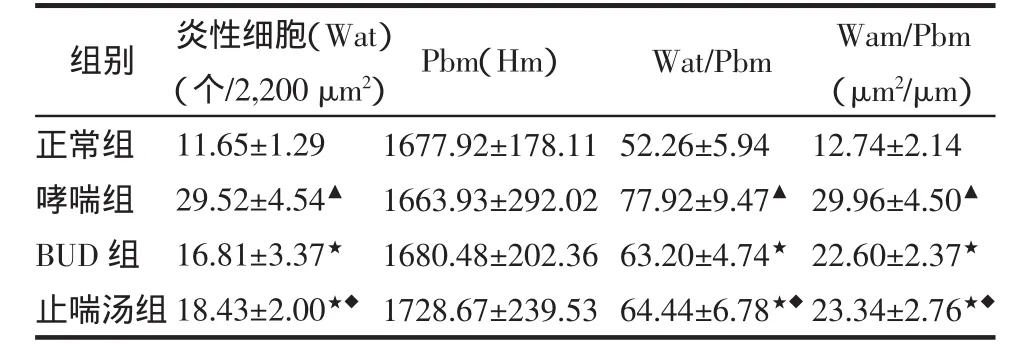
表3 气道炎性细胞计数和形态学指标测定结果(±s)Tab.3 Counts of airway inflammatory cell and Morphological Indexes in different groups(±s)
注:与正常组比较▲P<0.01,与哮喘组比较★P<0.01,与BUD组比较◆P>0.05;各组间比较▼P>0.05。
Pbm(Hm)组别Wat/Pbm正常组哮喘组BUD组止喘汤组炎性细胞(Wat)(个/2,200 μm2)11.65±1.2929.52±4.54▲16.81±3.37★18.43±2.00★◆1677.92±178.111663.93±292.021680.48±202.361728.67±239.5352.26±5.9477.92±9.47▲63.20±4.74★64.44±6.78★◆Wam/Pbm(μm2/μm)12.74±2.1429.96±4.50▲22.60±2.37★23.34±2.76★◆
3 讨论
病理学研究表明,哮喘的病理改变涉及整个支气管树,炎性细胞浸润不仅累及气道壁,也出现于外周肺组织。Th2反应介导的嗜酸粒细胞浸润已被认为是哮喘气道炎症的一个显著特征。气道重塑是哮喘的重要病理特征之一,成为哮喘近年来研究的热点之一,但其发生机制并未完全阐明。现被普遍接受的提法是由于急性炎症反复发作而转变为慢性炎症,气道反复损伤与修复,大量炎症细胞、炎症介质浸润并继发气道重塑[5]。
中医认为哮喘的病因是先天不足、脏腑失调,宿痰内伏、外邪触发,病久瘀血,以虚实夹杂、本虚标实为特征。止喘汤(党参、白术、茯苓、甘草、桑白皮、杏仁、葶苈子、黄芩、丹参、川芎)是基于哮喘基本病机证型的复方,由定喘汤合四君子汤加减而成。全方具有补益肺脾肾、活血化瘀、清泄肺热、祛痰止咳平喘,为根据多年临床经验研制的自拟中药合剂,临床应用效果良好。现代药理研究方中的甘草、杏仁、黄芩、丹参、川芎等都有不同的治疗哮喘的作用。
本实验应用大鼠建立慢性哮喘模型,观察中药复方止喘汤对致敏大鼠抗原激发所产生的气道炎症及气道重塑的影响。结果表明,致敏大鼠分别经过长期反复抗原激发,出现了支气管壁及支气管肺泡内以嗜酸粒细胞浸润为主的炎症反应,气道壁本身亦出现了结构性变化,表现为气道壁的增厚、支气管黏膜上皮脱落、上皮下纤维化、平滑肌细胞的增生肥大等,这些均为气道重塑的特征性病理改变。笔者发现止喘汤不仅可以抑制气道炎症,降低外周血、BAL中EOS数量,而且能有效预防气道重塑的发生。提示止喘汤可能通过减少EOS气道浸润控制气道炎症,减轻和延缓气道重塑;也可能通过其他途径如炎性介质或细胞因子等对气道炎症和重塑起作用[6];还可能本身就有抗气道重塑的作用;明确机制有待进一步研究。本实验结果可为止喘汤作为哮喘临床辨证治疗的基础方提供实验理论依据。
[1]Holgate ST,Peters-Golden M,Panettieri RA,et al.Roles of cysteinyl leukotrienes in airway inflammation,smooth muscle function,and remodeling[J].J Allergy Clin Immunol,2003,111(1):18-34.
[2]史 菲,邱 晨.大鼠支气管肺泡灌洗术标准化操作的探讨[J].中国现代医学杂志,2002,12(4):67-69.
[3]Henderson WR Jr,Tang LO,Chu SJ,et al.A role for cysteinyl leukotrienes in airway remodeling in a mouse asthma model[J].Am J Respir Crit Care Med,2002,165(1):108-116.
[4]Pascual RM,Peters SP.Airway remodeling contributes to the progressive loss of lung function in asthma:an overview[J].J Allergy Clin Immunol,2005,116(3):477-486.
[5]Cohn L,Elias JA,Chupp GL.Asthma:mechanisms of disease persistence and progression[J].Annu Rev Immunol,2004,22:789-815.
[6]刘仁慧,郭 忻,赵宇昊.中药复方抗支气管哮喘模型气道慢性炎症的机制研究[J].辽宁中医杂志,2007,34(10):1836-1837.

