Ni表面修饰对Mg2Ni储氢合金电化学性能的影响
冯武昌,杨桂玲,孔祥媚,丁盼爽,刘敬波,张便利
(河北北方学院理学院,河北张家口075000)
近些年来,很多研究表明镁基储氢合金特别是非晶态镁基储氢合金,由于它的放电容量高 (理论放电容量接近1 000 mAh/g)、资源丰富和价格低廉,是一种极具应用前景的镍氢电池电极材料[1].但其充放电循环稳定性差,几个充放电循环后放电容量甚至降低50%以上,无法满足新能源材料基本要求[2].为了提高镁基合金电极的循环稳定性,各国学者做了大量的研究工作.其中元素部分取代[3]、合金表面修饰[4]、合成方法的改革[5]等是提高镁基储氢合金循环稳定性的有效方法.我国学者将机械合金化法引入了镁基储氢合金的制备[6]﹑表面修饰[7,8]与合金的复合[9,10],提高了镁基储氢合金的初始放电容量和循环稳定性.日本的Iwakura等用元素部分取代和表面修饰法[11]对镁基储氢合金进行改良,也取得了很好的效果.但总的说来,镁基储氢合金电化学循环稳定性的改良还不尽如人意,30个循环后合金电极的放电容量便衰退至不足200 mAh/g[2,12].
镁是一种活泼金属,在浓的强碱溶液中很容易被氧化生成Mg(OH)2.一般认为镁基储氢合金循环稳定性差是由于在充放循环过程中,合金电极表面发生了氧化和粉化,降低了合金电极的表面活性和充放电能力.作者着力探索用电负性较小的Ni修饰镁基储氢合金,希望Ni特殊的性质增加合金的表面活性,增强镁基储氢合金的抗氧化、抗粉化能力,提高合金充放电的能力.
1 试 验
1.1 仪器与材料
所用仪器主要有:QM-3SP2型球磨机 (南京大学仪器厂),LAND(CT2001A)电池测试系统 (武汉蓝电电子有限分司),CHI660C电化学工作站(上海辰华仪器公司).所采用的主要材料有Mg锭(99.9%),Ni粉 (99.5%,200目).
1.2 非晶态镁基储氢合金试样的制备
非晶态镁基储氢合金Mg2Ni的制备:合金是通过机械合金化法获得的.所用 Mg为新切削纯度为99.9%镁屑;Ni的粒度≤74 μ m,纯度99.5%.按所需物质的量混合均匀,装入容积为100 mL的不锈钢真空球罐中,并加入适量的磨球,球料比为20∶1(质量比).在球磨之前先将球磨罐抽真空,并充入1.0×105Pa的氩气以防止合金属粉末被氧化.工作制度采用间歇旋转式,防止升温过高致使已非晶化的合金重新晶化.球磨时间为80 h.在氩气手套箱中将球磨好的试样取出过筛制成<74 μ m的合金粉,用以进行电化学性能测试.
以不同质量的Ni(粒度≤74 μ m,纯度99.5%)修饰Mg2Ni储氢合金.球磨修饰时间为10 h.修饰好的样品在充有氩气的手套箱中取出,过筛制成粒度<74 μ m的合金粉,用以进行电化学性能测试.
1.3 电化学测试
测试电极制备:将所得合金粉与Ni粉按质量比1∶3混合均匀,总质量为0.4 g.在20 Mpa压力下压成直径为1.0 cm的小片,刷掉毛边称量小片质量,计算活性物质的真实含量.再用两片直径为2.5 cm的泡沫Ni将小片夹在中间压实,点焊上极耳,制得测试电极.
充放电测试:是通过由测试电极、烧结式NiOOH/Ni(OH)2辅助电极和Hg/HgO参比电极组成的三电极体系来测量的.电解液为6 mol/L的KOH水溶液.以300 mA/g的电流密度充电6 h,静置10 min,再以75 mA/g的电流密度放电.放电截止电压为-0.6 V(vs.Hg/HgO)电极.整个测试过程由武汉蓝电电子有限公司LAND电池测试系统通过计算机进行联机控制.
高倍率测试:测试电极完全活化后,先将测试电极在三电极体系中静置1 h,然后在300 mA/g的电流下将合金充电6 h,静置10 min.放电过程分别采用900 mA/g、1500 mA/g、2100 mA/g、2700 mA/g电流,放电截止电位为-0.6V(vs.Hg/HgO).合金电极的高倍率性能以H RDn=Cn/(Cn+C75)表征,其中Cn表示以电流n放电至截止电位合金的放电容量,C75表示合金电极在以电流n放电至截止电位后,静置10 min,然后再以75 mA/g的电流放电至截止电位的放电容量.
循环伏安 (CV)测试:将测试电极在300 mA/g的电流下将合金充电6 h,静置10 min后,以不同的扫速对合金电极进行扫描,扫描范围-1.4~-0.2V.
2 结果与讨论
2.1 Ni以不同比例球磨修饰Mg2Ni储氢合金的初始放电容量
将球磨好的Mg2Ni储氢合金与Ni按质量比分别为1∶1、1∶1.5、1∶2、1∶2.5进行球磨表面修饰.样品进行充放电循环测试,实验结果如图1所示.
由图1可见:Ni修饰后的合金初始放电容量较Mg2Ni合金均有大幅的提高,特别是Ni的修饰比例为1∶1时,初始放电容量为最高 (664.8 mAh/g);同时还发现,随着Ni修饰比例的增大,各合金电极的初始放电容量C1均较664.8 mAh/g为低。这表明以Ni修饰Mg2Ni合金电极,能显著提高合金电极的表面活性,而且Ni的比例大小,还会影响合金电极的表面活性提高的幅度.
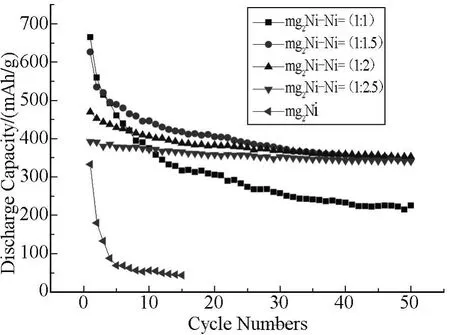
图1 Mg2Ni储氢合金电极包覆前后的循环特性曲线
2.2 Ni以不同比例球磨修饰Mg2Ni储氢合金的循环稳定性
为了更清楚的了解不同比例的Ni修饰对Mg2Ni储氢合金电极循环稳定性的影响,将各电极在第n个循环的放电容量值Cn与初始放电容量值C1的比值定义为循环稳定系数,对比各电极的循环稳定性,并将其列于表1.
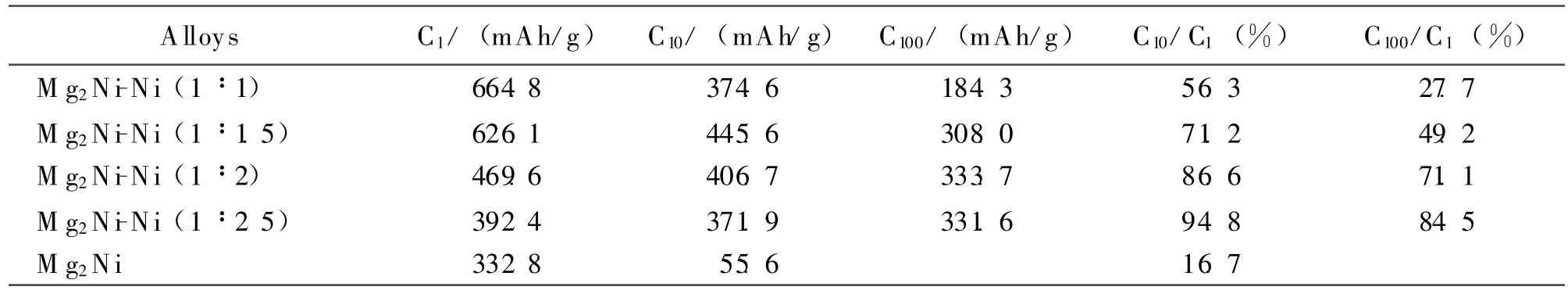
表1 Mg2Ni储氢合金电极修饰前后的循环容量和稳定性比较
对比表1的数据可发现:修饰后,虽然Mg2Ni-Ni(1∶1)合金电极的C1最高,但是C100/C1只有27.7%,循环稳定性相对较低;Mg2Ni-Ni(1∶2.5)合金电极循环稳定性最好,C100/C1高达84.5%,但C1相对较低,仅为 392.4 mAh/g;而 Mg2Ni-Ni(1∶2)合金电极C1为 469.6 mAh/g,C100/C1为71.1%.Mg2Ni-Ni(1∶2)合金电极的C1表面上看比Mg2Ni-Ni(1∶1)合金电极的C1低很多,但C100却确是所有合金中最高的,比C1最高的Mg2Ni-Ni(1∶1)合金电极的C100提高了149.4 mAh/g,同时Mg2Ni-Ni(1∶2)合金电极C1比Mg2Ni-Ni(1∶2.5)合金电极C1提高了77.2 mAh/g.综合修饰后合金电极初始放电容量和循环稳定性两个方面,Mg2Ni-Ni(1∶2)合金电极初始放电容量较高、合金电极的循环稳定性显著提高.
表1数据表明,随着Ni含量增高,修饰合金的循环稳定性系数增大,当Mg2Ni-Ni(1∶2.5)时,循环稳定性系数增加到最大.这说明,修饰效果与修饰材料在非晶态Mg2Ni储氢合金表面分布密度相关.修饰材料的分布密度较小,不足以有效抑制合金电极氧化与粉化作用的发生,改良循环稳定性的作用不很明显;修饰材料分布密度过大,较厚的修饰层或许会减少合金表面的活性中心,致使初始放电容量有所下降,但修饰后的合金循环稳定性大大提高.
2.3 高倍率放电性能测试
通过合金的充放电性能测试后,对Mg2Ni储氢合金和所筛选出的Mg2Ni-Ni(1∶2)合金进行高倍率测试,实验结果如图2所示:
由图2可见,图中所示合金电极的高倍率放电性能 (HRD值)均随放电电流的增大而减小,可喜的是Mg2Ni∶Ni=1∶2合金电极的高倍率放电性能大大高于 Mg2Ni储氢合金电极的高倍率放电性能,而且在给定的放电电流条件下,Mg2Ni-Ni(1∶2)合金都比Mg2Ni储氢合金电极的高倍率放电性能 (H RD)提高了约30%.不难看出,随着放电电流的增大,Mg2Ni-Ni(1∶2)合金电极的高倍率放电性能更好于Mg2Ni储氢合金电极.这说明,Ni的表面修饰,有效增加了合金表面电荷交换活性中心,使合金表面电荷迁移速率加快,从而使Mg2Ni-Ni(1∶2)合金电极的高倍率放电性能大大提高.这对于合金电极的实际应用有着重要的意义.
2.4 循环伏安 (CV)测试
图3为Mg2Ni和Mg2Ni-Ni(1∶2)合金电极在5 mV/s扫速下的循环伏安曲线.
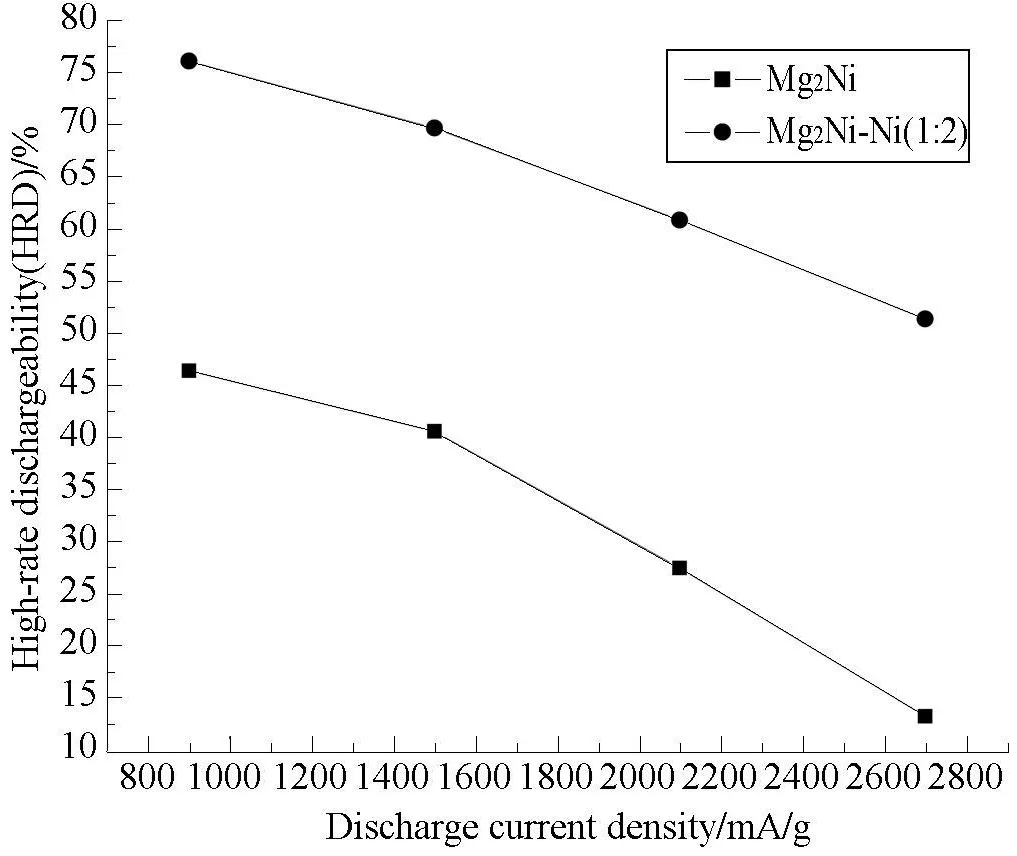
图2 Mg2Ni和Mg2Ni-Ni(1∶2)合金电极的高倍率放电性能
从图中可以看出,Mg2Ni-Ni(1∶2)合金的氧化峰面积比Mg2Ni合金的氧化峰面积大很多,说明修饰后合金的储电容量增大,这与修饰后合金电极的放电容量增大相一致;Mg2Ni合金在-0.6V(vs.HgO/Hg)附近出现氧化峰,而Mg2Ni-Ni(1∶2)合金则是在-0.5V(vs.HgO/Hg)附近出现氧化峰,Mg2Ni-Ni(1∶2)合金电极阳极电位正移,说明修饰后合金的抗氧化的能力增强.这与Ni修饰后合金电极的循环稳定性增大的测试结果相一致.
3 结 论
Ni对非晶态储氢合金的修饰效果与Ni在Mg2Ni储氢合金表面分布密度有关.恰当的表面分布密度有助于提高储氢合金电极的放电比容量和循环稳定性.高倍率放电性能也较修饰前大为提高.循环伏安测试表明,修饰后的合金氧化峰面积增大,氧化峰阳极电位正移,表明修饰后合金的储氢能力及抗氧化和抗粉化能力增强.

图3 Mg2Ni和Mg2Ni-Ni(1∶2)电极扫速2 mV/s下的循环伏安曲线
[1]Lei YQ,Yang QM,Wu J,et al.Electrochemical behavior of some mechanically alloyed Mg-Ni based amorphous hydrogen storage alloys[J].Phys Chem,1994,183:379-384
[2]Zhang Y,Li SQ,Ying T,et al.Effect of surface coating by ball milling on cycle stability of Mg-based hydrogen storage electrodes[J].Chin J Nonf Metals,2001,11(04):582-586
[3]Yan F,Li FJ,Hua TY,et al.Study on the preparation and electrochemical characteristics of M gNi-CoB alloys[J].J Alloys Comp,2007,440:304-308
[4]Iwakura C,Inoue H,Nohara S,et al.Effects of surface and bulk modifications on electrochemical and physicochemical characteristics of MgNi alloys[J].J Alloys Comp,2002,330-332:636-639
[5]Wu YM,Lei YQ,Wu J,et al.Electrochemical behaviour of some mechanically alloyed M g-Ni-based amorphous hydrogen storage alloys[J].Rare Metal Mater Engin,1997,26(03):26-29
[6]Shinji N,Hiroshi I,Yukio F,et al.Effect of surface modification of an MgNi alloy with graphite by ballmilling on the rate of hydrogen absorption[J].J Alloys Comp,1997,252:L16-L18
[7]Xu NJ,Han XL,Hou XY.Influence of partial Ni substituted by Cu on electrochemical properties of La-Mg-Ni systems[J].Appl Chem Industry,2007,36(01):54-57
[8]Santos SF,de Castro JFR,Ishikawa TT,et al.Effect of transition metal additions on the electrochemical properties of a MgNi-based alloy[J].J Alloys Comp,2007,434:756-759
[9]Yuan HT,Feng Y,Song HN,et al.Development of improving on the characteristics of magnesium hydrogen storage alloys[J].Chem Industry Engin Progr,2003,22(04):454-458
[10]Ye H,Li ZL,Wu Z,et al.Study of hydrogen storage alloy droped with boron for high-power type and low-temperature type Ni/MH battery[J].J Funct Mater Devices,2002,8(02):139-143
[11]Zou YB,Wang YJ,Yuan HT,et al.Preparation and electrochemical characteristics of M g-Based composite materials for hydrogen storage[J].Rare Metal Mater Engin,2006,35(02):320-323
[12]Wang N,Xi SQ,Guo ZQ,et al.Performance improvement in Mg-Ni hydrogen storage alloys[J].Rare Metal Mater Engin,2002,31(04):252-256

