斑马鱼hand2基因的克隆、抗体制备及分析
朱 婷,黄 文,王跃群,李永青,袁婺洲,莫小阳,万永奇,吴秀山,邓 云
(湖南师范大学蛋白质化学及鱼类发育生物学教育部重点实验室心脏发育研究中心,中国 长沙 410081)
已有文献表明:碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子对骨骼肌细胞[1]、造血细胞[2]及一些神经元细胞[3]的分化起重要调节作用;也有bHLH家族成员与心脏及其他组织中的表达,肌细胞的发生、细胞增殖、组织分化以及其他重要的发育过程有关.Hand基因就是bHLH家族成员之一[4].近来有文献报道hand基因对心脏发育有非常重要的调节作用,在心脏的发生过程中与外胚中胚层、心管和心室的发育有关.其中,hand2(又称dhand)主要在右心室和蜕膜中表达[5].剔除hand2等位基因,纯合子胚胎不能形成右心室[6].在缺失hand2的小鼠胚胎中,脉管系统不能正常形成[7].Hand2很可能是通过VEGF信号途径在血管发育和发生调控中起着重要的作用.另外,hand2的表达又受骨形成蛋白(BMPs)调控[8],且能在鳃弓神经嵴中表达,维持颅面结构和动脉弓的形状[9].近年来研究发现hand2对于胚胎发育十分重要,其功能异常与人类一些先天性异常综合征相关(如22q11 缺失综合征、DGS 综合征、CATCH222 综合征等)[10-12].
斑马鱼是进一步研究hand2在心脏发育中功能理想模型,作者克隆了斑马鱼hand2基因,成功实现原核表达并制备效价较高、特异性较好的Hand2多克隆抗体,对进一步研究利用斑马鱼研究hand2基因生物学功能奠定基础.
1 实验部分
1.1 实验材料
大肠杆菌E.coliDH5a,E.coliBL21菌株,由本实验室保种;载体pGEX-4T-1为本实验室提供;限制性内切酶BamH I和SalI,TagDNA聚合酶,10×loading buffer购买自深圳晶美公司; pMD18-T载体和连接酶购自大连TaKaRa公司;柱式DNA胶回收试剂盒(离心柱型)购买自博大泰克公司;蛋白胨、酵母提取物、氯化钠、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、IPTG(异丙基-β-D-硫代半乳糖苷)、 RNase等购自上海sangon公司;弗氏佐剂购自Sigma公司; Glutathione SepharoseTM4B购自Amersham Biotech 公司;新西兰大白兔购自中南大学湘雅附一医院.
1.2 斑马鱼hand2基因生物信息学分析
应用UCSC 程序(http://genome.ucsc.edu),根据已克隆的人的hand2基因序列,在NCBI 数据库(http://www.ncbi.nlm.nih.gov/)中查找斑马鱼hand2 基因,分析该基因在染色体中的位置、外显子与内含子数目、基因全长和开发阅读框的碱基数目,及其编码蛋白质的氨基酸数目.SMART(http://smart.embl-heidelberg.de) 分析蛋白质Hand2的结构域.Matchcode软件用于核苷酸序列和蛋白质序列的匹配.DNAstar 软件用于DNA 序列、蛋白质性质及进化关系分析.Primer Premier 5.0软件用于酶切位点的分析和PCR引物设计.凝胶分析系统用于分析蛋白相对含量.
1.3 斑马鱼hand2基因的分离及序列测定
用热酚法[13-14]抽提斑马鱼成鱼组织总RNA 1 mg,按试剂盒说明书分离纯化出mRNA,并以之为模板进行反转录PCR扩增(cDNA PCR Kits,TaKaRa公司),从而构建斑马鱼成鱼组织cDNA文库.以提取的斑马鱼mRNA反转录所得的cDNA文库为模板,用根据以上分析得到斑马鱼hand2基因序列设计合成的引物:5′端引物(5′GGATCCATGAGTTTAGTTGGAGGGT 3′,含BamH I酶切位点)和3′端引物(5′GTCGACCTCATTGCTTCAGTTCCA 3′,含SalI酶切位点),进行PCR扩增.PCR反应条件如下:95 ℃变性5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 42 s,反应32个循环;72 ℃ 8 min.所得PCR产物纯化后与pMD18-T载体16℃连接过夜,转化大肠杆菌DH5α感受态细胞,筛选阳性克隆,提取质粒,通过BamH I和SalI酶切鉴定后,在上海英峻公司测序分析.
1.4 斑马鱼Hand2蛋白原核表达及多克隆抗体的制备
利用限制性内切酶BamH I和SalI双酶切pMD18-T-hand2质粒,切取hand2基因片段,与同以BamH I和SalI双酶切的pGEX-4T-1质粒相连接,转化大肠杆菌DH5α感受态细胞,接种于LB 固体培养基平板上(含50 mg/L 氨苄青霉素)筛选阳性克隆,提质粒,经BamH I和SalI双酶切鉴定,进行测序分析.将鉴定正确连接的pGEX-4T-1-hand2质粒转入BL21菌株.将含重组子pGEX-4T-1-hand2的BL21菌株在LB培养液中37 ℃培养过夜,以1∶50比例接种于200 mL LB培养液,37 ℃振荡培养至OD600至0.6,加入IPTG至终浓度为0.5 mmol/L,于30 ℃继续培养5 h.收集诱导培养细菌,重悬于pH 8.0的PBS溶液中,超声破菌,离心后取上清经SDS-PAGE电泳鉴定.经考马斯亮蓝R250 染色,脱色后,用凝胶图象分析系统分析,计算蛋白质相对含量.
将表达的蛋白超声裂解后,离心取上清.再将上清与Glutathione SepharoseTM4B 结合30 min,3 000 r/min、4 ℃离心5 min,去上清.PBS漂洗后,用还原型谷胱甘肽缓冲液缓慢混匀,重悬珠子15 min,3 000 r/min、4 ℃ 离心5 min离心,上清即纯化的GST-Hand2融合蛋白.免疫新西兰大白兔获取多克隆抗体 将纯化得到的GST-Hand2目的蛋白0.6 mg按体积比1∶1与弗氏完全佐剂混合,皮下多点注射免疫新西兰大白兔,在第14 d、第21 d再将目的蛋白0.15 mg与弗氏不完全佐剂混合并免疫.第28 d主动脉取血后,收集血清,即得到斑马鱼Hand2蛋白的多克隆抗体,分装后,-80 ℃保存.
1.5 Western blotting分析抗体特异性
将含pGEX-4T-1-hand2重组子的BL21菌株和含pGEX-4T-1的BL21菌株在LB培养液中扩大培养,用IPTG诱导后,收集细菌,PBS重悬,SDS-PAGE电泳分离.将Hand2抗体稀释1 000倍后,采用Western blotting方法对表达的总蛋白抗原杂交,以检测抗体的特异性.同等条件下,用GST抗体进行Western blotting 分析作为对照.
1.6 免疫组化分析抗体特异性
取斑马鱼成鱼心脏组织石蜡切片,脱蜡,3% H2O2室温孵育5~10 min;95 ℃的枸橼酸钠缓冲液(pH 6.0)中抗原热修复15 min;5%正常山羊血清封闭20 min后,将Hand2抗体稀释100倍,于4 ℃孵育过夜;滴加生物素化羊抗免IgG,37 ℃孵育30 min;加SABC链霉亲和素-生物素-酶(或者FITC)复合物室温孵育30 min,DAB显色;苏木素轻度复染,中性树脂封片,各步骤间均用pH 7.4的PBS漂洗2~3次,每次5 min.在相同条件下,以未免疫血清进行免疫组化分析作为对照.
2 结果
2.1 斑马鱼hand2基因克隆

图1 hand2 的cDNA序列、ORF和编码蛋白
斑马鱼hand2位于一号染色体上,全基因在基因组上长达2 061 bp,含两个外显子,一个内含子.其mRNA为1 668 bp,该转录本编码一个长为208个氨基酸的蛋白质(图1),蛋白相对分子质量为23 000.从491 bp到1 117 bp为开放阅读框,其编码的蛋白包含一个HLH结构域.利用斑马鱼hand2基因序列在NCBI数据库中进行Homologene搜索,发现在人类、小鼠、大鼠、猩猩、狗、原鸡、果蝇中都存在斑马鱼hand2的同源基因.Hand2同源蛋白进化树分析表明:Hand2蛋白在人类、猩猩、小鼠、大鼠中的同源度高达82%;在狗中的蛋白同源度达60%,与果蝇的蛋白同源度为39%.
经PCR技术扩增出hand2基因全长,将目的片段纯化回收后,与pMD18-T连接.用BamH I和SalI双酶切pMD18-T-hand2质粒,产生与hand2基因大小一致的酶切片段,约640 bp(图2).表明hand2基因已插入到pMD18-T载体中.测序结果与NCBI数据库报道一致.
2.2 重组表达质粒的构建及GST-Hand2融合蛋白诱导表达和纯化
将从pMD18-T-hand2质粒切取下来的斑马鱼hand2基因片段插入到pGEX-4T-1载体中,构建成pGEX-4T-1-hand2质粒,质粒以BamH I 和SalI酶切产生与hand2基因大小一致的酶切片段(图3),表明斑马鱼hand2基因已插入到载体pGEX-4T-1.

M: SM0241 DNA 分子量标准;1:BamH Ⅰ/Sal I双酶切结果. M: SM0331 DNA 分子量标准;1:BamH Ⅰ/Sal I双酶切结果.图2 pMD18-T-hand2质粒酶切鉴定图谱 图3 pGEX-4T-1-hand2重组表达质粒双酶切鉴定图谱
收集诱导的细菌,PBS重悬后超声破菌,取上清经SDS-PAGE电泳鉴定.结果表明,经IPTG诱导后大量表达出相对分子质量约为49 000的融合蛋白(图4),与预期结果一致.因为pGEX4T-1载体能表达出26 000大小的GST蛋白,而Hand2的蛋白相对分子质量为23 000,故表达出的蛋白为49 000大小的GST-Hand2融合蛋白.该蛋白经Glutathione SepharoseTM4B 亲和纯化后,SDS-PAGE电泳,经考马斯亮蓝染后,显示出特异性较强的条带,经凝胶图像分析系统分析,蛋白质相对含量高达71%,且为可溶性蛋白(图4).
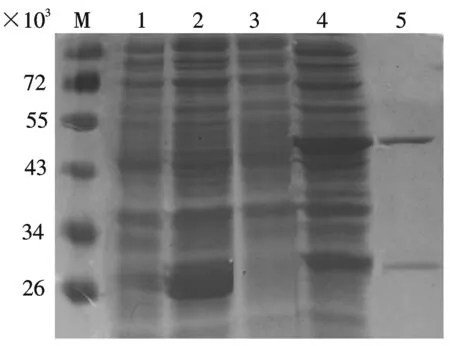
M:SM0671 蛋白分子量标准;1:未经诱导的pGEX4T-1质粒转化的BL21总蛋白;2:IPTG诱导后的pGEX4T-1质粒转化的BL21总蛋白;3:未经诱导的pGEX4T-1-hand2重组质粒转化的BL21总蛋白;4:IPTG诱导后的pGEX4T-1-hand2重组质粒转化的BL21总蛋白;5:纯化的pGEX4T-1-hand2表达蛋白.图4 SDS-PAGE 电泳图谱
2.3 Hand2多克隆抗体特异性检测
利用制备的Hand2多克隆抗体对含有重组子pGEX-4T-1-hand2和含有空载体pGEX-4T-1两种BL21菌株的IPTG诱导表达蛋白进行Western blotting 分析,在相同条件下,以GST抗体进行Western blotting 分析作为对照.结果表明:在用Hand2抗体进行分析时,在pGEX-4T-1-hand2诱导表达的GST-Hand2融合蛋白的49 000处能检测到特异性条带,而pGEX-4T-1诱导表达蛋白则没有49 000特异性条带出现;而用GST抗体分析时,则在pGEX-4T-1-hand2诱导表达的GST-Hand2融合蛋白的49 000处和pGEX-4T-1诱导表达的GST蛋白的23 000处均有条带出现(图5).说明利用GST-Hand2融合蛋白制备的Hand2多克隆抗体对Hand2蛋白有抗性,对GST没有抗性,制备的Hand2抗体特异性较强,达到了用于进一步实验的需要.

A: 用制备的Hand2多克隆抗体Western blotting分析IPTG诱导的pGEX-4T-1-hand2和pGEX-4T-1在大肠杆菌BL21中的表达蛋白;B: 用GST抗体Western blotting分析IPTG诱导的pGEX-4T-1-hand2和pGEX-4T-1在大肠杆菌BL21中的表达蛋白.图5 Western blotting检测抗体的特异性
2.4 免疫组化结果分析
应用免疫组化SuperPicTureTM法(DAB棕色反应法)染色的切片,背景无色或浅棕色.Hand2免疫反应阳性物质呈深浅不等的棕色和棕黄色颗粒,主要定位于细胞核内,细颗粒状(图6A).而在对照组中,细胞的细胞核被苏木素复染成淡蓝紫色(图6B),未出现棕色颗粒阳性信号,与预想结果一致.再次说明Hand2抗体是特异性的.
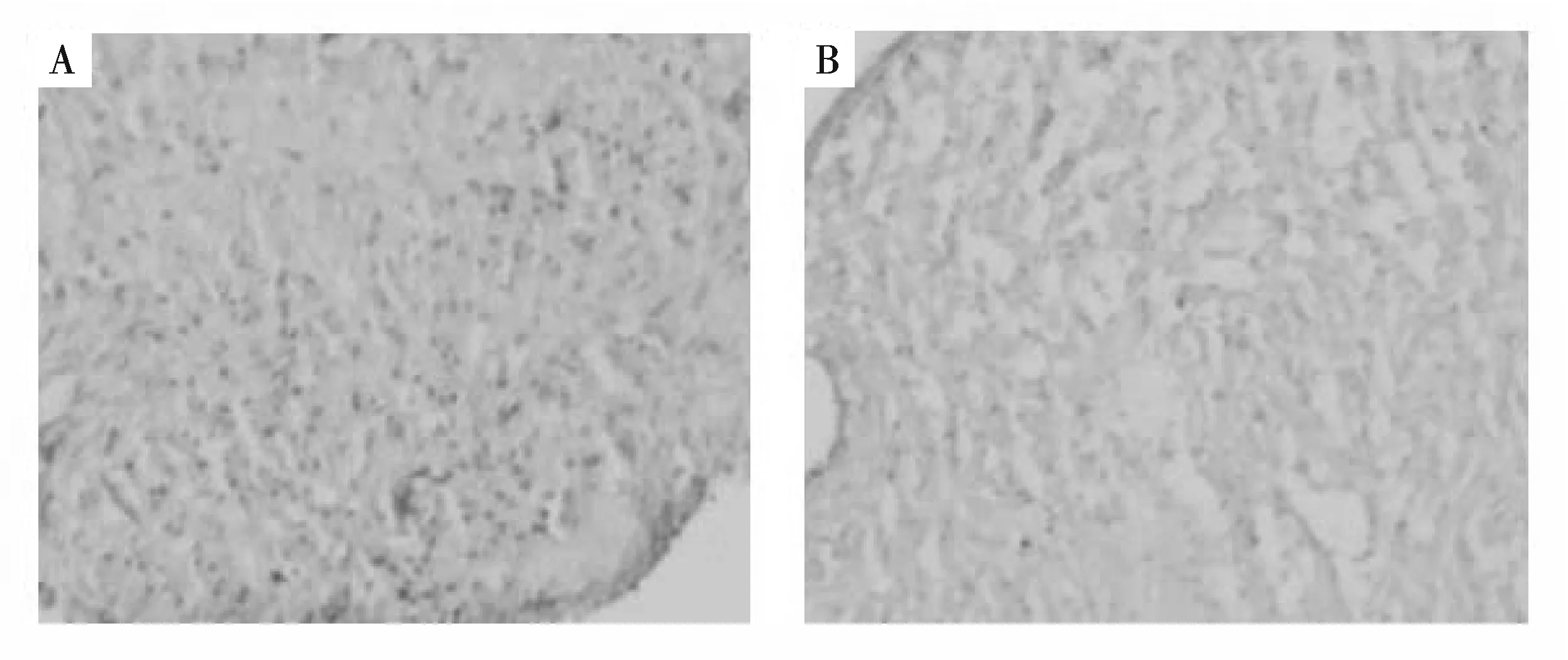
A:用Hand2抗体免疫组化分析斑马鱼心脏组织,图中黄色颗粒即为阳性信号;B:用未免疫血清免疫组化分析斑马鱼心脏组织.放大倍数=230.图6 免疫组化分析抗体特异性
3 讨论
Hand2蛋白含一个HLH结构域,属于bHLH 家族.在这个家族成员中,组成HLH结构域的多数氨基酸相对保守,不同物种间Hand2蛋白的同源性大多可达到80%.与其他物种相比,斑马鱼hand2基因的开放阅读框不长,仅627 bp,通过PCR技术作者很容易扩增出了斑马鱼hand2基因,并将其插入到pGEX-4T-1表达载体上.
pGEX 表达载体是谷胱甘肽转移酶(GST) 表达载体系列,该表达载体是专为外源多肽能在大肠杆菌中表达,并可在非变性的条件下快速纯化而设计的.与其他表达载体不同之处在于,pGEX 表达载体SD序列下游是谷胱甘肽巯基转移酶基因,而克隆的外源基因则与谷胱甘肽巯基转移酶基因相连.表达产物为谷胱甘肽巯基转移酶和目的基因产物的融合体,可用Glutathione SepharoseTM4B纯化出来.目的蛋白与GST蛋白以融合蛋白形式在大肠杆菌BL21中表达是目前使用很广泛的表达系统之一,它不仅表达量高,而且具有纯化方便的优点[15].
在进行融合蛋白诱导时,蛋白极易以包涵体的形式表达,而包涵体形成后的缺点是需变性、复性等复杂处理过程后才能得到可溶性融合蛋白质.为了避免变性、复性等复杂过程,通过改变诱导的温度、时间和IPTG的浓度,摸索到最适宜的条件,即在诱导温度为30 ℃, IPTG浓度为0.5 mmol/L 的条件下诱导5 h,使融合蛋白在上清表达,且不影响蛋白的大量表达,这样使得利用Glutathione SepharoseTM4B进行融合蛋白的纯化过程变得简单.在进行免疫组化实验时,热修复用的枸橼酸钠溶液的pH值非常重要,偏高或偏低都将导致热修复效果不佳而影响免疫组化实验结果,故要严格控制好枸橼酸钠溶液的pH值.
本实验中,作者克隆了斑马鱼hand2基因的全长,获得了高纯度的蛋白,并首次制备了斑马鱼Hand2抗体的多克隆抗体.Western blotting 及免疫组化等方法证明,制备的Hand2多克隆抗体能与原核生物和真核生物体内表达的Hand2蛋白结合,显示了该抗体与Hand2蛋白结合的特异性.因此,它为将来运用免疫共沉淀、染色质免疫沉淀、胚胎抗体染色等手段深入研究hand2基因的功能奠定了基础.
参考文献:
[1] OLSON E, KLEIN W. bHLH factors in muscle development: dead lines and commitment, what to leave in and what to leave out[J]. Genes Dev, 1994,8:1-6.
[2] SHIVDASANI R, MAYER E, ORKIN S. Absence of blood formation in mice lacking the T cell leukaemia oncoprotein tal-1/SCL[J]. Nature, 1995,373:432-434.
[3] JAN L, JAN Y. HLH proteins, fly neurogenesis, and vertebrate myogenesis[J]. Cell, 1993,75:827-830.
[4] EVANS S. Vertebrate Tinman homologues and cardiac differentiation [J]. Cell Biol,1999,10(1):73-83.
[5] BIBEN C, HARVEY R. Homeodomain factor Nkx2-5 controls left/right asymmetric expression of bHLH gene eHand during murine heart development[J].Genes Dev, 1997,11:1 357-1 369.
[6] MORIN S, CHARRON F, ROBITAILLE L,etal. GATA2 dependent recruitment of MEF1 proteins to target promoters[J]. EMBO J,2000,19(9):2 046-2 055.
[7] YAMAGISHI H, OLSON E, SRIVASTAVA D. The basic helix-loophelix transcription factor, dHAND, is required for vascular development[J]. Clin Invest,2000,105:261-270.
[8] MARTHE J, MATTHIAS S, CAROLIN C,etal. The transcription factor dHAND is a downstream effector of BMPs in sympathetic neuron specification[J]. Development,2000,127:4 073-4 081.
[9] DAVID G, MCFADDEN, JEROEN C,etal. A GATA-dependent right ventricular enhancer controls dHAND transcription in the developing heart[J]. Development,2000,127: 5 331-5 341.
[10] CHUNG M, LU J, WENG Y,etal. Absence of mutations in human ubiquitin fusion degradation protein gene in tetralogy of Fallot[J].J Mol Med, 2001,79(5-6):338-342.
[11] THOMAS T, KURIHARA H, YAMAGISHI H. A signaling cascade involving endot helin21, dHAND and msx1 regulates development of neural crest derived branchial arch mesenchyme[J].Dev,1998,125(16):3 005-3 014.
[12] PIOT R, AHN D, SCHILLING T. The zebrafish vangogh mutation disrupts tbx1, which is involved in the Di2 George deletion syndrome in humans [J].Development,2003,130(20):5 043-5 052.
[13] 李永青,曾伟奇,朱传炳,等. 一个人类新基因ZNF322 的研究初报[J].生命科学研究,2001,5(2):141-145.
[14] 王雁云,罗开梅,李永青,等. 一种快速的胚胎组织总RNA 的提取方法[J].生命科学研究,2001,5(1):88-90.
[15] YUAN C,REULAND J,LEE L,etal. Optimized expression and refolding of human kerato epithelin in BL21 (DE3)[J]. Protein Expr Purif, 2004,35:39-45.

