D151树脂一步法提取井冈霉素
钟世华,齐风佩,范明亮,徐满才
(湖南师范大学化学化工学院,中国 长沙 410081)
井冈霉素[1]是通过微生物发酵生产的一种多组分的混合物,含量在2%左右,与日本生产的有效霉素(Validamycin)结构相同[2],其有效成分为A、B、C、D、E、F、G,其中A成分大于70%,B成分占20%左右.在pH=3.0~9.0时稳定,能有效抑制水稻纹枯病,是国内价格低廉、产量最大的生物农药[3].目前提取方法多采用传统方法[4],即将发酵液预处理后直接浓缩成水剂产品,含量在5%左右,或者将浓缩后水剂通过真空干燥成粉剂产品,含量在20%左右,适合于农用抗生素使用.郑裕国[5]等用三步离子交换方法吸附提取井冈霉素,收率70%左右,含量达90%以上,适用于井冈霉素产品的后期开发利用.作者根据井冈霉素分子结构中仲胺基在碱性介质中显正电性的特点,提出用D151弱酸吸附树脂一步法提取井冈霉素[6],含量在95%左右,收率80%以上,为分离提取纯化井冈霉素工艺提供有效的参考数据.
1 实验部分
1.1 药品与仪器
D151树脂(南开大学化学试剂厂);井冈霉素发酵液(武汉科洛生物技术有限公司);SHA-2000数显全温水浴振荡器(长沙素拓科学仪器设备有限公司);BT-100B数显恒流泵(上海沪西分析仪器厂有限公司);BSZ-100自动部分收集器(上海沪西分析仪器厂有限公司);Agilent 1100液相色谱(美国).
1.2 方法
1.2.1 树脂对不同酸度发酵液的静态吸附 分别取25.0 mL井冈霉素发酵液(效价31 265 μg·mL-1)于6个100 mL三角瓶中,加入1.000 g D151干树脂,分别调pH为4、5、6、7、8、9,塞好塞子,室温振荡24 h,取吸附后的井冈霉素发酵滤液,检测其含量(稀释200倍).
1.2.2 树脂对不同温度发酵液的静态吸附 分别取6个100 mL三角瓶,加25.0 mL井冈霉素发酵液(pH=8.0,效价31 265 μg·mL-1)、0.500 g D151干树脂,塞好塞子,分别在10.0、15.0、20.0、25.0、30.0、35.0 ℃水浴中振荡24 h,取吸附后水液检测其含量(稀释200倍).
1.2.3 D151树脂对发酵液的动态吸附与洗脱 采用层析柱的内径2.6 cm,长度20 cm,床体积50 mL,预处理后的发酵液调pH = 8.0,以流速1.0、1.2、1.5、1.8、2.0 mL·min-1直接上柱,检测流出液中井冈霉素的含量,至吸附饱和用2倍床体积流速为2.0 mL·min-1的去离子水洗,用浓度为0.5、0.8、1.0 mol·L-1氨水洗脱[5]确定恰当浓度;在此浓度下,以流速为0.5、0.8、1.0、1.2、1.5 mL·min-1氨水洗脱.
1.2.4 D151树脂再生与重复使用 树脂用2 mol·L-1NaOH(aq)再生,用2 mol·L-1HCl(aq)转型,按1.2.3方法重复使用.
1.2.5 井冈霉素效价检测 井冈霉素效价检测:HPLC法[7].
2 结果与讨论
2.1 发酵液酸度对树脂吸附的影响
根据1.2.1得到发酵液酸度对树脂的吸附影响结果(见表1),随着井冈霉素发酵清液pH值的增加,其吸附量增大,当pH值在8~9时,吸附趋于平衡;从表1中数据可以看出:D151在酸性介质中对井冈霉素的吸附量很小,在碱性介质中对井冈霉素的吸附量较大,且趋于平衡,这主要是由于井冈霉素分子结构中的仲胺基在碱性介质中显正电性,能与D151吸附树脂中的—COO-1形成有效结合,从而使吸附量增加.通过计算可知,在碱性介质中D151对井冈霉素的静态饱和吸附量为0.7 g·g-1(干树脂).由此发酵液应调剂到pH=8~9时进行树脂吸附.

表1 发酵液酸度对吸附的影响
2.2 发酵液温度对树脂吸附的影响
根据1.2.2得到发酵液温度对树脂的吸附影响结果(见表2),井冈霉素发酵液的温度不同,D151吸附量几乎相同,吸附量为0.7 g·g-1(干树脂),说明发酵液温度对树脂的静态饱和吸附影响不大.由此采用常温发酵液进行树脂吸附.

表2 发酵液温度对吸附的影响
2.3 D151树脂对井冈霉素动态吸附与洗脱
2.3.1 D151树脂对井冈霉素的动态吸附 图1为D151树脂对井冈霉素发酵液在不同流速下的动态吸附曲线.从图1中可以看出,当流速为1.5 mL·min-1时,达到最大吸附所需的时间最短,床体积为8.5倍.当流速减小或者增大时,都会延长树脂达到饱和吸附的时间.因此,选用流速为1.5 mL·min-1作为动态吸附速率.

Q=流出液效价/μg·mL-1 V=流出液体积÷树脂体积 Q=流出液效价/μg·mL-1 V=流出液体积÷树脂体积 图1 不同流速下的动态吸附曲线 图2 不同浓度洗脱剂的动态脱附曲线
2.3.2 D151树脂对井冈霉素的动态脱附 图2考察了D151树脂吸附井冈霉素后在不同浓度氨水下脱附曲线,图2说明在氨水浓度为1.0 mol·L-1时洗脱所用时间最短,同时考察了在浓度为1.0 mol·L-1时不同流速下氨水洗脱剂的动态脱附曲线,如图3,由图中可以看出,用1.0 mol·L-1的氨水以1.0 mL·min-1的流速洗脱时所用的时间最短,且没有出现拖尾现象.
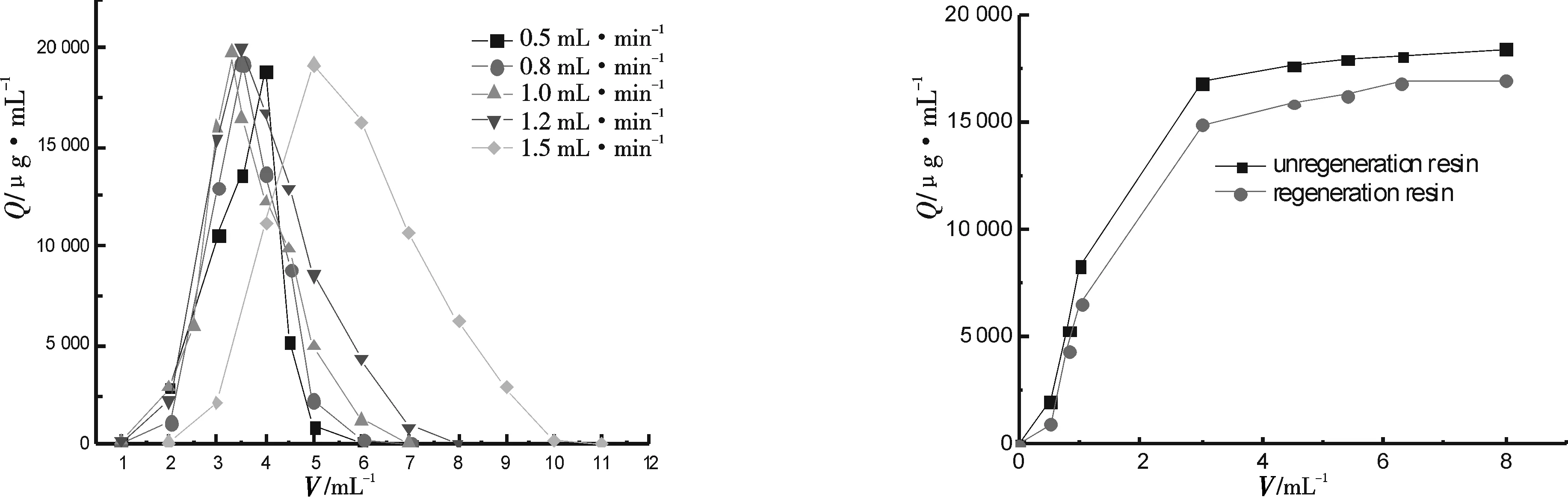
Q=流出液效价/μg·mL-1 V=流出液体积÷树脂体积图3 不同流速下的动态脱附曲线 图4 树脂再生后在流速为1.0 mL·min-1时的动态吸附曲线
D151树脂对井冈霉素的动态吸脱附实验结果说明:D151树脂在中等流速下对井冈霉素有比较好的吸附效果,可以很快达到吸附平衡;用稀的氨水溶液可以很容易将井冈霉素洗下来,但由于井冈霉素与D151树脂之间的结合力稍强,洗脱的速度就会慢一些,用1.0 mL·min-1的洗脱速度才能最快的将井冈霉素解析下来.
2.3.3 树脂重复利用 树脂经过NaOH溶液再生之后,树脂机械强度好,未破损.图4是再生后的树脂对井冈霉素的吸附曲线,从图中可以看出,树脂经再生后,跟原树脂相比对井冈霉素的吸附量有所下降,但仍可以达到85%以上的吸附率.
2.4 D151一步法吸附提取井冈霉素方法与现行工艺的对比分析
井冈霉素传统生产提取方法[4]如图5所示,发酵液预处理后,经减压浓缩,得水剂产品含量在5%~10%,呈酱油状,作为农用抗生素虽不影响使用效果,但由于含量低,浪费了大量包装材料和运输费用;10%的水剂产品经真空干燥得粉剂产品,含量在20%左右,粉碎时粉尘多,且极易吸潮成膏状,影响产品的溶解度,直接影响药物的喷洒和使用效果;产品收率在80%左右.
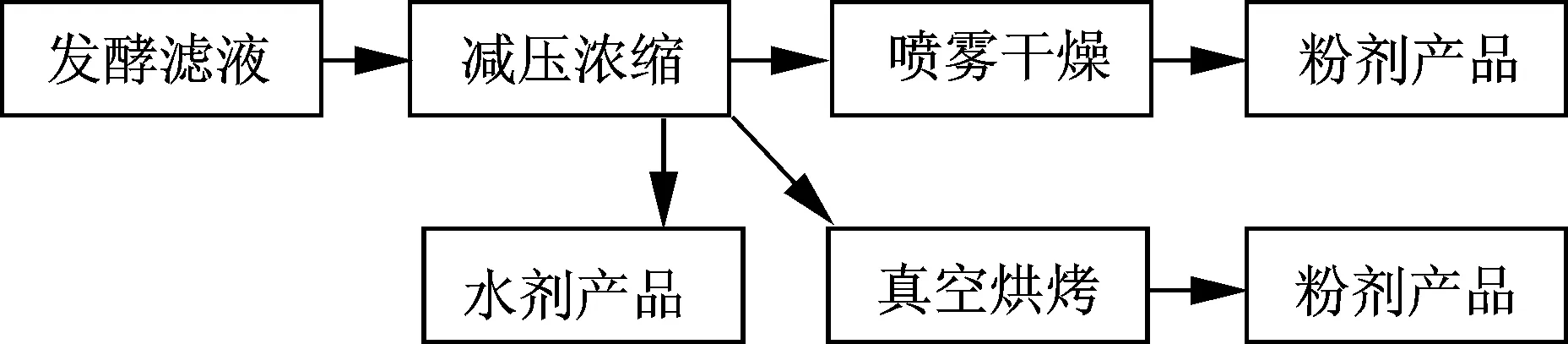
图5 传统提取工艺流程
随着井冈霉素下游产品的开发和利用,对井冈霉素产品的质量提出了更高的要求,1996年郑裕国等报道了使用凝胶离子交换树脂来提取分离发酵液中井冈霉素,具体方法如图6所示.发酵液经预处理后,先用碱性阴离子交换树脂除去阴离子杂质;后用阳离子交换树脂除去阳离子杂质;再用001×4强酸凝胶树脂吸附井冈霉素,去离子水洗;氨水解吸,收集解脱液经减压浓缩、活性炭脱色、干燥,得到了高纯度的井冈霉素产品,产品收率在70%左右,目前已实现工业化.
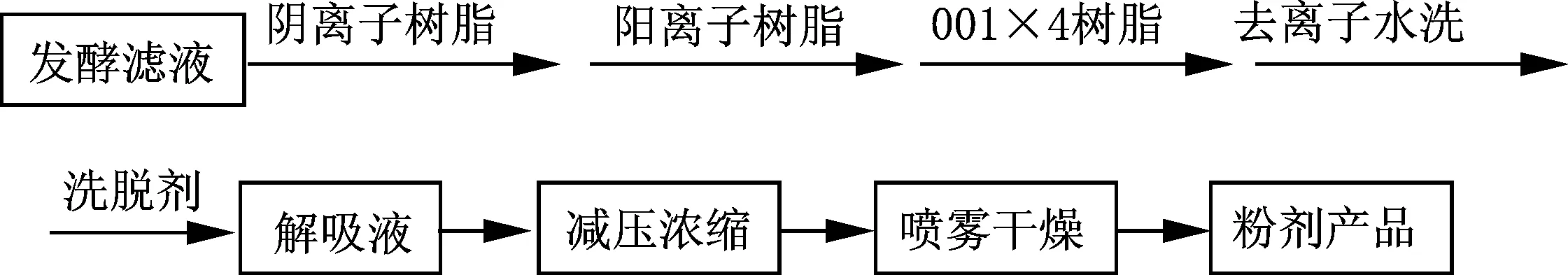
图6 离子交换法提取工艺流程
在井冈霉素下游产品的开发和利用方面,申屠旭萍、郑裕国[8]等用微生物酶解的方法,裂解井冈霉素的C—N键,产生井冈霉烯胺,再通过化学合成生产井冈霉醇胺,井冈霉醇胺是合成伏格列波糖(新一代降糖药)的关键中间体.张宪锋、郑裕国、沈寅初[9]等用微生物转化法裂解井冈霉素生产井冈霉亚基胺A,制备了一种生物杀虫剂.这些都需要高纯度的井冈霉素产品来支持.由于现行离子交换法吸附提取工艺存在流程长、废水排放量大、凝胶树脂吸附量相对较低、收率低、成本高等问题.作者根据井冈霉素分子结构中仲胺基在碱性介质中显电正性的特点,采用一步法吸附提取井冈霉素,如图7所示,即将发酵液调pH = 8~9,采用大孔交联D151树脂吸附,去离子水洗至中性,氨水解脱,解脱液减压浓缩至10波美(减压浓缩时除去的氨气可用树脂再生的盐酸溶液吸收),活性炭脱色,滤液减压浓缩至16波美,真空干燥得白色粉末.井冈霉素含量在95%左右,收得率80%以上.
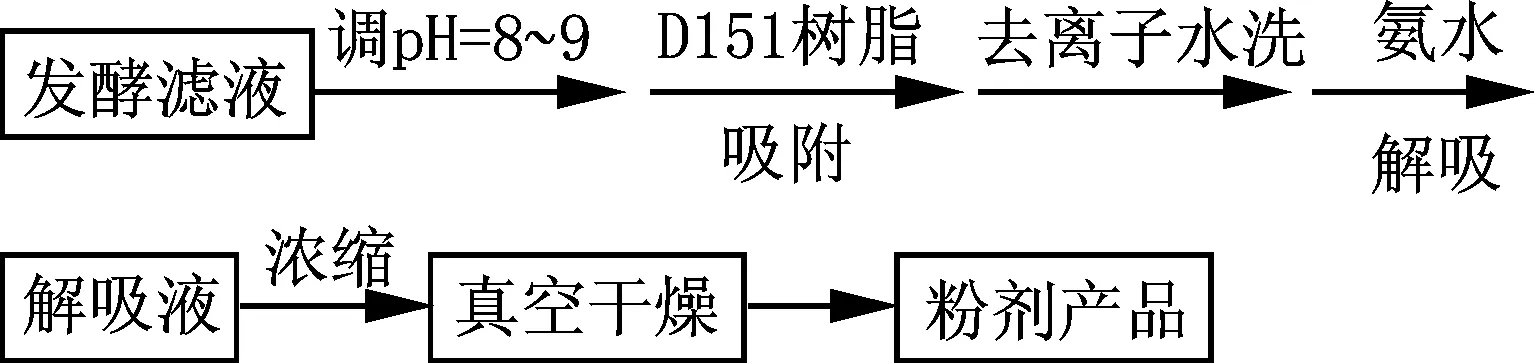
图7 D151吸附树脂提取工艺流程
3 结论
井冈霉素发酵液调pH=8.0左右,在常温下采用D151树脂一步法吸附提取,缩短了树脂提取流程,减少了废水的排放量;采用树脂再生的盐酸溶液吸收减压浓缩除去的氨气,能减少氨气的直接排放.大孔交联D151树脂对井冈霉素吸附量大(0.7 g·g-1干树脂),选择性高,氨水解脱快,提取所得井冈霉素产品质量高(含量在95%).
参考文献:
[1] DONG H J, MAHMUD T, TORNUS I,etal. Biosyn thesis of the validamycins:identification of intermediates in the biosyn thesis of validamycin a by streptomyces hygro scopicus var limoneus[J].J Am Chem Soc, 2001, 123: 2 733-2 742.
[2] SUANI T, OGAWA S, CHIDA N.The revised structure of validamycin A[J]. Antibiotics,1980,(33):98-99.
[3] 郑裕国,汪 钊,陈小龙. 外循环气升式生物反应器气含率及其用于井冈霉素发酵的研究[J]. 中国抗生素杂志,2000,25(2): 105-108.
[4] 上海农药研究所农用抗菌素组编. 井冈霉素[M]. 上海:上海人民出版社,1986.
[5] 郑裕国,虞炳钧,陈小龙,等. 离子交换法提取井冈霉素的研究[J]. 农药,1996,35(11):9-10.
[6] 钟世华,徐满才,齐风佩,等. 大孔弱酸吸附树脂一步法提取井冈霉素:中国,200910043109.2[P]. 2009-04-14.
[7] 沈寅初,叶文炳,程大畏,等.GB/T 9553-93 井冈霉素水剂[S].北京: 化学工业出版社,1993.
[8] 申屠旭萍,郑裕国,俞晓平. 井冈霉素及其分解产物的开发利用[J]. 国外医药抗生素分册,2005,26(06):275-279.
[9] 张宪锋,郑裕国,沈寅初,等. 微生物转化法裂解井冈霉素生产井冈霉亚基胺A [J]. 中国抗生素杂志, 2004,29 (4): 206-210.

