增殖诱导配体和受体在大肠癌中的表达及其临床意义
于 杰,龚治林 (长江大学荆州临床医学院 荆州市中心医院胃肠外科,湖北 荆州 434020)
增殖诱导配体和受体在大肠癌中的表达及其临床意义
于 杰,龚治林
(长江大学荆州临床医学院 荆州市中心医院胃肠外科,湖北 荆州 434020)
目的:观察增殖诱导配体(APRIL)及其受体在大肠癌的表达,并探讨其临床意义。方法:应用荧光定量RT-PCR方法检测大肠癌40份、12份溃疡性结肠炎、12份肠克罗恩病、12份管状腺瘤、12份家族腺瘤性息肉、12份正常大肠粘膜中APRIL及其受体的表达,并分析其临床病理特征的关系。结果:显示在管状腺瘤、家族性腺瘤性息肉和大肠癌组织中APRIL及受体HSPG表达水平显著高于正常对照组、溃疡性结肠炎和肠克罗恩病(P<0.05),在大肠癌组织中表达水平显著高于管状腺瘤和家族性腺瘤性息肉(P<0.05)。结论:APRIL在大肠癌的病变演进过程中呈现累积和渐进趋势。
大肠癌;增值诱导配体;受体
在世界范围内,大肠癌年发病近120万例,发病率在男性恶性肿瘤中排第4位,在女性恶性肿瘤中排第3位[1]。据美国癌症学会估计,2009年美国有146970例大肠癌新发患者,并有49920例患者死于大肠癌[2]。在我国,2002年大肠癌年龄标化发病率为男性13.6/10万人,女性9.2/10万人[3]。研究显示,早中期大肠癌术后5年生存率高达90%以上,甚至可以长期生存,而晚期大肠癌术后5年生存率仅为50%左右,如术后出现吻合口漏等并发症,其术后5年生存率仅30%左右[4],因此早期发现大肠癌非常重要。
增殖诱导配体(a proliferation-inducing ligand,APRIL)是肿瘤坏死因子tumor necrosis factor,TNF) 超家族的新成员,可在多种消化道肿瘤中表达,因此有望作为一种肿瘤标志物通过非侵入性来诊断大肠癌。我们荧光RT-PCR法检测APRIL和它的三个受体TACI、BCMA、HSPG在大肠癌发生各阶段组织中的表达情况,探讨其在大肠癌发生发展中的作用及其相互关系,旨在为大肠癌的早期诊断和寻找抗癌治疗的靶分子提供理论依据。
1 对象与方法
1.1对象100例患者大肠标本中,其中大肠癌40例为我院胃肠外科手术切除标本,其余60份为荆州市中心医院内镜中心内镜下活检组织,正常大肠粘膜、溃疡性结肠炎、肠克罗恩病、管状腺瘤、家族性腺瘤性息肉各12例。所有患者取材前未受过放、化疗或生物治疗等干预治疗。所有标本组织手术切除后于30min内迅速放入液氮,后移至-80℃冰箱冻存,并术后经病理学鉴定证实。
1.2方法
1.2.1 主要试剂 Trizol试剂 (上海生工生物工程公司);cDNA逆转录试剂盒 (上海奇康生物科技有限公司);0.5ml dNTP;10×PCR 缓冲液;DiamondTM 250bp DNA Marker;1000U DiamondTM Taq DNA Polymerase ;DEPC;琼脂糖(均购自上海生工生物工程公司);其他:75%乙醇(RNase free)、氯仿、异丙醇、TAE电泳缓冲液、6×上样缓冲液等。APRIL、TACI、BCMA、HSPG和β2微球蛋白定量标准品 (上海奇康生物科技有限公司)。
1.2.2实验设备 DY-501 B型电泳仪(上海琪特分析仪器有限公司),THZ-C恒温振荡器(江苏太仓实验设备厂),AllegraTM 64R台式高速离心机(美国Backman-Coulter 公司),U-00800 200V DioE ARRAY BIO PHOTOME核酸紫外检测仪(日本HITACHI公司),Dolphin-Doc凝胶成像系统(美国WEAITEC公司)LightCycler荧光PCR仪及软件系统(美国罗氏公司)
1.2.3 引物设计及合成 应用primer premer5.0引物设计软件,设计APRIL、TACI、BCMA、HSPG、内参照基因β2M的引物,由上海生工生物工程公司合成。引物长度分别为APRIL(150bp)、TACI(113bp)、BCMA(142bp)、HSPG(224bp)、β2M(100bp)。
1.2.4RNA提取及逆转录反应 Trizol法提取组织总RNA,核酸蛋白紫外分析仪检测RNA质量和浓度。将逆转录试剂盒从-20℃冰箱取出后室温融化。取0.2ml的离心管依次加入模板RNA 0.1~5μg,引物Oligo(dT)18(0.5μg/μl) 1μl,DEPC水至12μl,将试管移至PCR仪中用Instant Incubate 程序70℃孵育5min,冰上冷却至少1min后离心片刻。再按以下顺序加入其余试剂5×Reaction buffer 4μl,Ribonuclease inhibitor(20U/μl) 1μl,10mmol/L dNTP mix 2μl,升至70℃,10min以终止反应,随后冰上冷却,将反应生成的cDNA分装,并放入-20℃冰箱保存备用。
1.2.5AP RI L及其受体mRNA含量测定 冰上在0.5ml PCR管内依次加入:10×PCR 缓冲液 2.5μl,25mmol/L MgCl21.5μl,10pmol/μl目的基因上游引物 0.5μl,10pmol/μl目的基因下游引物 0.5μl,10pmol/μl β2上游引物1.0μl,10pmol/μl β2下游引物1.0μl,cDNA模板 1.0μl,1U/μlTaq DNA聚合酶 0.2μl。混匀后加入Roche专用毛细管中各反应 管于Roche荧光定量检测仪(Lighcycler) 进 行 PCR扩增,94℃,3min,预变性;94℃,30s→54℃,30s→72℃,50s共30个循环。根据各自标准品建立的标准曲线,软件自动计算 出待测样本中靶基因或p M mR NA的准确含量。
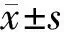
2 结 果
2.1组织总RNA纯度与完整性鉴定电泳结果观察到28、18s两条清晰的条带,紫外分光光度计检测260/280nm的值在1.7~2.2之间才用于进行cDNA合成。
2.2APRIL及其受体的扩增产物特异性鉴定APRIL(150bp)、 BCMA (142bp) 、TACI (113bp)、和 HSPG (224bp)扩增片段经 1.5%琼脂糖凝胶电泳,扩增片段长度与理论大小一致。
2.3APRIL及受体PCR批内和批间重复性检测见表1。

表1 APRIL及受体PCR批内和批间重复性检测结果
2.4APRIL及其受体mRNA的RFQ-PCR检测结果见表2。结果显示,在管状腺瘤、家族性腺瘤性息肉生和大肠癌组织中APRIL及受体HSPG表达水平显著高于正常对照组、溃疡性结肠炎和肠克罗恩病(P<0.05),在大肠癌组织中表达水平显著高于管状腺瘤和家族性腺瘤性息肉(P<0.05)。APRIL在大肠癌的病变演进过程中呈现累积和渐进趋势。

表2 大肠癌及对照组织中APRIL及其受体mRNA的水平
注:与正常对照组、溃疡性结肠炎组和肠克罗恩病组相比,*P<0.05;与管状腺瘤组相比,#P<0.05;与家族性腺瘤性息肉组相比,△P<0.05。
3 讨 论
大肠癌是一种常见的恶性肿瘤,在西方发达国家其发病率居恶性肿瘤谱的第二位。随着人们生活水平的提高、饮食习惯的改变,我国大肠癌的发病率也日渐增高,已跃居第3~5位。上世纪90年代与70年代相比,我国大肠癌的发病率在城市上升了31.95%,在农村上升了8.51%[5]。
大肠癌不同于其他肿瘤,它一般先由正常粘膜上皮转变成腺瘤再变成腺癌的过程,很少有一开始就表现恶性的情况。如果能在大肠癌发生前通过对某些分子的检测达到对其的预警或预测,使其早期能确诊,这对降低大肠癌的发病率或提套临床治愈率有重要意义,但目前仍无单一的分子检测能进行早期预警。
增值诱导配体(APRIL)亦称为TAIL-2、TRDL-1和TNASF-13a,1998年首先由 Ha h n e等[6-7]发现并克隆成功。研究发现,APRIL主要通过靶细胞表面的2个受体[穿膜蛋白活化物(transmembrane activator and CAML interaor,TAC)和B细胞成熟抗原(B cell maturation antigen,BCMA) ] 结合, 从而促进肿瘤细胞的增殖,调节体液免疫,并参与B、T淋巴细胞增殖和活化。人BCMA由TNFRS F17编码,由185个氨基酸组成,胞外区具有50个氨基酸,包括1个富含半胱氨酸结构域(CRD),主要分布在活化的B淋巴细胞中,多发性骨髓瘤细胞系亦高表达,人TACI由TNFRSF13B编码,定位于17p11.2,由293个氨基酸组成,胞外含有2个CRD,主要分布于B淋巴细胞和活化的T细胞表面。人HSPG基因位于1p36.1,根据不同的核心蛋白和葡胺聚糖链HSPG包括大约10余种不同的蛋白聚糖,在哺乳动物主要表达在细胞表面或存在于细胞基底膜和细胞外基质中[8-13]。
我们通过荧光RT-PCR方法测定了APRIL及其受体mRNA在正常大肠粘膜、溃疡性结肠炎、肠克罗恩病、管状腺瘤、家族性腺瘤性息肉及大肠癌中的含量,结果发现APRIL在管状腺瘤、家族腺瘤性息肉及大肠癌中的含量显著高于正常大肠粘膜、溃疡性结肠炎及肠克罗恩病(P<0.05),另外APRIL在大肠癌中的含量显著高于管状腺瘤及家族腺瘤性息肉(P<0.05),而正常大肠粘膜、溃疡性结肠炎、肠克罗恩病之间及管状腺瘤、家族腺瘤性息肉之间APRIL无统计学差异(P>0.05)。以上结果显示APRIL在结直肠癌的病变、演进过程中呈现累积和渐进趋势,提示APRIL在大肠癌发生、发展过程中可能起了重要作用,而且有可能成为结直肠癌早期诊断和抗癌治疗的靶分子。
总之,通过本研究初步探讨了APRIL在大肠癌的不同阶段的含量,为以后进一步研究及抗癌药物的研制提供了一个实验基础。
[1]Garcia M,jemal A,Ward EM,etal.Global cancer facts and figures 2007.Atlanta,GA[J].American Cancer Society,2007,78:12.
[2]Jernal A,Siegel R, Ward E,etal.Cancer statistics,2009[J]. CA Cancer J Clin,2009,59:225-249.
[3]Center MM,Jemal A,Ward E,etal.Research articlesinternational trends in colorectal cancer incidence rates cancer epidemioll[J]. Biomarkers Prev,2009,18:1688-1694.
[4]Scholefield JH,Moss S,Sufi F,etal.Effect of faecal occult blood screening on mortality from colorectal cancer:results from a randomized controlled tria1[J]. Gut,2002,50(6):840-844.
[5]LI Lian-di,RAO Ke-qing,ZHANG Si-Wei,etal.statistical analysis of data from 12 cancer registries in China,1993~1997[J]. Bulletin of Chines Cancer,2002,11(9):497-507.
[6]Hahne M,Kataoka T,Schroter M,etal.APRIL, a new ligand of the tumor necrosis factor family,stimulates tumor cell growth[J].Cancer Res,2000,5(12):1021-1027.
[7]Kelly K,Manos E,Jensen G,etal.APRIL/TADL-1.a tumor necrosis factor-like ligand,stimulates cell death[J].Cancer Res,2000,5(12):1021-1027.
[8]Rennert P,Schneider P,Cachero T,etal.A sluble form of B cell maturation antigen,a receptor for the tumor necrosis factor family member APRIL,inhibits tumor cell growth[J]. J Exp Med,2000,192:1677-1684.
[9]Mackay F,Schneider P,Rennert P,etal.BAFF and APRIL:A tutorial on B cell survival[J].Ann Rev Immunol,2003,21(4):231-264.
[10]Roschke V,Sosnovtseva S,Ward C,etal.Blys and APRIL form biologically actibe hetertrimers that are expressed in patients with systemic immune-based rheumatic diseases[J]. J Immunol,2002,168:4314-4321.
[11]Wu Y,Bressette D,Carrell J,etal.Tumor necrosis factor (TNF)receptors superfamily member TACI is a high affibity receptor for TNF family member APRIL and BlyS[J]. J Biol Chem,2000,275:35478-35485.
[12]Yu G,Boone J,Dclaney J,etal.APRIL stimulates B and T cell function by binding BCMA and TACI[J].Nat Immunol ,2000,1(2):252-256.
[13]Stein JV,Lopez-Fraga M,Elustondo FA,etal.APRIL modulates B and T cell immunitu[J]. J Clin Invest,2002,109:1587-1598.
[编辑] 一 凡
10.3969/j.issn.1673-1409(R).2010.03.009
R735.3
A
1673-1409(2010)03-R020-03

