雷公藤甲素对血管紧张素II诱导足细胞损伤的保护作用及其机制研究
陈朝红 洪亦眉 秦卫松 曾彩虹 刘志红
各种损伤 (免疫,毒物,感染,高糖,局部缺血等)均可触发足细胞损伤和缺失。足细胞缺失达到一定程度后,残存的足细胞代偿性工作,这种长期应激状态将加速足细胞的损伤和脱落,导致更多足细胞丢失,从而启动足细胞受损的恶性循环,血管紧张素 II(Ang II)可放大这一效应。足细胞表达 Ang II的 1型受体(AT1R)和 2型受体(AT2R),Hoffmann等[1]发现,足细胞高表达 AT1R的大鼠在血压无增高、出现微量蛋白尿时,足细胞发生病变,表现为足突融合和足细胞胞体脱落,逐步进展为局灶节段硬化,证实 Ang可直接作用于足细胞。因此,长期以来,Ang II作为足细胞损伤治疗的靶点,抑制 Ang II的产生或抑制其与受体结合的药物可延缓肾小球疾病进展。由于雷公藤甲素对肾小球足细胞疾病具有广泛的治疗作用[2-7],而 Ang II是介导足细胞损伤的重要因素,并参与了肾小球疾病的进展。我们前期研究发现雷公藤甲素对足细胞损伤有直接的保护和修复作用,可拮抗氨基核苷嘌呤霉素对足细胞的损伤,稳定足细胞的骨架结构[8]。针对雷公藤甲素能否拮抗 Ang II导致的足细胞损伤,我们体外观察了雷公藤甲素对 Ang II诱导的足细胞损伤的直接保护作用,并探讨其作用机制。
材料与方法
药品 雷公藤甲素由中国药品生物制品检定所提供。样品经高效液相层析分析,纯度 >99%。雷公藤甲素以二甲基亚砜(DMSO)配制成 10mg/ml的储存液,储存于 -20℃冰箱,实验前应用时,用培养液新鲜稀释成所需浓度,DMSO的浓度不超过0.001%(V/V)。
试剂和仪器 Ang II(Sigma);RPMI-1640(GIBCO)培养液中,含 10%灭活小牛血清(四季青生物工程技术研究所,杭州);青霉素、链霉素各 100 U/ml;重组小鼠 γ干扰素(IFN-γ)(R&D),CM-H2DCFDA(GIBCO),罗丹明标记的鬼笔环肽(cytosleleton),紧密连接蛋白 1(ZO-1)单抗(Zymed),FITC标记的兔抗小鼠 IgG(DAKO),抗p-38、抗 C-Jun氨基端激酶(JNK)、抗细胞外信号调节激酶 1/2(ERK1/2)磷酸化和非磷酸化抗体,HRP标记的兔抗小鼠 IgG、山羊抗兔 IgG和驴抗山羊 IgG(上海康成),p-38丝裂原活化蛋白激酶(MAPK)抑制剂 SB203580,ERK MAPK抑制剂 U0126,JNK MAPK抑制剂 SP600125均购自 Sigma,增强的化学发光 试剂 ECL(上海康成),显影液、定影液(乐凯),激光共聚焦显微镜(Zeiss LSM 510)。
足细胞培养 永生化温度敏感小鼠足细胞系(heat-sensitive mouse podocytes,HSMPs)由美国华盛顿大学 Shankland教授惠赠。HSMPs由 H-2KbtsA58转基因小鼠的肾小球分离培养获得。tsA58为温度敏感 SV40大 T抗原,其表达受 IFN-γ诱导的启动子调控。足细胞于 33℃,在重组小鼠 IFN-γ(150 U/ml)诱导条件下足细胞增生,而在 37℃不含IFN-γ的培养基中培养 10~14 d,足细胞停止增生,获得分化表型。
足细胞的药物处理 Ang II以 10-6,10-7,10-8mol/L的浓度加入培养足细胞作用 2h,作为足细胞损伤的体外研究模型;本研究观察了雷公藤甲素对 Ang II诱导足细胞损伤的保护作用,以及细胞内活性氧(ROS)及其下游 MAPK信号通路与雷公藤甲素保护作用的关系。在观察雷公藤甲素对足细胞损伤的保护作用研究中,雷公藤甲素(1,3,10 ng/ml)与足细胞预孵育 30~60 min后,再加入含Ang II(10-7mol/L)的培养基,继续作用 2h;在雷公藤甲素抑制 Ang II诱导足细胞损伤的机制研究中,雷公藤甲素(10 ng/ml)与足细胞预孵育 30 min,再加入含 Ang II(10-7mol/L)的培养基,继续作用 5~120 min;以及 p-38 MAPK通路抑制剂 SB203580(25μmol/L),ERK MAPK抑制剂 U0126(25 μmol/L),JNK MAPK抑制剂SP600125(25μmol/L)足细胞预孵育 30min,再加入含 Ang II(10-7mol/L)的培养基,继续作用 2h。
足细胞 Ang受体 mRAN定量 分化 14 d的HSMP经 Ang II和雷公藤甲素处理后,使用 trizol试剂(凯基生物)提取 RNA。采用 RT-PCR法对足细胞 AT1R和 AT2R mRNA进行定量。小鼠 AT1R和AT2R以及 GAPDH引物序列分别为:AT1R sense:5'-GGAAACAGCTTGGTGGTG-3',AT1R antisense:5'-CTGAATTTCATAAGCCTTCTT-3',扩增产物为556bp;AT2Rsense:5'-TATGCTCAGTGGTCTGCTG G-3',AT2R antisense:5'-TCTCTCTCTTGCCTTGGA GC-3',扩增产物为 427bp;GAPDH sense 5‘-ATGAC ATCAAGAAGGTGGTG-3‘,GAPDH antisense 5‘-CA TACCAGGAAATGAGCTTG-3‘,扩增产物为 177 bp;引物均由上海生工合成。PCR反应体系包括:1μl的 cDNA,100 nmol上游引物,100 nmol下游引物,200μM dNTP,1×缓冲液,2.5 mMmg2+,1U Taq酶,2μl DMSO混合,加水至 50μl。 PCR反应条件为94℃,45s,55℃,45s,72℃,45s,共 30个循环;72℃,7 min。PCR产物在 2%琼脂糖凝胶上进行电泳,用Brand Leader Application Version 3.00图像分析系统对电泳条带灰度及其面积相对百分比进行分析,以GAPDH光密度值作校正。
荧光显微镜观察足细胞骨架蛋白 接种于chamber slides(Nunc)中的各组细胞,37℃ PBS洗三次,75%冰乙醇固定 10 min后,洗去固定液,加入0.5%Triton X-100透膜 5 min,洗涤,室温避光条件下罗丹明-鬼笔环肽孵育 30 min,PBS洗三次,甘油封片,共聚焦荧光显微镜下(LSM510,Carl Zeiss)观察结果,扫描采集图像。
免疫荧光染色分析足细胞 ZO-1的表达与分布接种于 chamber slides中的各组细胞,PBS洗三次。用 2%多聚甲醛室温固定 30 min;0.5%Triton X-100室温破膜 5 min和 5%BSA室温封闭 30 min;加抗小鼠 ZO-1单抗,室温孵育 2h,空白对照孔仅加抗体稀释液;然后加 FITC标记的抗小鼠二抗室温反应 30 min,PBS洗涤,PI套染细胞核 1 min,PBS洗涤,吹干,甘油封片,共聚焦显微镜下观察,扫描采集图像。
流式细胞仪分析荧光探针 CM-H2DCFDA标记的细胞内 ROS[9]2 ml CM-H2DCFDA(10μmol/L)加入六孔细胞培养板中的足细胞,药物作用足细胞后,用 PBS洗涤细胞三次,以充分去除未进入细胞内的 CM-H2DCFDA,0.25%胰蛋白酶消化收集细胞,流式细胞仪(FACSARIA,BD)分析,使用激发波长 488 nm,发射波长 525 nm的检测参数,以平均荧光强度(mean fluorescence index,MFI)表示细胞内ROS含量,每例样品测定10 000个细胞。
Western blotting检测雷公藤甲素对足细胞内信号通路的影响 25 cm2培养瓶中的各组细胞以预冷的 PBS液洗二次,加入 100μl预冷裂解液,冰浴 5 min,刮勺收集样本,4℃ 12 000 r/min离心 10 min,取上清,以 BCA法测定提取蛋白浓度。每个样本取50μg蛋白加入等体积 2×SDS上样缓冲液煮沸变性后,预制的 10%SDS聚丙烯酰胺凝胶电泳分离后,14V×16h湿法转移至硝酸纤维素膜。转载标本蛋白的硝酸纤维素膜浸入含 5%脱脂奶粉的 TTBS(20 mM Tris-HCl,p H=7.4,150 mM NaCl,0.1%Tween-20),室温封闭 1h,加入一抗(磷酸化 p38,ERK及 JNK,总 p38,ERK,JNK及 GAPDH,1∶1 000稀释),4℃孵育过夜,TTBS洗涤 15 min×4次后,加入 HRP标记的山羊抗兔或驴抗羊二抗(1∶5 000稀释),室温孵育 1h,充分洗涤后,用增强的化学发光系统(ECL,上海康成)检测标本膜上的信号,所有目的条带与内参均在同一张膜上检测,X片记录实验结果。利用上海复日图像分析系统进行条带的分析。
统计学处理 采用 SPSS 11.0软件进行统计学分析。计量资料以均数 ±标准差表示,两组间比较采用 t检验。P<0.05为差异有统计学意义,P<0.01时统计学差异显著。
结 果
雷公藤甲素对足细胞 Ang受体表达的影响在 mRNA水平,RT-PCR扩增后,琼脂糖电泳中出现556 bp和 427 bp的目的条带,显示我们体外培养的小鼠足细胞系表达 AT1R和 AT2R。进一步的定量实验显示,不论是Ang II单独作用,还是雷公藤甲素单独作用,或雷公藤甲素与Ang II联合作用,均不影响足细胞 AT1R和 AT2R的表达水平(图1)。
雷公藤甲素对 Ang II诱导足细胞骨架蛋白破坏的保护作用 足细胞于 37℃,无 IFN-γ的培养基中分化 14 d,观察骨架结构的形态,结果显示,正常分化的足细胞,细胞骨架呈丝状结构,密度大,丝强劲有力,沿细胞呈极性分布(图2A),Ang II呈剂量依赖性破坏足细胞骨架结构。10-8mol/L Ang II对足细胞骨架结构无明显的损伤作用,部分细胞出现F-actin变细;10-7mol/L Ang II干预 2h,足细胞骨架结构被明显破坏,细胞骨架的极性消失,排列紊乱,部分足细胞 F-actin出现溶解(图 2B);10-6mol/L Ang II作用后,F-actin几乎完全解聚,少数细胞尚有残存的被切断的丝状结构。雷公藤甲素与足细胞预孵育 30 min后,再加入 Ang II作用 2h,足细胞骨架结构得以很好的保存,雷公藤甲素的保护亦呈剂量依赖性,10 ng/ml雷公藤甲素的保护作用较 3 ng/ml更为明显(图 2C、D),但雷公藤与足细胞预孵育 30 min或 60 min,其对足细胞的保护作用无明显差异。

图1 足细胞血管紧张素 II(Ang II)的 1型受体(A)与 2型受体(B)
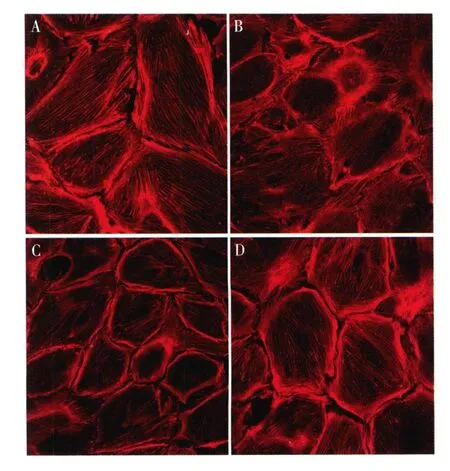
图2 雷公藤甲素对血管紧张II(Ang II)诱导足细胞骨架破坏的保护作用(IF,×400)
雷公藤甲素对 Ang II诱导的足细胞间细胞断裂的保护作用 正常分化的足细胞,ZO-1沿细胞边界呈均匀连续的线状分布,细胞边缘光滑,细胞间连接紧密。Ang II呈剂量依赖性破坏足细胞的细胞间连接。Ang II(10-8mol/L)作用足细胞 2h,ZO-1连续的线性分布消失,出现皱褶,但无明显的断裂;Ang II(10-7mol/L)组细胞 ZO-1表达和分布出现明显改变,ZO-1出现明显的断裂(图 3B);Ang II(10-6mol/L)组细胞 ZO-1的破坏进一步加剧,表达减弱、断裂,细胞出现皱缩,细胞间间隙增大。雷公藤甲素与足细胞预孵育 30 min后,能够有效拮抗 Ang II对足细胞细胞间连接蛋白的破坏,雷公藤甲素的保护亦呈剂量依赖性,10 ng/ml雷公藤甲素的保护作用较 3 ng/ml更为明显(图 3C、D),但雷公藤与足细胞预孵育 30 min或 60 min,其对足细胞的保护作用无明显差异。
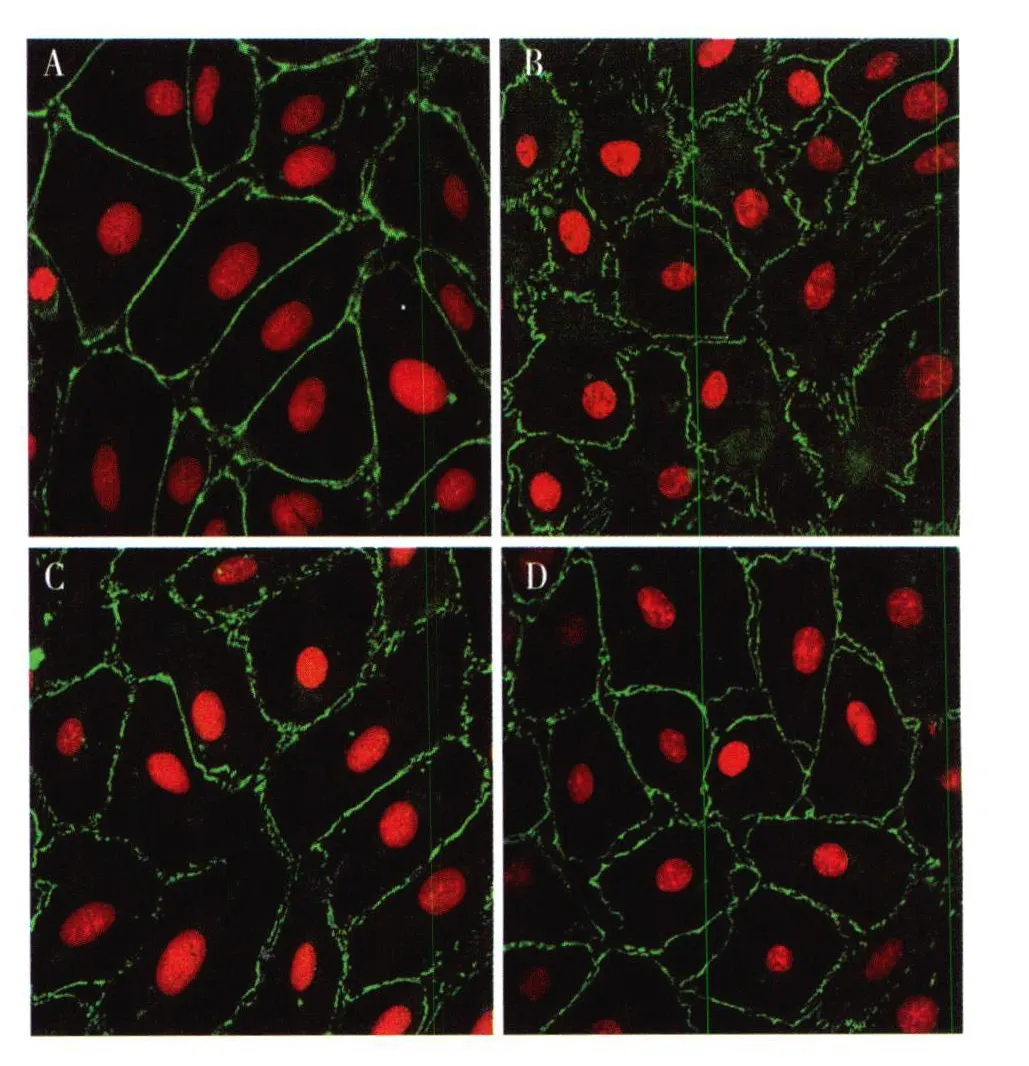
图3 雷公藤甲素对血管紧张素II(Ang II)诱导的足细胞间细胞断裂的保护作用(IF,×400)
雷公藤甲素抑制 Ang II诱导的细胞内 ROS的产生 Ang II(10-7mol/L)作用10 min即可诱导足细胞内 ROS的明显增加,是基础值的近三倍,并持续到 30 min。雷公藤甲素(10 ng/ml)或抗氧化剂 N乙酰半胱氨酸(NAC)(10 mmol/L)预处理细胞后,能够有效遏制 Ang II诱导的细胞内 ROS的产生。与此相平行,足细胞骨架蛋白的荧光染色也证实,抗氧化剂能够阻断 Ang II对足细胞的损伤,进一步说明了 ROS介导了 Ang II对足细胞的损伤。雷公藤甲素抑制 ROS的产生无疑是阻断 Ang II对足细胞损伤作用的重要机制(图4)。

图4 雷公藤甲素抑制Ang II诱导的细胞内ROS产生
雷公藤甲素抑制 Ang II诱导的 MAPK信号通路的活化 Ang II(10-7mol/L)可诱导 MAPK三条信号通路的活化,p-38和 JNK MAPK信号通路较早发生活化。Western blot结果显示,Ang II刺激 10min后,p-38和 JNK MAPK的磷酸化水平即显著升高,分别是对照组的 5.1倍和 4.5倍,并持续到 60 min。ERK MAPK磷酸化水平在 Ang II作用 30min后达到高峰,并持续到 60 min。雷公藤预处理细胞后,能够有效地遏制 Ang II诱导的 MAPK信号通路的活化,p-38,ERK和 JNK MAPK的磷酸化水平显著降低(图5)。足细胞骨架蛋白的荧光染色发现,p-38、ERK MAPK抑制剂 SB203580和 U0126能拮抗 Ang II对足细胞的损伤,而 JNK MAPK抑制剂对 Ang II诱导的足细胞损伤无明显的保护作用(图6)。
讨 论
雷公藤用于治疗肾炎已有 30多年的历史,能明显减少微小病变,局灶节段肾小球硬化(FSGS)和膜性肾病患者的蛋白尿[2-5]。动物实验和临床研究显示,雷公藤甲素对糖尿病肾病(DN)的蛋白尿也有一定的疗效[10,11]。近年来随着对蛋白尿形成机制研究的深入,足细胞病变在大量蛋白尿发生中的重要性得到了充分的认识。足细胞损伤是 DN发病的早期事件,如微量白蛋白尿(MAU)、肾小球肥大等的重要病因,与肾小球硬化、肾功能下降有关系,因此人们将DN也归因于足细胞病。不同病因的足细胞疾病发展到一定程度,有共同的病理机制推动肾小球病变进展直至肾小球球性硬化。Ang II就是导致足细胞受损恶性循环的一个重要因素,临床试验和实践均显示,有效地控制血压、抑制 Ang II的生成或作用,以及减少蛋白尿几乎延缓所有肾小球疾病的进展[9]。雷公藤甲素对多种以足细胞病变为突出表现的肾小球疾病的疗效提示,雷公藤甲素可能作用于推动疾病进展的一个共同因素。我们前期研究发现,雷公藤甲素对免疫因素和非免疫因素介导的蛋白尿的产生均有防治作用[6,7]。体外实验发现雷公藤甲素对嘌呤霉素氨基核苷(PAN)所致的足细胞损伤有直接的保护和修复作用,可拮抗 PAN对足细胞的损伤,稳定足细胞的骨架结构[12]。结合临床上观察到雷公藤对足细胞病的广泛疗效,我们进一步观察了雷公藤对 Ang II诱导足细胞损伤的影响。
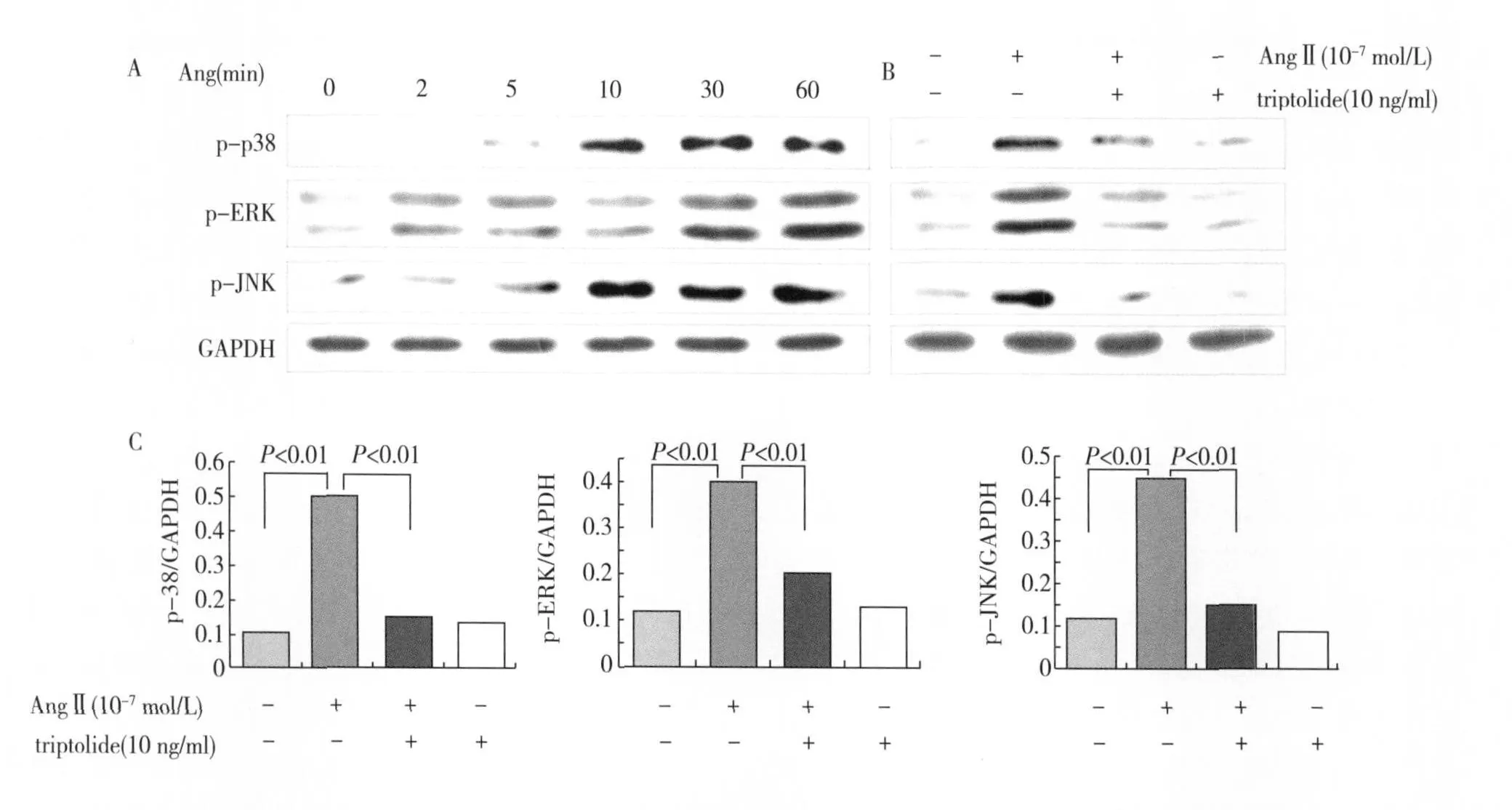
图5 雷公藤甲素抑制 MAPK信号通路的活化
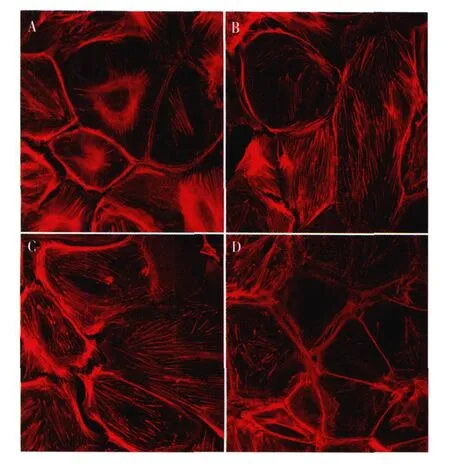
图6 p-38 MAPK和ERK MAPK信号通路介导 Ang II诱导的足细胞骨架损伤
肾素血管紧张素系统(RAS)激活是足细胞损伤的重要因素。一些因素,如高糖,高血压可刺激局部,包括足细胞内 RAS的激活,导致 Ang II释放增加[13]。研究证实足细胞上有 ATIR与 AT2R表达,是 Ang II作用的靶细胞。Ang II可诱导足细胞肥大,刺激足细胞分泌 IV型胶原 α3链的产生,刺激整合素 β1分泌和整合素连接激酶合成[14,15],诱导裂孔膜成分,如 nephrin表达和分布的改变[16]。更为重要的是,有研究表明,Ang II可影响足细胞骨架蛋白和细胞间的紧密连接[17]。以肌动蛋白为中心的细胞骨架是各种损伤因素作用于足细胞引起足细胞损伤的“共同通路”[18],足细胞的骨架结构又是主要由 F-actin、α-actinin和 synaptopodin组成,它们之间在结构和功能上互相支撑、相互影响,其中 actin是足细胞的基本骨架蛋白,对维持足细胞的正常结构和功能具有重要意义。不论引起足突形态变化的因素是什么或损伤的部位在何处,大部分情况下均可先影响足细胞骨架而后引起足突融合的形态改变,同时足细胞相关蛋白分子的改变也能以不同的方式与细胞骨架发生作用从而引起足突融合。细胞间紧密连接蛋白 ZO-1分位于裂孔隔膜的胞质内,是裂孔膜分子(nephrin和 podocin)与 actin连接的桥梁,在裂孔隔膜完整性和信号传导及穿膜蛋白复合体组成中起重要作用[17]。我们的研究表明,Ang II呈剂量依赖性解聚足细胞胞质中应力纤维,破坏足细胞间细胞连接,是 Ang II损伤足细胞的分子基础。失去骨架支撑以及细胞间连接松散的足细胞易于从基膜脱落,是 DN足细胞数目减少的病理基础。如果预先加入雷公藤甲素处理,Ang II上述作用被明显的减弱,足细胞骨架结构得到了很好的保存,拮抗Ang II对足细胞细胞间连接蛋白的破坏。上述研究证实雷公藤甲素对 DN的疗效与其对足细胞直接保护作用有关。那么雷公藤甲素为何对多种因素造成的足细胞损伤均有明显的保护作用,是否因为不同损伤因素通过共同机制影响足细胞功能呢?
Ang II通过细胞上表达的 1型和 2型受体发挥生物学作用,高糖和机械牵张等因素可诱导 AT1R的表达[19]。我们的研究结果显示,雷公藤甲素并不影响足细胞上 AT1R和 AT2R的表达,提示雷公藤甲素的作用靶点可能在细胞内的下游信号通路。
氧化应激参与了多种肾小球疾病的发病过程,包括 DN的发生发展[20-23]。足细胞不仅是 ROS作用的靶细胞,同样也是产生 ROS的源头。研究表明,PAN可刺激足细胞内 ROS的产生[12,24],ROS是PAN导致足细胞损伤的初始因素[25]。而 Ang II可诱导血管内皮细胞[26],血管平滑肌细胞[27],成纤维细胞[28]等多种细胞内 ROS的产生。我们发现,Ang II同样刺激足细胞内 ROS的产生,Ang II(10-7mol/L)作用 10 min即可诱导足细胞内 ROS的明显增加,是基础值的近三倍,足细胞骨架蛋白的荧光染色证实,抗氧化剂 NAC能够阻断 Ang II对足细胞的损伤。进一步说明 ROS介导了 Ang II对足细胞的损伤。而雷公藤甲素(10ng/ml)预处理细胞后,能够有效抑制 Ang II诱导的细胞内 ROS的产生。在前期研究中,我们发现雷公藤甲素对 ROS的影响参与了其对 PAN诱导足细胞损伤的保护作用,该机制同样介导了雷公藤甲素对 Ang II所致足细胞损伤的保护作用。
细胞内 ROS可直接攻击细胞,或作为类似第二信使的信号分子激活氧化还原敏感性信号通路,如核因子 κB、MAPK、己糖胺等。其中 MAPK是足细胞内重要的信号通路,nephrin可通过 p-38和 JNK MAPK激活转录因子的激动蛋白,而 podocin可明显加强 nephrin的这一信号传递[29],MAPK通路的活化与足细胞损伤,足突融合和蛋白尿的发生密切相关[30]。MAPK家族主要有三条亚信号通路,即经典的 p-38 MAPK通路,细胞外信号调节激酶(ERK1/2)通路,c-un氨基末端激酶(JNK)/应激激活蛋白激酶(SAPK)途径。我们研究发现,Ang II(10-7mol/L)可诱导 MAPK三条信号通路的活化,雷公藤预处理细胞后,能够有效地遏制 Ang II诱导的MAPK信号通路的活化,p-38,ERK和 JNK MAPK的磷酸化水平显著降低。足细胞骨架蛋白的荧光染色发现,p-38、ERK MAPK抑制剂 SB203580和U0126能拮抗 Ang II对足细胞的损伤,而 JNK MAPK抑制剂对 Ang II诱导的足细胞损伤没有明显的保护作用,JNK信号通路的活化在足细胞损伤中的作用还有待进一步研究。
上述研究表明,雷公藤甲素对 Ang II导致的足细胞的损伤有直接的保护作用,表现为拮抗 Ang II诱导的骨架蛋白解聚,拮抗 Ang II诱导的细胞间连接分子的重排。雷公藤甲素的上述作用与细胞内ROS及下游的 p-38、ERK MAPK信号通路密切相关。雷公藤甲素干预Ang II诱导的足细胞损伤可能部分参与了其对肾小球疾病的疗效。
1 Hoffman S,Podlich D,Hähnel B,et al.Angiotensin II type 1 receptor overexpression in podocytes induces glomerulosclerosis in transgenic rats.J Am Soc Nephrol,2004,15(6):1475-1487.
2 黎磊石,张 训,陈惠萍,等.雷公藤治疗肾小球肾炎的临床与实验研究.中华医学杂志,1982,62:581-584.
3 黎磊石,刘志红.雷公藤在肾脏病领域应用的前景.肾脏病与透析肾移植杂志,1997,6(3):203-204.
4 刘志红,黎磊石.雷公藤治疗肾小球疾病的理论与实践.金陵医院学报,1990,3:75-77.
5 黎磊石,张 训,陈光永,等.雷公藤治疗肾小球肾炎的临床研究.中华内科杂志,1981,20:216-220.
6 Chen ZH,Qin WS,Zeng CH,et al.Triptolide reduces proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro.Kidney Int,2010,77(11):974-988.
7 Zheng CX,Chen ZH,Zeng CH,et al.Triptolide protects podocytes from puromycin aminonucleoside induced injury in vivo and in vitro.Kidney Int,2008,74(5):596-612.
8 陈朝红,刘志红,孙 骅,等.雷公藤甲素干预足细胞病变的体外观察.肾脏病与透析肾移植杂志,2007,16(2):119-126.
9 Wigg RC.The spectrum of podocytopathies:A unifying view of glomerular diseases.Kidney Int,2007,71(12),1205-1214.
10 鲁 盈,杨汝春.复方雷公藤对链脲佐菌素诱导糖尿病大鼠肾损伤的防治作用.中华肾脏病杂志,2000,16(2):121-122.
11 张长明,周家俊.雷公藤多苷片对糖尿病肾病患者大量蛋白尿的影响.中国中西医结合肾病杂志,2005,6(11):654-655.
12 Zheng CX,Chen ZH,Zeng CH,et al.Triptolide protects podocytes from puromycin aminonucleoside induced injury in vivo and in vitro.Kidney Int,2008,74(5),596-612.
13 Han SY,Kang YS,Jee YH,et al.High glucose and angiotensin II increase beta1 integrin and integrin-linked kinase synthesis in cultured mouse podocytes.Cell Tissue Res,2006,323(2):321-332.
14 Chen S,Lee JS,Iglesias-de la Cruz MC,et al.Angiotensin II stimulates alpha3(IV)collagen production in mouse podocytes via TGF-γ and VEGF signalling:implications for diabetic glomerulopathy.Nephrol Dial Transplant,2005,20(7):1320-1328.
15 Li JJ,Kwak SJ,Jung DS,et al.Podocyte biology in diabetic nephropathy.Kidney Int Suppl,2007,(106):s36-s42.
16 Doublier S,Salvidio G,Lupia E,et al.Nephrin expression is reduced in human diabetic nephropathy:evidence for a distinct role for glycated albumin and angiotensin II.Diabetes,2003,52(4):1023-1030.
17 Macconi D,Abbate M,Morigi M,et al.Permselective Dysfunction of Podocyte-Podocyte Contact upon Angiotensin IIUnravels the Molecular Target for Renoprotective Intervention.Am J Pathol,2006,168(4):1073-1085.
18 Ichimura K,Kurihara H,Sakai T.Actin Filament Organization of Foot Processes in Rat Podocytes.J Histochem Cytochem,2003,51(12):1589-1600.
19 Durvasula RV,Petermann AT,Hiromura K,et al.Activation of a local tissue angiotensin system in podocytes by mechanical strain.Kidney Int,2004,65(1):30-39.
20 Neale TJ,Ojha PP,Exner M,et al.Proteinuria in passive Heymann nephritis isassociated with lipid peroxidation and formation of adducts on type IV collagen.J Clin Invest,1994(4),94:1577-1584.
21 Budisavljevic MN,Hodge L,Barber K,et al.Oxidative stress in the pathogenesis of experimental mesangial proliferative glomerulonephritis.Am J Physiol Renal Physiol,2003,285(6):F1138-F1148.
22 Binder CJ,Weiher H,Exner M,et al.Glomerular overproduction of oxygen radicals in Mpv17 gene-inactivated mice causes podocyte foot process flattening and proteinuria:a model of steroid-resistant nephrosissensitive to radical scavenger therapy.Am J Pathol,1999,154(4):1067-1075.
23 Pavenstädt H,Kriz W,Kretzler M,et al.Cell biology of the glomerular podocyte.Physiol Rev,2003,83(1):253-307.
24 Marshall CB,Pippin JW,Krofft RD,et al.Puromycin aminonucleoside inducesoxidant-dependent DNA damagein podocytesin vitro and in vivo.Kidney Int,2006,70(11):1962-1973.
25 Rincon J,Romero M,Viera N,et al.Increased oxidative stress and apoptosis in acute puromycin aminonucleoside nephrosis.Int J Exp Pathol,2004,85(1):25-33.
26 Xie Z,Pimental DR,Lohan S,et al.Regulation of angiotensin II-stimulated osteopontin expression in cardiac microvascular endothelial cells:role of p 42/44 mitogen-activated protein kinase and reactive oxygen species.JCell Physiol,2001,188(1):132-138.
27 Touyz RM,Yao G,Viel E,et al.Angiotensin II and endothelin-1 regulate MAPkinases through different redox-dependent mechanisms in human vascular smooth muscle cells.J Hypertens,2004,22(6):1141-1149.
28 Sano M,Fukuda K,Sato T,et al.ERK and p 38 MAPK,but not NF-kappaB,are critically involved in reactive oxygen species mediated induction of IL-6 by angiotensin II in cardiac fibroblasts.Circ Res,2001,89(8):661-669.
29 Huber TB,Kottgen M,Schilling B,et al.Interaction with podocin facilitates nephrin signaling.JBiol Chem,2001,276(45):41543-41546.
30 Koshikawa M,Mukoyama M,Mori K,etal.Role of p38 mitogen-activated protein kinase activation in podocyte injury and proteinuria in experimental nephrotic syndrome.J Am Soc Nephrol,2005,16(9):2690-2701.
- 肾脏病与透析肾移植杂志的其它文章
- 南京军区南京总医院全军肾脏病研究所博士后招聘信息
- 肾脏病专业研究生报考信息

