在元素周期表中添加C族的设想
徐丙申
(河南工程学院 环境工程系,河南 郑州 451191)
过去的光谱试验表明,Yb、Lu的结构分别为[Xe]4f135d16s2、 [Xe]4f145d16s2.这表明,镥是最后一个充填4f轨道的元素.因此,将其列为镧系元素的最后一个元素.但是后来的光谱试验表明,Yb结构为[Xe]4f146s2, 这说明它是f区的最后一个成员, 而镥在4f充满后充填了3d态的第一个电子,因而它是d区的第一个元素.比较Sc、Y、La、Lu的外围电子结构、物理性质及化学性质可以得出Sc、Y、Lu较为相似的结论[1].而La的结构为[Xe]5d16s2, 其中4f轨道是全空的,而Sc、Y内层轨道是全满的.La与Sc、Y的结构差异较大.此外Sc、Y、与La的物理性质及化学性质差异也较大[2].鉴于此,一些学者已经重新界定镧系元素的位置[3].镧系元素不是15个而是14个,镧元素属于镧系而镥元素不属于镧系,镧系元素不是占据ⅢB族一个格子而是占据s区与d区之间的狭缝[4].
重新界定镧系元素使镥元素有了很好的归宿,却产生了新问题,即镧系元素在周期表中失去了确切的位置.要解决这个问题,现有的元素周期表要加以改进.笔者认为,有必要添加一个C族解决这个矛盾.
1 建立C族的设想
建立C族的设想如下:镧系从La到Yb,锕系从Ac到No共28个元素14个列,移到s区与d区之间.元素周期表由18列改成32列.
从La到Pm和与之对应的Ac到Np分别为ⅢC至ⅦC族.从镧系的Sm至Er和与之对应的Pu至Fm共14个元素为ⅧC族.Tm与Md为ⅠC族Yb与No为ⅡC族.新周期表见图1.
这样安排的根据是他们的外围电子结构.从La至Pm的外围电子数从3个变为7个,从Ac到Np 也如是.最高化合价变化与B族也有相似之处,从Sc到Mn最高化合价由+3变成+7.从Ac到Np最高化合价也是从+3变为+7,见表1. 由于镧系元素在结构上的特点使得它的化合价最高不超过+4.
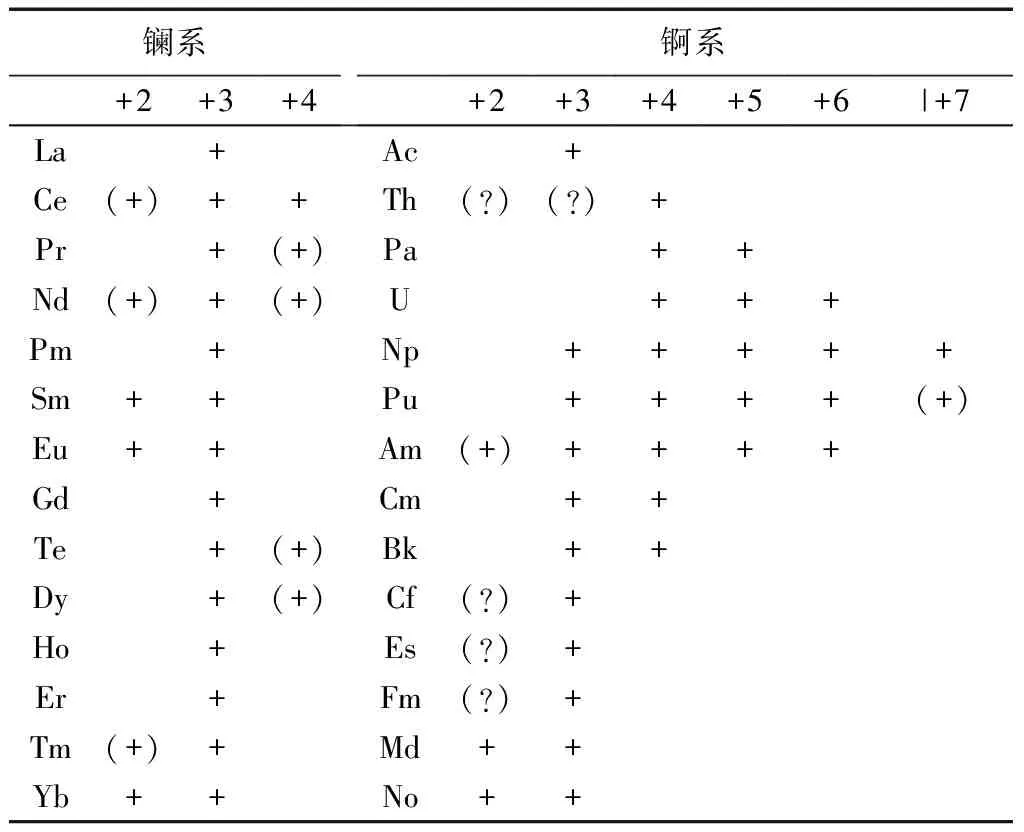
表1 镧系和锕系元素的氧化数[6]Tab.1 The oxidation of lanthanide and actinide
注:+表示在溶液里,(+)表示仅在固态存在,(?)表示存疑.

图1 32列元素周期表Fig.1 Periodic table with 32 columns
ⅠC族与ⅠB结构也有差异.ⅠB族如铜的结构[Ar]3d104s1,这种排列是由于3d是全充满轨道,4s是半充满轨道,比[Ar]3d94s2能量更低更稳定.但是,ⅠC族的Tm结构为[Xe]4f136s2这种排列比[Xe]4f146s1更稳定.这是由于6s上的一个电子如果进入4f比较困难,因为4f轨道被埋藏在5s5p之内,由于5s5p的隔绝使ⅠC和ⅠB族在化合价方面也显示了不同.ⅠB族的Cu显示了+1、+2价,而Tm显示了+2、+3价没有+1价的化合物.ⅡB、ⅡC族在结构上相似之处要多一些,如Zn的外围电子结构[Ar]3d104s2,d轨道全充满,ⅡC的Yb在结构上[Xe]4f146s2,f轨道全充满,Zn的化合价显示+2而Yb显示了+2、+3价.
比较B族与C族元素可以看出,同一周期中从左至右最高氧化数逐渐升高随后又逐渐降低,同一列中从上而下高氧化态趋于稳定.
2 镧系元素的结构特点
2.1 4f电子对外层电子较弱的屏蔽作用
镧系元素4f轨道电子是外数第三层电子,当原子核增加一个质子时核外4f轨道上也增加一个电子,但是4f轨道上的电子不能有效地遮挡,使得原子核对外层的5s5p电子的吸引增强了,因而出现了镧系离子半径随原子序数的增加而减小,即所谓镧系收缩.
比较镧系元素的原子半径也可以看出随原子序增加原子半径总体上也在缩小.但是当4f电子处于半充满和全充满时(如Eu和Yb)原子半径突然增大,原因在于Eu和Yb的原子中没有5d电子.d电子对于金属键的贡献比f电子大,金属键的减弱使得原子核间的距离增加,原子半径出现了双峰[6].
还有学者认为,Eu的4f轨道为半充满(4f7)Yb的4f轨道为全充满(4f14)与f轨道的其他状态比较这种构型对原子核有较大的屏蔽作用因而导致原子半径明显增大[7].
2.2 5s5p电子对4f电子的埋藏作用[6]
镧系元素的4f电子被5s5p电子紧紧地埋藏在其中使其与外界处于半隔绝状态.4f电子不容易失去,我们至今没有发现氧化数大于+4的镧系元素化合物.
正是这种埋藏作用也使得6s电子难于进入4f轨道.气态铥Tm(g) 外层结构为4f136s2而不是4f146s1,钐的气态原子Sm(g)外层结构为4f66s2而不是4f76s1.
应该注意的是,5s5p电子对4f电子有埋藏作用,4f对5s5p也有反埋藏作用.4f试图摆脱5s5p的埋藏.如果没有这种反埋藏作用,就不存在4f电子会失去的现象.它既然能失去,就说明5s5p的包埋作用不是绝对的.用4f的反埋藏作用可以解释为什么某些镧系元素可以显示+4价,即在失去6s的2个电子和5d的1个电子之后还可以失去1个4f电子.如果没有5d电子还可以失去2个4f电子.从现有的实验数据看,它们难于失去更多的电子,因而镧系元素氧化数没有超过+4的.
2.3 基态原子电子组态的不确定性
镧系元素自由原子的基态有两种类型: [Xe]4fn6s2和 [Xe]4fn-15d16s2,如表2所示.

表2 镧系元素在不同状态时电子构型[6]Tab.2 The electron configuration of Lanthanide in different state
从表2中可得以下结论,物理状态的改变即可影响它的电子组态[6],说明镧系元素的4f态电子能量与5d轨道能量十分接近.图2表示原子轨道能量与原子序的关系[6],从图2也可以看出核电荷57~71这一节段内4f与5d能量接近而交错,因而出现同一元素不同状态下原子结构不同.表2中的Pr在固态时的外围原子结构为4f25d16s2, 而在气态时外围原子结构为4f36s2, 可见电子在4f轨道5d轨道之间容易搬迁,镧系元素基态原子电子组态的不确定性是镧系素元不同于其他原子的重要区别.4f和5d轨道的差别应当由两个方面体现:一是能级;二是电子云在核周围空间的分布.如果第一个差别不大,那么差别主要由电子云在空间的分布来体现了.

图2 原子轨道能量与原子序的关系Fig.2 The relationship between the atomic orbital energy and atomic number
3 镧应属于镧系
1968年10月,IUPAC推荐把镧以后的原子序数为58至71的铈至镥14种元素称为镧系元素.这个推荐的理由也是出于镧原子中没有f态电子的考虑.镧核外电子的结构为[Xe]5d16s2, 所以把它从镧系元素中取出了.笔者有不同的观点,理由如下.前已述及La与d区的Sc、Y在结构和性质上差别较大而Sc、Y、Lu无论在结构上还是在性质上更为相似,所以镥应占据第六周期ⅢB族的位置,镧系元素只能占据s区与d区的狭缝.La不属于s区,因为在同周期中Cs、Ba填满了s区,La又被Lu挤出了d区,它只能与Ce等元素属于f区元素.为什么镧元素没有填充4f轨道而填充了5d轨道,这与上述的4f、5d轨道能量相当、能级交错有关.镧元素中的4f与5d轨道的能级差异微乎其微,它们的差异主要表现在电子云的空间分布上.
将镧放于镧系的第一个位置,将镥从镧系中去除放于d区的第一个位置,这样安排更合理.在同一周期中,每种轨道的电子数与元素的个数相等是普遍现象.S态有2个电子,s区每周期有2个元素;p态有6个电子,p区有6个元素;d态有10个电子,d区有10个元素;而f态电子有14个却有15个元素.显然,应去掉一个,从现有的资料来看去掉镥更合理.
4 Ⅷ族与 ⅧC族的比较
Ⅷ族与 ⅧC族在结构上有相似之处,他们的外围电子数等于或大于8.Ⅷ族(n-1)d轨道未充满,而ⅧC族(n-2)f轨道未充满.Ⅷ族最高化合价为+8. Ru、Os有+8价的显示,其余元素没有+8价的记载.ⅧC族元素最高化合价为+7而没有+8价的记载.无论Ⅷ族还是 ⅧC族都显示了高价态和多种价态的特点.同列元素自上而下化合价有升高趋势.Ⅷ族与 ⅧC族元素除了Os外均是银白或灰白色的金属.Ⅷ族的Fe、Co、Ni具有铁磁性而 ⅧC族的Sm、Gd、Dy、Ho、Er也具有铁磁性.
由于d态电子对金属键的贡献较f态电子更大,Ⅷ族单质熔点与同周期 ⅧC族单质熔点相比高得多.Ⅷ族与 ⅧC族元素结构性质比较见表3.

表3 Ⅷ族与ⅧC族元素性质比较Tab.3 Comparing the nature of elements of Ⅷ family with elements of ⅧC family
5 建立C族的意义
(1) 建立C族使镧系和锕系元素找到了在周期表中准确的位置.它们不再是15个元素占据1个格子也不是14个元素占据1条缝,而是占据了14个列.每个元素占据一个格子对于深入研究镧系和锕系元素有着积极意义.
(2) C族的建立对预测未知元素的性质有了新的依据.现有周期表从第二周期开始每隔两个周期出现新区.依此规律第8周期将出现g态电子,将产生一个g区.按照建立C族后的周期表推测, g区应在s区与f区之间.根据4个量子数的关系, g态电子的角量子数L=4,磁量子数m=2L+1=9,所以g态电子共有18个.第8周期将有s、g、f、d、p共5个区.这样,第8周期将是一个50元素的超长周期,如图3所示,其原子序数从119至168.在g区将出现一个D族如图4所示.该区有8个族18列,其中ⅧD族将有11个列.排列顺序与d区元素相同,即从ⅢD——ⅧD然后是ⅠD、ⅡD. g区元素全部是金属,因为它的位置在周期表的左下方,其金属性比镧系元素金属性强.超长周期的元素绝大部分是金属,仅可能有一个非金属元素和一个稀有气体元素.


图3 第八周期元素分区Fig.3 The partition of eighth cycle elements

图4 第八周期g区元素在周期表中的位置Fig.4 The location of g region of eighth cycle in periodic table
目前,科学家对原子核内部结构提出了稳定岛的假说,认为中子数和质子数为幻数的原子核可以形成稳定的同位素,它的四周被不稳定的同位素如同海洋一样包围着,稳定元素如同在海洋中的山脉、山峰或孤岛.
所谓幻数是指在质子数和中子数为某个特定数值或两者均为这一数值时,原子核的稳定性就比平均值大.这些数值被称为“幻数”. 迄今已知的幻数有2、8、20、28、50、82、126,例如在自然界中广泛存在的氦、氧、钙、镍、锡、铅,其质子数或中子数就分别与2到82的数值相对应.质子数和中子数同为126的元素目前尚未发现,但是质子数为82、中子数为126的铅208(铅的同位素)在自然界是存在的. 有科学家估计,在稳定岛中z=110、114、126的元素比较稳定甚至有可能在自然界找到.上述的126号元素是第8周期g区的元素.按照我们对周期表的新认识它应属于ⅧD族,其在周期表中的位置类似于Fe和Sm.推测一下它的性质:可能为白色金属,熔点低于镧系金属的熔点,可能具有铁磁性,氧化数很有可能是+2或+3也可能有更高的氧化数.
参考文献:
[1] 古国榜, 谷云骊. 无机化学[M]. 北京:化学工业出版社, 1997.95-374.
[2] 徐丙申,马英歌. 元素周期表中ⅢB族元素重新界定的若干问题的探讨[J]. 河南科学, 2004,22(1):40.
[3] 徐丙申,马英歌.镧系和锕系元素的重新界定与32列元素周期表[J]. 河南科学,2003,21(2):154.
[4] 英国shefield大学化学系[DB/OL].www.webelements.com.
[5] 华南理工大学无机化学教研室. 无机化学(第三版)[M].北京:高等教育出版社,1994.397.
[6] 付献彩. 大学化学(下册)[M]. 北京:高等教育出版社,1999.813-816.
[7] 李保山.基础化学[M].北京:科学出版社,2003.9,519.

