AcSDKP对体外培养条件下人骨髓间充质干细胞增殖周期的影响
戴 国,李 烨,彭 彬,徐 倩,汪保和
(湖南师范大学生命科学学院, 中国 长沙 410081)
N-乙酰基-丝氨酰-天冬氨酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartyl-lysyl-proline, AcSDKP)是细胞生长的一种生理性调控因子,是在胎牛骨髓中发现的[1].AcSDKP能阻止造血干/祖细胞进入S期,使之停留在Go期,抑制它们的增殖[2-3].进一步的研究发现,AcSDKP对非造血细胞如淋巴细胞,肾间质成纤维细胞等有生长抑制作用[4],对心肌、肺组织纤维化也有一定的抵抗作用[5-6].作者所在实验室前期的研究发现,AcSDKP能抑制体外培养条件下人和小鼠骨髓间充质干细胞(mesenchymal stem cells, MSCs)的增殖[7].本研究的主要目的是通过分离、纯化和培养人骨髓MSCs,观察AcSDKP对这种成体干细胞增殖周期的影响,为阐明该因子对MSCs的增殖调控机制提供新的论据.
1 材料和方法
1.1 主要试剂
DMEM培养基(低糖)、卡托普利、胰蛋白酶、AcSDKP、四甲基偶氮唑盐(MTT)、碘化丙啶(PI)、5-溴脱氧尿嘧啶核苷(BrdU)为Sigma公司产品.胎牛血清(FBS)购于杭州四季青公司.淋巴细胞分离液(1.077±0.002 g/L)为上海国药集团生化公司产品.小鼠抗人BrdU抗体购于Oncogene Science公司;生物素化羊抗小鼠IgG、DAB显色试剂盒购于武汉博士德生物公司.培养器皿为Costar公司产品.
1.2 人骨髓单个核细胞的分离
从中南大学湘雅医院胸外科获取择期手术切口中摘除的肋骨段,病人无血液系统疾患且无肋骨病变.在无菌条件下剪成约3 cm小段,用DMEM培养液冲出骨髓,依次用带7号、6号、4号针头的注射器将骨髓悬液吸打各3次,制成单细胞悬液.将单细胞悬液加于淋巴细胞分离液上,1 500 r/min离心10 min,收集中间层单个核细胞,用DMEM重悬所收细胞,洗2次,计数备用.
1.3 MSC的纯化和传代培养
取骨髓单个核细胞混于20%(体积分数,下同)FBS的DMEM液中,悬液含细胞5×106个/mL,种入塑料培养瓶,于35 ℃、5%CO2、饱和湿度条件下培养.3 d后更换一次培养液,相同条件下继续培养,至细胞增殖而铺满瓶底约90%面积时,用胰蛋白酶消化法收集细胞,于同样培养体系和条件下传代培养,以扩增和纯化人骨髓MSC.
1.4 BrdU掺入法
取第3代MSC,接种于内置一盖玻片的35 mm塑料培养皿中,细胞密度为1×105个/mL.分4组进行培养,对照组加入20%FBS的DMEM,另3组在对照组基础上添加AcSDKP,终浓度分别为1×10-9,1×10-10和1×10-11mol/L.培养5 d后加入BrdU(终浓度为30 μmol/L), 继续培养2 h.取出盖玻片,按试剂盒说明书依次操作如下:PBS洗3次,4%多聚甲醛固定30 min.滴加0.3%H2O2:甲醇,灭活内源性过氧化物酶.滴加5%正常兔血清封闭液,室温20 min.甲酰胺100 ℃, 5 min变性核酸.滴加小鼠抗BrdU单抗(工作浓度1∶250),4 ℃过夜.滴加生物素化羊抗小鼠IgG(1∶100),37 ℃,20 min.加SABC(链酶亲和素-生物素-过氧化物酶复合物),37 ℃,20 min.DAB(3,3-二氨基联苯胺)显色.阴性对照:同样条件下培养的未加BrdU的 MSC.随机计数10个高倍视野中细胞总数及BrdU阳性细胞数,计算标记指数(LI)[8].
标记指数(LI)=标记细胞数/计数细胞总数×100%.
1.5 流式细胞术
将浓度分别为1×10-10,1×10-11,1×10-12mol/L 的AcSDKP添加组与对照组培养瓶细胞培养至接种后第5天,细胞80%融合时,胰蛋白酶消化法收集细胞,以1×106个细胞密度悬浮细胞,经荧光染料碘化丙锭(PI)溶液避光染色30 min,流式细胞仪488 nm检测,获取DNA含量分布组方图,确定各期细胞数.
1.6 MTT比色法
取传代培养第3代的MSC,分5组接种于24孔塑料培养板,5×103个细胞/孔,第一组(对照组)添加20%FBS的DMEM;在对照组基础上,第二至五组加AcSDKP(终浓度分别为1×10-12,1×10-11,1×10-10,1×10-9mol/ L),同时加入卡托普利(终质量浓度为10-6μg/L).按前述条件培养24 h后小心吸去悬液,MTT检测,490 nm波长下读取A值(absorbance value).重复实验3次.
1.7 AcSDKP对MSC集落生成抑制作用可逆性的检测
将人骨髓单个核细胞混于20%FBS的DMEM中,培养体系含细胞2×106个/mL,种入12孔塑料培养板,每孔1 mL.35 ℃、5%CO2、饱和湿度下培养.3 d后,轻轻晃动培养板,吸去各孔的培养上悬液和未贴壁的细胞,分4组(3孔/组)做第一次换液.第一、二组换入20%FBS的DMEM,第三、四组加终浓度为1×10-11mol/ L AcSDKP的20%FBS DMEM,同时加入卡托普利(终质量浓度为10-6μg/L).在相同培养条件下继续培养3 d,吸去上悬液,用DMEM轻轻刷洗一次培养孔,按前分组第二次换液.第一组为(1)不换液的不添加AcSDKP组;第二组仍换入20%FBS的DMEM,为(2)换液前后均不添加AcSDKP组;第三组仍换入终浓度为1×10-11mol/ L AcSDKP,为(3)换液后继续添加AcSDKP的全程作用组;第四组换入不含AcSDKP的20%的FBS的DMEM,为(4)换液撤除AcSDKP组.同样条件下继续培养4 d,瑞氏-吉姆萨(Wrighte-Giemsia)染色,光镜下计数MSC集落(≥50个成纤维细胞样细胞的细胞聚合定为一个MSC集落).
1.8 不同血清浓度条件下AcSDKP影响MSC生长的集落形成实验
配含FBS体积分数为10%、20%、30%和40%的人MSC集落培养体系,每一浓度包含2个组,其中一组添加AcSDKP(终浓度为1×10-11mol/L);另一组不添加AcSDKP.按前所述培养后,计数MSC集落,并按下式计算各FBS浓度点AcSDKP对MSC集落生成的抑制率:
抑制率=(不加AcSDKP组集落数-AcSDKP添加组集落数)/不加AcSDKP组集落数×100%.
1.9 统计学处理
2 结果
2.1 骨髓MSC的体外生长状况
图1 传代培养的第3代人骨髓MSC(Scale bar, 20 μm)
骨髓单个核细胞种于塑料培养瓶培养3 d后,在倒置显微镜下可见单个或少量集落生长的贴壁细胞,形态大多呈短梭形或针尖状,有一个核位于中央,可见核仁.10~15 d后,细胞集落不断扩大并形成融合单层,细胞形态大多呈长梭形或多角形.传代培养中,细胞24 h内完全贴壁、伸展,重新变为长梭形,呈均匀分布,增殖迅速,培养7~10 d即达到完全融合 (图1).黏附于贴壁细胞之上的造血细胞和其他细胞在换液的过程中逐渐减少而几近消失.在本实验条件下,人骨髓MSC能在体外扩增10代左右.
2.2 AcSDKP作用下人骨髓MSC的BrdU掺入试验结果
10-11mol/L的AcSDKP添加组标记指数(LI)为(5.93±1.08)%,与对照组(10.57±1.36)%相比,差异有高度显著意义(P< 0.01).10-9mol/L和10-10mol/L AcSDKP添加组的LI分别为(8.07±0.55)%和(6.73±0.52)%,与对照组相比,差异有统计显著性(P<0.05).
2.3 AcSDKP作用下人骨髓MSC细胞周期的FCM分析结果
FCM检测不同浓度AcSDKP培养条件下人骨髓MSC的DNA含量,经计算机处理,获得细胞周期各时相细胞的百分率(见表1).AcSDKP添加组与对照组相比,G0/G1期细胞比例增加,S+G2/M期细胞比例减少,差异有显著意义(P<0.05)(图2).
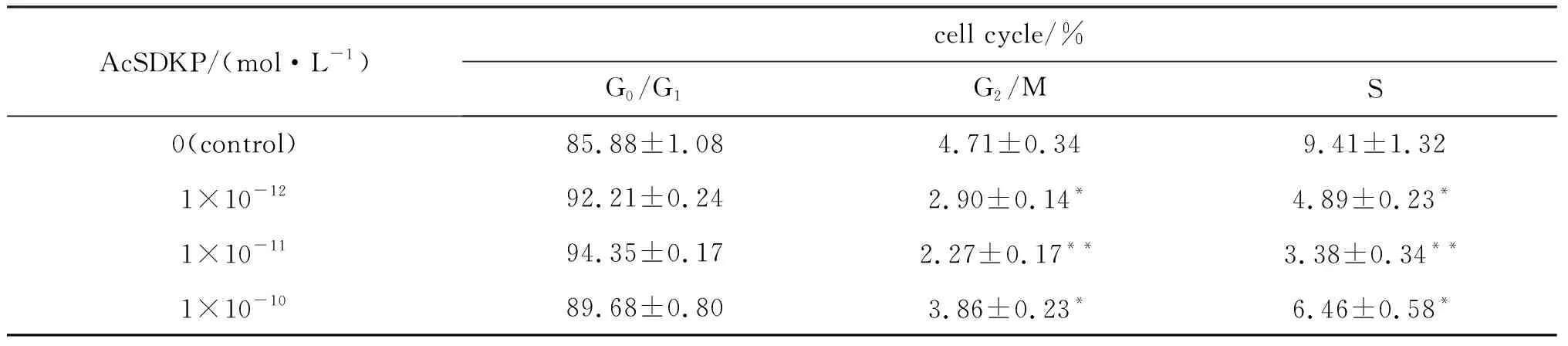
表1 不同浓度AcSDKP培养条件下人骨髓MSC的细胞周期状态
**P<0.01 and*P<0.05, compared with control. Data were from three separate experiments.
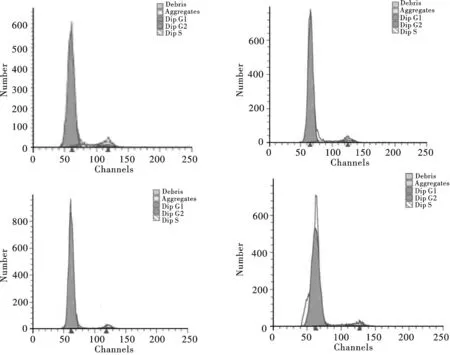
A.control;B.treated by 10-10 mol/ L AcSDKP;C.treated by 10-11 mol/L AcSDKP;D.treated by 10-12 mol/ L AcSDKP图2 AcSDKP对人骨髓MSC细胞周期的影响
2.4 AcSDKP对人骨髓MSC生长抑制作用的可逆性
如图3所示,不换液不加AcSDKP组、换液不加AcSDKP组、换液加 AcSDKP组和换液撤除AcSDKP组的集落生成数分别为(22.46±1.96),(22.84±1.61),(11.50±1.83),(17.51±1.05)个/106BMMNC.换液后撤除AcSDKP组的集落生成数与对照组比较有显著差异(P<0.01),MSC生长得到了一定程度的恢复.
2.5 不同血清浓度下AcSDKP对人骨髓MSC的增殖抑制效应
如图4显示,在FBS为10%、20%、30%的条件下,AcSDKP添加组的集落数明显小于对照组(P<0.05);而FBS体积分数为40%AcSDKP添加组与对照组之间集落生成数差异无显著性意义(P>0.05).在FBS体积分数为40%AcSDKP添加组中抑制率也最低.
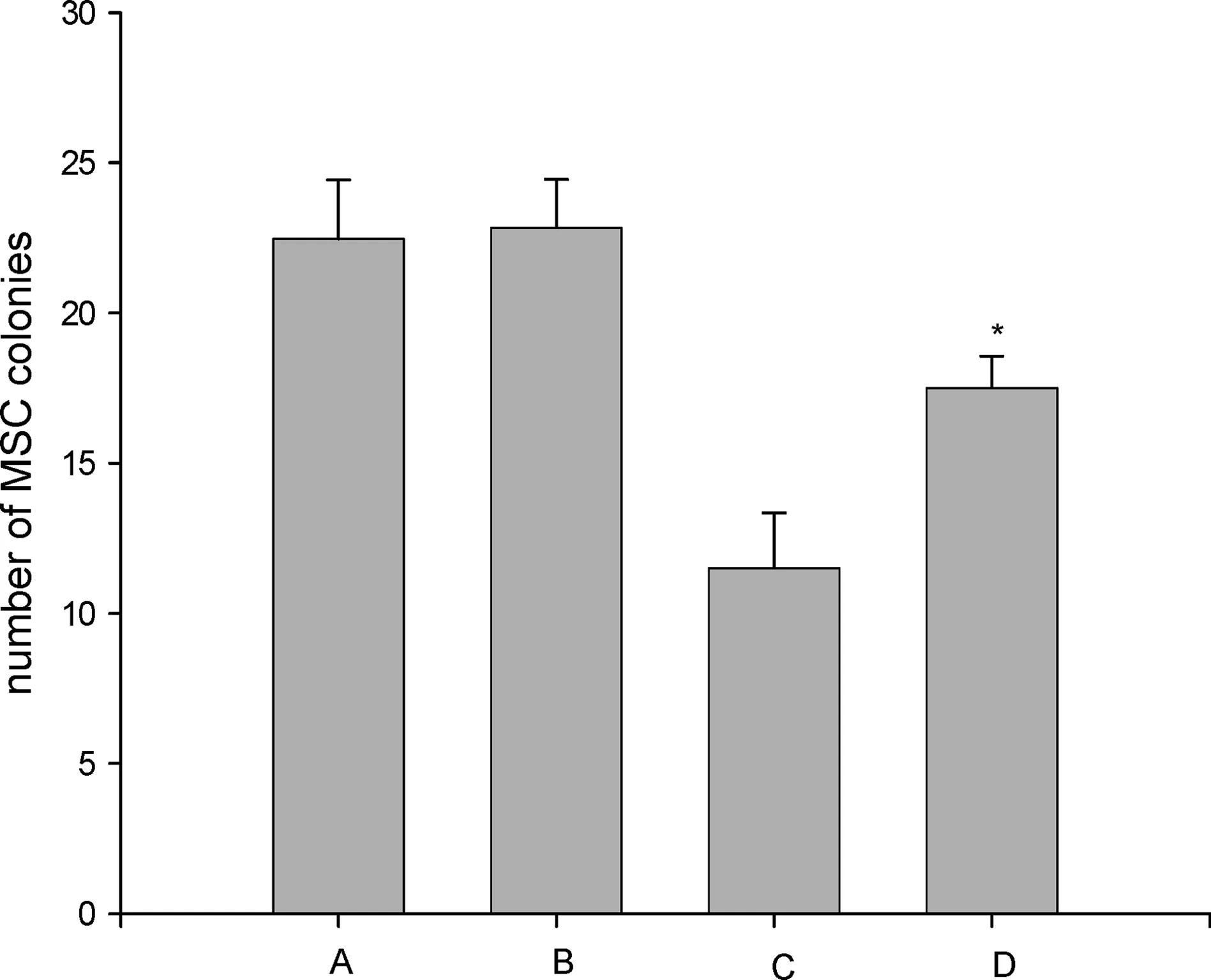
A为不换液不加AcSDKP组;B为换液不加AcSDKP组;C为换液加AcSDKP组;D为换液撤除AcSDKP组.图3 培养体系中撤除AcSDKP后MSC生长的恢复
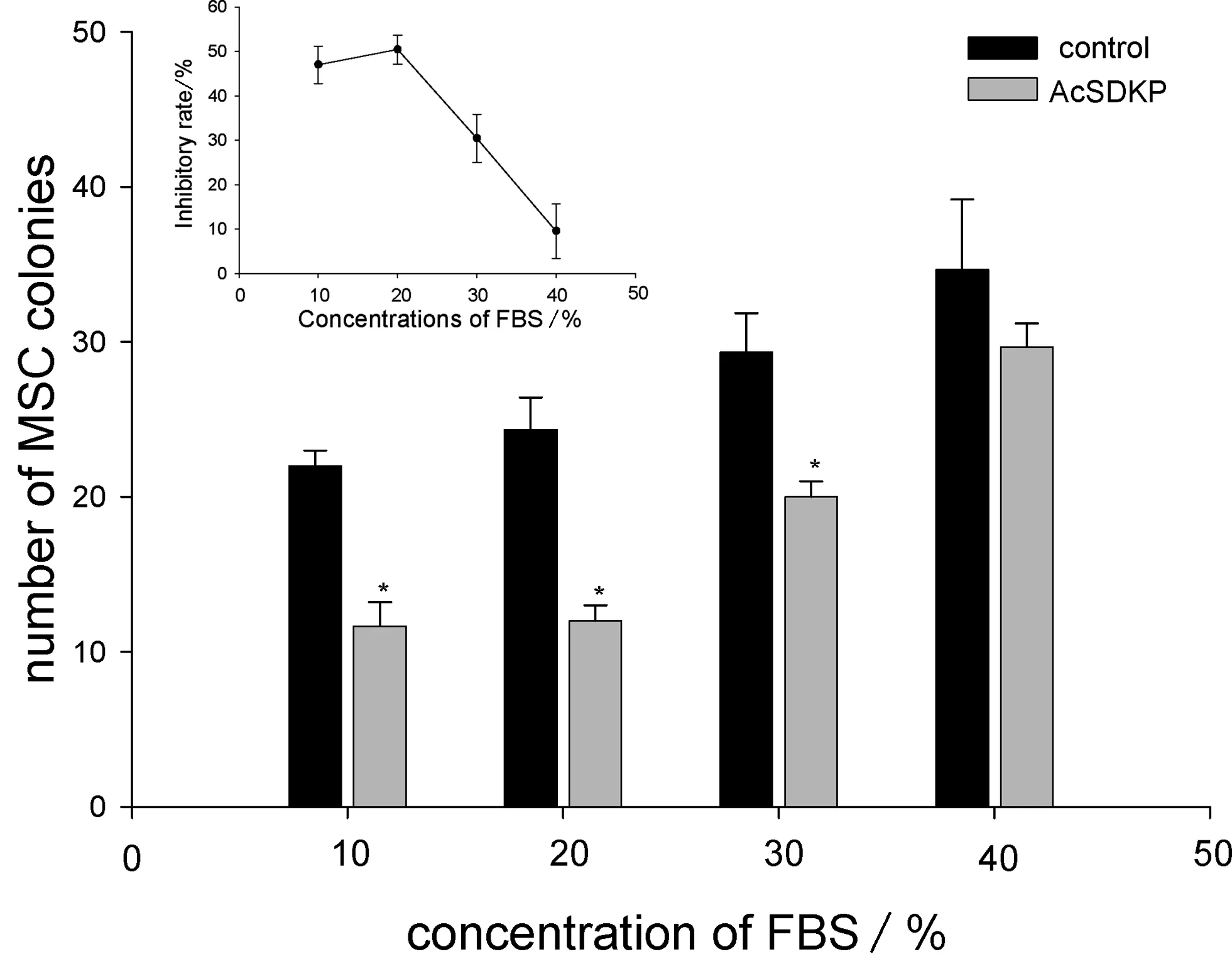
**P<0.01 and *P<0.05, compared with control. Data were from three separate experiments图4 不同血清浓度下AcSDKP对人骨髓MSC生长的影响
2.6 AcSDKP对人骨髓MSC贴壁的影响
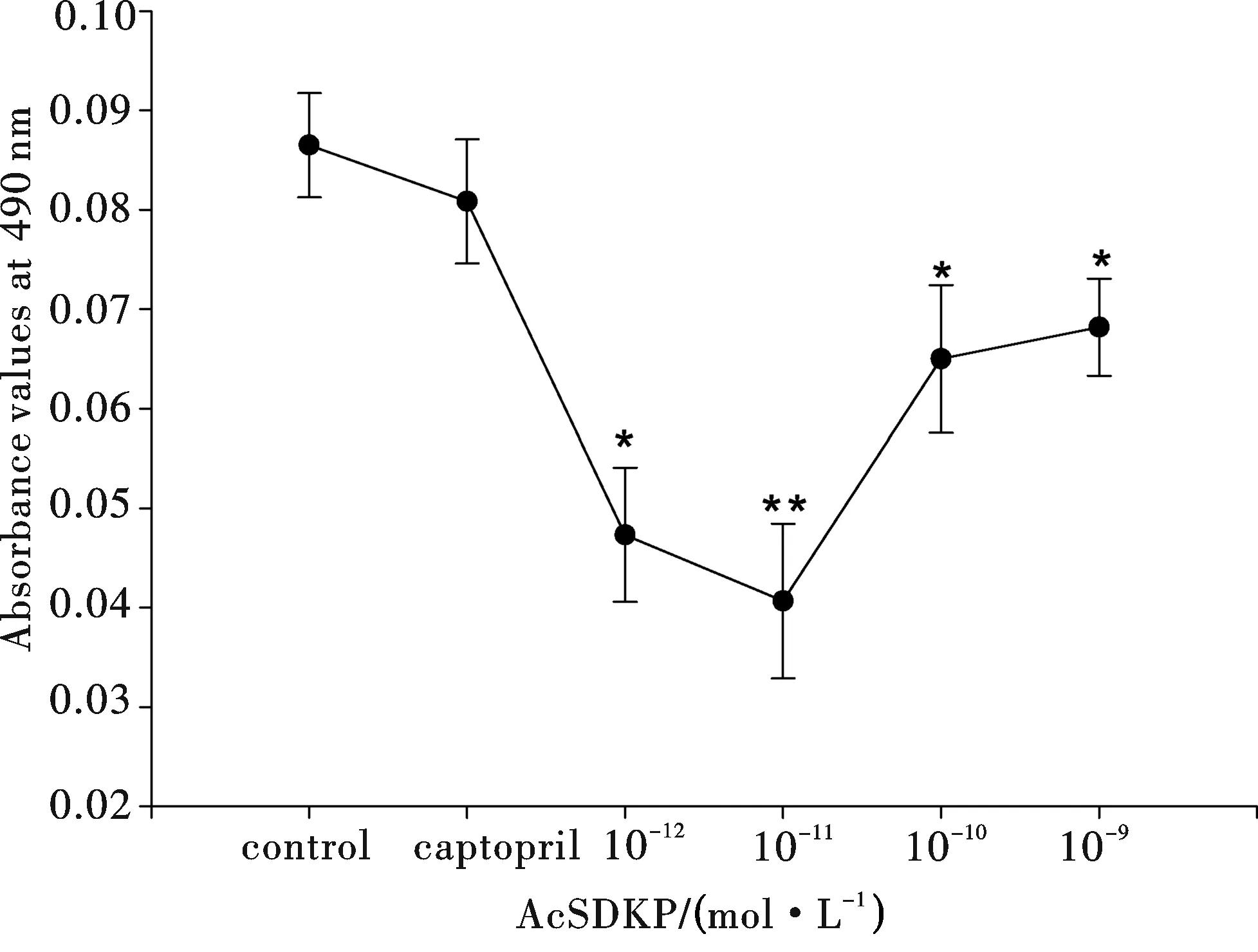
**P<0.01 and *P<0.05, compared with control. Data were from three separate experiments图5 AcSDKP作用下人骨髓MSC传代培养24 h后的MTT试验吸光值
结果如图5所示,在传代培养的第3代人骨髓MSC培养体系中加入浓度为10-12~10-9mol/L的AcSDKP,24 h后做MTT检测,AcSDKP各浓度组的吸光值(A值)均明显低于对照组(P<0.01 或P<0.05),10-11mol/L浓度组的A值最低.
3 讨论
干细胞的增殖受多种调控因素的影响,其中细胞因子的作用尤为重要.AcSDKP对造血干/祖细胞的增殖具有负调控作用[9-10];但对白血病细胞及HL-60细胞的增殖无明显抑制作用[11].人们希望将AcSDKP用作抗癌治疗的干细胞保护剂.我室最近的工作发现,浓度为10-12~10-9mol/L的AcSDKP能抑制小鼠和人骨髓间充质干细胞的增殖,最大效应浓度为10-11mol/L[7].但AcSDKP抑制细胞增殖的作用机制目前尚不十分清楚,在本研究中,从细胞周期、细胞贴壁等方面进行了初步探讨.
BrdU掺入法是一种常用的细胞周期分析方法.传代培养第3代的人骨髓MSC的BrdU掺入试验结果显示,AcSDKP为10-11~10-9mol/L 范围内的各浓度组的S期细胞,与对照组比较显著减少.这说明了该浓度范围内的AcSDKP可以通过阻止人MSC进入S期.FCM检测了不同浓度AcSDKP培养条件下人骨髓MSC各时相细胞的百分率,结果显示AcSDKP添加组的S+G2/M期细胞的比率降低,G0/G1期细胞明显增加,进一步表明AcSDKP能通过阻止人MSC进入S期,使其停留在G0/G1期,且最大效应浓度为10-11mol/L,与前期实验结果一致[7].这些结果与Jackson等[3,12]的报道AcSDKP对其他细胞的抑制作用相近.另外,由于AcSDKP是血管紧张素I转换酶(ACE)的一种生理底物,在该酶的作用下,AcSDKP降解失活.卡托普利是ACE抑制剂,预实验表明卡托普利对人骨髓MSC的生长无明显影响.考虑到培养体系中血清成分含有ACE,贴壁细胞也能表达ACE,因此,在培养体系中加入AcSDKP的同时,也加入卡托普利,以维持AcSDKP在体系中的浓度.
Bonnet等[12]还报道,在人骨髓长期培养中加入AcSDKP,非黏附贴壁层的造血祖细胞减少,停止加入AcSDKP后两周,祖细胞数恢复到对照组水平.在本研究中作者也观察到,AcSDKP在人骨髓MSC集落培养体系中作用一段时间后,通过换液撤除,MSC集落生成能够在一定程度上得到恢复,说明AcSDKP对MSC的增殖抑制作用也是可逆的,其作用停止后,细胞恢复生长,提示停滞在G0/G1期细胞重新进入了S期.
Robinson 等[13]在AcSDKP与细胞生长刺激因子共用于培养的实验结果提示,AcSDKP不是直接对造血干/祖细胞起作用而影响它们在S期的数量和比例,而是阻断细胞增殖刺激因子的作用,阻止静止状态的细胞进入细胞周期.在本研究中,MSC增殖所需要的生长因子主要由FBS提供,作者在不同的FBS浓度的培养体系中加入了该因子,观察MSC集落的变化.结果表明,FBS为10%、20%、30%的培养条件下,AcSDKP抑制MSC集落的生成,集落生成数显著减少,但抑制率随FBS的浓度升高而降低;而FBS浓度为40%时,AcSDKP对MSC集落生成无明显影响.这些结果提示,AcSDKP阻遏细胞生长刺激因子的作用,可能是其抑制MSC集落生成的机制之一.另外,AcSDKP还可能通过对抗促贴壁因子的作用,而抑制MSC的增殖.MSC的生存和生长具有停泊依赖性,作者前期实验发现MSC在一般情况下培养24 h会有90%以上的细胞贴壁.本实验中,作者在培养MSC 24 h后,去除未贴壁细胞,用MTT检测其贴壁的活力细胞数,发现添加AcSDKP组的贴壁细胞数明显少于对照组,提示AcSDKP影响了MSC的贴壁,但这种作用是因为抑制了胶原等ECM(细胞外基质)分子及CAM(细胞黏附分子)的合成,还是对抗了血清中促贴壁因子的作用,都有待进一步的研究证实.
参考文献:
[1] FRINDEL E,GUIGON M. Inhibition of CFU entry into cycle by a bone marrow extract[J]. Exp Hematol,1977, 5(1): 74-76.
[2] ROBINSON S, LENFANT M, WDZIECZAK-BAKALA J,etal. The molecular specificity of action of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (AcSDKP) in the control of hematopoietic stem cell proliferation[J]. Stem Cells, 1993, 11(5): 422-427.
[3] JACKSON J D, OZEROL E, YAN Y,etal. Activity of acetyl-Ser-Asp-Lys-Pro (AcSDKP) on human hematopoietic progenitor cells in short-term and long-term bone marrow cultures[J]. J Hematother Stem Cell Res, 2000, 9(4): 489-496.
[4] IWAMOTO N, XANO H J, YOSHIOKA T,etal. Acetyl-seryl-aspartyl-lysyl-proline is a novel natural cell cycle regulator of renal cells[J]. Life Sci, 2000, 66(15): 221-226.
[5] CHEN Y W, LIU B W, ZHANG Y J,etal. Preservation of basal AcSDKP attenuates carbon tetrachloride-induced fibrosis in the rat liver[J]. J Hepatol, 2010,53(3):528-536.
[6] CASTOLDI G, DI GIOIA C R, BOMBARDI C,etal. Prevention of myocardial fibrosis by N-acetyl-seryl-aspartyl-lysyl-proline in diabetic rats[J]. Clin Sci (Lond), 2009, 118(3):211-220.
[7] 戴 国,黄 畅,李 烨,等. AcSDKP抑制体外培养条件下人骨髓间充质干细胞的增殖[J]. 生理学报,2006,58(2):110-115.
[8] NAKAMURA S, TAKEDA Y, KANNO M,etal. Application of bromodeoxyuridine (BrdU) and anti-BrdU monoclonal antibody for the in vivo analysis of proliferative characteristics of human leukemia cells in bone marrows[J]. Oncology, 1991,48(4): 285-289.
[9] PITTENGER M F, MACKAY A M, BECK S C,etal. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5 411): 143-147.
[10] JOSHI C, ENVER T. Molecular complexities of stem cells[J]. Curr Opin Hematol, 2003, 10 (3): 220-228.
[11] CASHMAN J D, EAVES A C, EAVES C J. The tetrapeptide AcSDKP specifically blocks the cycling of primitive normal but not leukemic progenitors in long-term culture: evidence for an indirect mechanism[J]. Blood, 1994, 84(5): 1 534-1 542.
[12] BONNET D, LEMOINE F M, PONTVERT-DELUCQ S,etal. Direct and reversible inhibitory effect of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (Seraspenide) on the growth of human CD34+ subpopulations in response to growth factors[J]. Blood, 1993, 82(11): 3 307-3 314.
[13] ROBINSON S, LENFANT M, WDZIECZAK-BAKALA J,etal. The mechanism of action of the tetrapeptide acetyl-N-Ser-Asp-Lys-Pro (AcSDKP) in the control of haematopoietic stem cell proliferation[J]. Cell Prolif, 1992,25(6): 623-632.

