硅胶管气样原位采集技术研究土壤N2O浓度及通量变化
陆 星,巨晓棠*,张福锁,Volker Römheld
(1中国农业大学资源与环境学院植物营养系,农业部植物营养学重点实验室,北京100193;2霍恩海姆大学植物营养所(330),斯图加特,德国 70593)
土壤微生物通过硝化作用、反硝化作用以及硝化菌的反硝化作用产生N2O[1]。N2O气体经对流扩散直接释放到大气中,或者溶解滞留在土壤溶液及土壤空隙中,或者被微生物进一步还原成氮气,或者随着下渗径流进入地下水层[2]。
箱法(Chamber)技术发展历史悠久,简便易行,是国内外通用的监测土壤N2O排放通量的采样方法[3-5]。通过采样箱收集并测量的N2O通量实质是综合了N2O在土壤中各种过程后的表观净通量,无法提供N2O在土壤中的周转信息。另外,箱法采样本身受到雨雪天气的限制,无法进行全天候连续监测。分析N2O的同位素异构体组成(Analysis of N2O isotopomers)为区分土壤中N2O的来源并研究其土壤过程开辟了新窗口[6-13]。为了使同位素分析结果精确可靠,收集气样中N2O的浓度和体积必须达到1000 nL/L和100 mL以上[10]。通常可通过延长采样箱的关闭时间来增加气样N2O浓度,但此方法有两个弊端:一是收集的N2O气样是土壤生成的N2O和大气背景N2O的混合气样;二是关箱时间长短取决于当时的土壤N2O排放强度大小,无法统一操作,费时且容易造成系统误差。
除了箱法,国内外研究者[14-16]还通过埋入气体采集管(Gas probe)直接采集土壤产生的N2O气体、研究N2O的产生位置、周转动态并计算N2O排放通量。这类采集管通过前端的开口结构连接土壤基质和采样管道,因其有一定体积,土壤空气和采集管开口空间能进行气体交换,平衡之后即可抽气采样。由于土壤孔隙比箱体空间更易累积N2O,此方法采集的气样N2O浓度一般能满足同位素分析要求。但是这类气体采集管受自身开口结构的限制,无法在土壤淹水状态下采样;采样体积取决于开口空间大小,无法大量采样;此外还会因开口空隙被土壤颗粒堵塞而失效。
硅胶管特有的孔隙结构使它具有透气不透水的特性。利用这一特性,国外研究者直接把硅胶管做成土壤气体采集管,并研究了管壁、浓度、温度等因素对气体扩散平衡时间的影响[17-18]。但是硅胶管能否用于采集高浓度的土壤N2O以满足同位素分析的需要;硅胶管田间动态监测土壤N2O浓度的实际效果如何以及基于硅胶管的浓度梯度法和箱法测定的土壤N2O排放通量相关性等问题尚未解决。据此,本研究拟通过室内模拟试验和田间试验,以期回答上述问题。
1 材料与方法
1.1 硅胶管对N2O的通透性
本试验拟通过室内模拟,测试应用硅胶管采集土壤N2O的理论可行性,并获取相应的参数用于指导田间的气体采样频率。试验装置由一个带橡皮塞的广口瓶(容积2 L,模拟土壤孔隙)和硅胶管组成(图1)。硅胶管管壁3 mm,内径12 mm,长1.5 m,盘旋装入广口瓶中,其两端通过用硅胶塞密封,靠近瓶塞的一端连入Teflon小管,小管另一端穿过橡皮塞并和三通阀相连接。橡皮塞上另插着一根Teflon小管,小管的一头也连有三通阀。所有连接均用玻璃硅胶密封以保证装置的气密性。通过控制橡皮塞上的两个三通阀门,实现硅胶管内空间和瓶外空间,以及广口瓶内空间和瓶外空间的连通。硅胶管内和广口瓶内的气体交换只能通过硅胶管壁扩散实现。

图1 N2O气体通透性试验装置图Fig.1 Equipment design for N2O diffusion experiment
试验具体操作如下:先打开两个三通,使大气和广口瓶以及硅胶管内空间相通。5 min后,关闭与硅胶管相连的三通。通过带三通阀的医用注射器从广口瓶中抽出50 mL空气,然后再注回标定浓度为71.5 μ L/L的 50 mL N2O气体,以保持内外气压平衡。以此为0时刻,分别于 0、3.5、8、15、30、60、100、150、203 min后,用注射器通过三通吸取广口瓶以及硅胶管中的气体约3 mL,并立刻用气相色谱进行N2O浓度分析。此试验设3次重复。
通过计算硅胶管内外空气中N2O浓度的相对百分差异变化反映硅胶管内外N2O气体的扩散平衡过程。计算公式为:
相对浓度差异%=(硅胶管内N2O浓度-广口瓶内N2O浓度)/广口瓶内N2O浓度×100。
1.2 硅胶气体采集管的结构
参照国外的设计[18],改进了两种硅胶气体采集管:适合采集较深土层气样的垂直采集管(图2左)和适合浅层土壤采样的平行采集管(图2右)。两种采集管结构原理类似,都是由缠绕并固定成多个圈形的硅胶管,以及连接硅胶管和三通阀的Teflon小管组成。垂直采集管的圈形沿垂直方向缠绕固定,而平行采集管沿水平方向由内向外缠绕固定。采集管所用硅胶管壁厚 3 mm,内径12 mm,长2.0 m,内部集气体积达226 mL,完全能满足同位素采样的体积要求。正式试验前2周,按照试验目的,提前把硅胶采集管埋入指定土层中,并按照原有的次序覆土压实,Teflon小管以及三通露于地表,关闭三通,以便采气。本研究中,垂直采集管埋入较深的10—20 cm土层中,目的在于收集反硝化生成的N2O;而平行采集管埋入较浅的5 cm土层处,目的在于收集硝化作用生成的N2O。

图2 垂直硅胶管采集管(左)和平行硅胶管采集管(右)Fig.2 Overview of the vertical silicone tube probe(left)and the horizontal silicone tube probe(right)
1.3 田间试验设计
试验地位于中国农业大学东北旺试验站。该站属华北平原北部山前冲积平原,土壤为该地区典型的石灰性粉砂壤质潮土。试验选择在N2O排放强烈的夏玉米季进行[3]。所选田块经5年不施肥的冬小麦/夏玉米轮作,达到匀地并耗竭土壤中无机氮的效果。试验前移走上季全部植物残茬,以避免土壤本身无机氮以及有机质矿化作用对试验造成的影响。试验设施铵态氮肥(NH+4)、硝态氮肥(NO-3)及硝态氮肥加葡萄糖(NO-3+C)3个处理。氮肥施用量均为N 250 kg/hm2,按100和150 kg分2次追肥撒施入土壤,同时均匀灌水15 mm或者100 mm(NO-3+C处理)。氮肥品种分别为铵态氮肥为(NH4)2SO4,硝态氮肥为Ca(NO3)2。每个处理设4次重复,小区面积为3.7 m ×2.0 m,小区区组随机排列,采样箱和硅胶采集管安置于玉米行间。对于铵态氮肥处理,埋入浅层(5 cm)平行采集管;剩下的2个硝态氮处理,埋入深层(10—20 cm)垂直采集管。每个小区埋入2个硅胶管采集管,采气时把2个采集管中的气样混匀成一个气样代表整个小区。
1.4 密闭箱法测量N2O通量
采用密闭暗箱法采集田间气样。暗箱用PVC管制成,内径19.2 cm、高15.0 cm、容积3990 cm3。箱体顶端一侧连1.5 m的平衡管,用以在采气过程中保持箱子内外大气压力的相对平衡。箱顶装有三通用于取气样。试验前一周把采样箱底座打入土壤固定,以避免土壤扰动对N2O的影响。采样频率为:每次施肥灌水之后的3 d内,1 d采1次样,接下来的4 d每2 d采1次样,之后6 d每3 d采1次样,之后每7 d采1次样。采样前1 min盖上箱体,以此为t0时刻,在0~20 min内,用60 mL一次性医用注射器连续采集3针20 mL的气样,采气间隔10 min,用于分析计算N2O排放通量。同时记录每个小区采样始末的箱外温度。气样12 h内上气相色谱(型号Varian 3600,Varian Instruments,Walnut Creek,CA)分析N2O浓度。
N2O通量计算公式为:
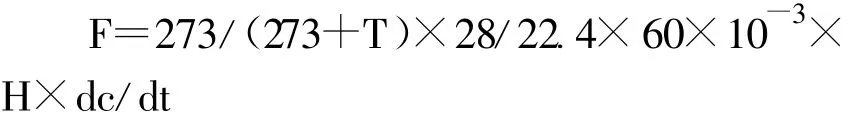
式中:F 为N2O 排放通量[N2O-N μ g/(m2·h)];T为箱内温度,28为每mol N2O分子中N的质量数,22.4为温度为273K时的N2O摩尔体积(L/mol);H为采样箱高度(cm);c为N2O气体浓度(nL/L);t为关箱时间(min);dc/dt为采样箱内N2O气体浓度的时间变化率[nL/(L·min)]。
1.5 硅胶采集管采集土壤N2O
硅胶管采气和静态箱法采气同步进行。采气时,打开采集管上的三通阀,用容积为60 mL的一次性医用注射器分别从每个小区埋入的两个硅胶管中各抽取60 mL气样,一并注入已抽成真空的容积为115 mL的气样瓶中混匀保存待用。气样中N2O浓度用GC-ECD测定。
1.6 浓度梯度法计算N2O排放通量
土壤表面的N2O排放通量通过浓度梯度法计算[19]。依据原理Fick第一定律(Fick’s first law),计算公式如下:

其中:q为气体排放通量[ng/(cm2·s)];Ds为气体在土壤中的扩散常数(cm2/s);C为气体浓度(ng/cm3);Z为气体扩散深度,即采集管埋藏深度(cm);Δ C/ Δ Z 为气体浓度梯度[ng/(m3·m)]。为了与箱法测定的通量F保持单位一致,计算结果乘以单位转化系数 a[μ g·cm2·s/(ng·m2·h)],其数值为22909,公式变为:

气体在土壤中的扩散常数Ds又可以通过如下公式求得:

这里D0是气体在自由空气中的扩散系数(cm2/s),对于N2O气体为0.14 cm2/s[20],EA和Eτ分别是土壤通气孔隙度(cm3/cm3)和土壤总孔隙度(cm3/cm3)。
Eτ=1-BD/2.65,BD为土壤容重(g/cm3);
EA=Eτ-WC,WC为土壤的体积含水量(mL/cm3)。
每次采集气样的同时,用土钻随机取小区0—20 cm土层土样,烘箱105℃烘干法测定其重量含水量,再乘以土壤容重换算成土壤体积含水量。计算时所需的其他土壤物理性质如表1。
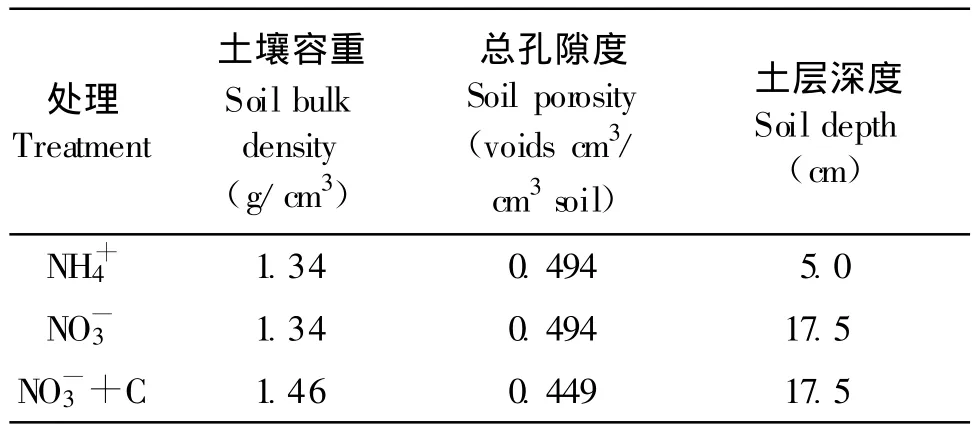
表1 试验地土壤物理性质Table 1 Physical properties of the investigated soil
2 结果与讨论
2.1 硅胶管对N2O的通透性
图3看出,广口瓶中高浓度N2O气体迅速通过硅胶管壁扩散到硅胶管内并达到动态平衡:60min内,广口瓶内的N2O浓度从初始的约2000 nL/L下降到约1800 nL/L;同时,硅胶管内的N2O浓度从初始的200 nL/L迅速增加到900 nL/L,达到前者的一半。此后硅胶管内的N2O浓度继续上升,但增加速率降低;而广口瓶内N2O浓度保持恒定。

图3 硅胶管内N2O和管外广口瓶中N2O随时间的扩散平衡Fig.3 Chronological equilibration of N2O between the inner silicone tube and the surrounding jar space
用SigmaPlot软件(版本10.0)尝试不同的方法回归拟合相对浓度差异随时间的变化,发现结果最符合指数衰减方程Dt=-36.0+129.1exp(-0.0067t),R2=1.00。经计算,约2.9 h之后,硅胶管内外的N2O浓度达到95%的平衡。
对比国外类似研究,Jachine和Dick[17]用2.4 mm厚的硅胶管,N2O扩散达到95%的平衡时间是4.4 h;Kammann等[18]用壁厚3.0 mm的硅胶管,达到同样程度的平衡状态,仅需1.5 h。本试验表明,硅胶管对N2O具有良好的通透性,较短的平衡时间(2.9 h达到95%的平衡)使该硅胶管用于田间采集土壤N2O完全可行。考虑到N2O扩散通过硅胶管壁的速度不仅取决于硅胶管壁厚,还与温度、硅胶管内外N2O浓度梯度,甚至生产厂家有关。故建议用此硅胶管法田间采集土壤N2O的时间间隔不低于3 h。
2.2 土壤高浓度N2O气样采集和N2O浓度的时间变化规律
用硅胶采集管原位收集土壤生成的N2O气体,操作简便,大多气样浓度都能达到同位素分析要求。NH4+、NO3-和NO3-+C处理小区N2O浓度超过1000 nL/L的气样比率分别达到43%、43%和90%,施肥灌水后3 d内的气样浓度全部能达到分析要求。若换用箱法采集气样,在空气背景N2O浓度为330 nL/L、箱高15 cm、关箱时间 20 min的前提下,达到此浓度要求土壤N2O排放通量达到N2O-N 337 μ g/(m2·h);而 NH4+、NO3-和 NO3-+C 处理中达到此通量强度的比率仅分别为14%、4.5%和44%,显著低于硅胶管采气的达标率。若把关箱时间增至40 min,则 3个处理相应的达标比率仅略增加到23%、4.5%和47%。但是,随着关箱时间的增长,箱体中和土壤孔隙之间的N2O浓度梯度减少,箱内N2O将逐渐达到饱和甚至被土壤重新吸收或还原[2],因此箱中实际N2O浓度将低于理论计算值。由此可见土壤N2O排放通量较低时通过延长关箱时间获取高浓度N2O气样并不可行。土壤孔隙和土壤溶液中常常超饱和累积N2O,在土壤强烈产生N2O,而其运输又受到限制的条件下,其最高浓度能分别比周围空气和大气中的N2O浓度高30000倍和25000倍[21]。本研究中,硅胶管采集器直接埋入指定土层,土壤孔隙和土壤溶液中累积的N2O通过扩散作用快速进入硅胶管内,所以相比箱法更容易采集到高浓度的N2O气样。
试验小区土壤N2O浓度受到施肥、灌水以及降水的影响,表现出明显的时间变化(图4)。玉米三叶期(7月10日)第1次施肥灌水前,大气空气中N2O的背景浓度为322 nL/L。NH4+、NO3-以及NO3-+C处理小区土壤空气中平均N2O浓度分别为573、647和1334 nL/L,均极显著高于大气背景浓度(配对t检验,P<0.01)。而NO3-+C处理的N2O浓度显著高于其他两个处理(配对t检验,P<0.05),NH4+和NO3-处理之间没有显著差异。说明施肥灌水之前,土壤中的微生物已经开始活跃,生成的N2O气体累积在土壤孔隙中。因土壤空气和地表大气中的N2O浓度存在浓度梯度(通常为正梯度),使得土壤孔隙N2O气体能够通过扩散作用顺浓度梯度扩散到大气中,从而形成地表净排放通量。NO3-+C处理小区的土壤经过压实处理,容重由1.34增加到1.46 g/cm3(表1),而土壤总孔隙度则由0.494减少到0.449,这一方面有利于反硝化菌等嫌气微生物还原土壤中的硝酸盐产生N2O,另一方面阻滞了N2O的扩散,使得更多的N2O累积在土壤孔隙中[2]。

图4 土壤空气中N2O浓度的时间变化Fig.4 Temporal variation of soil gas N2O concentration at depths of 5 cm(NH+4treatment)or 15-20 cm(NO-3and+C treatment)in soil
第1次施肥灌水后,3个处理的N2O浓度均显著增加,3 d后达到最高峰,其中NH+4和NO-3处理最高浓度分别为1323和1434 nL/L,对比施肥前分别增加了1.3和1.2倍,两者无显著性差异。而此时NO-3+C处理小区土壤中的N2O浓度迅速增加到10619783 nL/L,同比施肥前增加了7962倍;1周以后,各个处理小区中的N2O浓度都回落到施肥前水平。说明施肥和灌水显著刺激了土壤微生物的活动,产生大量N2O,这与大多数研究[3-4,15]的结果相吻合。
玉米十叶期(8月9日)第2次施肥灌水后,各处理N2O产生规律和第1次类似,但是由于这次施肥量由N 100增加到150 kg/hm2,小区土壤N2O浓度也相应增大;NH4+、NO3-以及NO3-+C处理小区土壤N2O的浓度峰值分别为 16733、14637和9619619 nL/L。此外,受降水影响,此阶段土壤含水量相对第1次施肥后要高。高含水量一方面有利于微生物产生N2O,另一方面阻滞了N2O通过土壤非含水孔隙向四周扩散,这是此阶段N2O浓度更高的另一个可能原因[2,19]。
对于NO3-+C处理,每次氮肥是分两段施入,所以小区土壤中对应有四个N2O浓度高峰。受降雨影响,7月19日NH4+和NO3-处理小区土壤中均检测到一个N2O浓度高峰,其平均浓度值分别为11722和7018 nL/L。
2.3 土壤浓度梯度法和箱法N2O排放通量的比较
3个试验处理中,硅胶采集管测定的土壤N2O浓度随时间变化趋势(图5上)和传统箱法测定的N2O排放通量(以下简称箱法通量)变化趋势(图5下)相吻合,这说明土壤产生的N2O能迅速扩散到硅胶管中并达到动态平衡。在不同的N2O产生强度下(3个处理,以及各个处理的不同时期),硅胶管采样方法均响应灵敏、准确可靠。在此基础上,用浓度梯度法计算的N2O净通量(以下简称浓度梯度通量)和箱法通量之时间变化趋势一致,但是浓度梯度通量极显著低于箱法通量(配对 t检验:|t|=4.05,P<0.001,n=293)。
回归分析结果表明,浓度梯度通量与箱法通量呈显著正相关(图6),但是都显著低于后者测量值。其中NH+4处理小区的浓度通量与箱法通量的数值最接近,其数值大约为后者的80%;而NO-3和NO-3+C处理小区的N2O浓度梯度通量值较低,分别仅相当与箱法通量的30%和17%。对数化处理后的NO-3+C小区,其浓度梯度通量值和箱法通量值相当接近,两者拟合的关系式为lgy=0.97lgx-0.67,R2=0.87。

图5 浓度梯度法(上图)和箱法(下图)测定的全采样期N2O排放通量比较Fig.5 Comparison of N2O fluxes between the gradient method(upper)and the chamber method(down)during the whole sampling period
气体采集管取样位置和N2O产生位置的匹配程度直接影响浓度梯度法和箱法分别测量的N2O排放通量值的匹配程度。气体采集管主要采集其埋藏位置附近土层产生的N2O,如果位于其上方的土壤是产生N2O的活跃区域,则浓度梯度通量就会有负偏差[22]。Yoh等[15]研究了施肥土壤N2O排放通量和N2O在不同土层的生成速率,发现浓度梯度法(10 cm)测定的N2O通量值和箱法测定值显著相关。但是前者数值大约为后者的一半,而表土层(10 cm)产生的N2O显著高于25 cm和40 cm土层的N2O产生速率。Maljanen等[16]同时用箱法和浓度梯度法测量有机土壤的N2O排放,发现在湿润年份,浓度梯度通量值要小于箱法通量值,但用浅层土壤(5 cm)N2O浓度计算的通量值比用深层土壤(20 cm)N2O浓度计算的通量值更接近箱法通量值;在较干旱年份则箱法通量小于浓度通量。作者把差异的原因归结为不同土壤湿度条件下N2O产生的位置不同,湿润年份N2O主要产生在表层,而干旱年份则主要产生在较深土层。本研究中,NH+4处理小区N2O主要产生于表层土壤的硝化作用,硅胶管埋在5 cm土层处,更接近N2O的主要产生位置,所以浓度梯度通量值较NO-3和NO-3+C处理(硅胶管埋于15—20 cm土层)更接近对应的箱法通量值;葡萄糖的添加为微生物反硝化提供了碳源,有利于土壤表层形成厌氧孔隙,其结果是NO-3+C处理小区表层土壤亦能进行强烈反硝化产生大量N2O。而NO-3处理小区的N2O生成位置则更靠近15—20 cm的采样管,推测这是NO-3处理小区浓度梯度法测定的N2O通量较NO-3+C处理小区更接近对应的箱法通量的可能原因。

图6 浓度梯度法与箱法测定的N2O排放通量的相关性Fig.6 Correlations of N2O fluxes between the chamber method and the gradient method within each treatment and all treatments
3 结论
硅胶管法简便易行,能同时用于原位采集高浓的土壤N2O气体、长期监测不同土壤剖面N2O浓度变化,计算土壤N2O排放通量。基于硅胶管采样法计算的N2O通量值与传统箱法通量值相关性好,但是测量值偏低,偏低的程度取决于采样位置和土壤中N2O产生位置的匹配程度。建议采用埋于土壤表层的硅胶管计算地面N2O排放通量,或在不同土层埋入硅胶管研究土壤剖面N2O行为的时空变异。
[1]Bremmer J M.Sources of nitrous oxides in soils[J].Nutr.Cycl.A-groecosys.,1997,49:7-16.
[2]Clough T J,Sherlock R R,Roslston D E.A review of the movement and fate of N2O in the subsoil[J].Nutr.Cycl.Agroecosys.,2005,72:3-11.
[3]高志岭,陈新平,张福锁,等.农田土壤N2O排放的连续自动测定方法[J].植物营养与肥料学报,2005,11(1):64-70.Gao Z L,Chen X P,Zhang F S et al.Continuous-automatic method formeasuring N2O emission from agricultural soil[J].Plant Nutr.Fert.Sci.,2005,11(1):64-70.
[4]王秀斌,梁国庆,周卫,等.优化施肥下华北冬小麦/夏玉米轮作体系农田反硝化损失与N2O排放特征[J].植物营养与肥料学报,2009,15(1):48-54.Wang X B,Liang G Q,Zhou W et al.Effect of optimized nitrogen application on denitrification losses and N2O emissions from soil in winter wheat/summer corn rotation system in North China[J].Plant Nutr.Fert.Sci.,2009,15(1):48-54.
[5]Philippe R,Eriksen-Hamel N S.Chambermeasurements of soil nitrous oxide flux:are absolute values reliable?[J]Soil Sci.Soc.Am.J.,2008,72:331-342.
[6]Yoshida N,Toyoda S.Constraining the atmospheric N2O budget from intermolecular site preference in N2O isotopomers[J].Science,2000,405:330-334.
[7]Bol R,Toyoda S,Yamulki S et al.Dual isotope and isotopomer ratios of N2O emitted from a temperate grassland soil after fertilizer application[J].Rapid Commun.Mass Spec.,2003,17:2550-2556.
[8]Toyoda S,Mutobe H,Yamagishi H et al.Fractionation of N2O isotopomers during production by denitrifier[J].Soil Biol.Biochem.,2005,37:1535-1545.
[9]Sutka R L,Ostrom N E,Ostrom P H et al.Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances[J].Appl.Environ.Microbiol.,2006,72:638-644.
[10]Well R,Kurganovab I,de Gerenyub V L,Flessa H.Isotopmer signatures of soil-emitted N2O under different moisture conditions-A microcosm study with arable loess soil[J].Soil Biol.Biochem.,2006,38:2923-2933.
[11]Well R,Flessa H,Lu X et al.Isotopologue ratios of N2O emitted from microcosms with NH4+fertilized arable soils under conditions favoring nitrification[J].Soil Biol.Biochem.2008,40:2416-2426.
[12]Jinuntuya-Nortman M,Sutka R L,Ostromc P H et al.Isotopologue fractionation during microbial reduction of N2O within soil mesocosms as a function of water-filled pore space[J].Soil Biol.Biochem.,2008,40(9):2273-2280.
[13]Baggs EM.A review of stable isotope techniques for N2O source partitioning in soils:recent progress,remaining challenges and future considerations[J].RapidCommun.Mass Spec.,2008,22:1664-1672.
[14]梁东丽,同延安,Ove Emteryd,等.土土壤剖面中N2O浓度的时间和空间变异[J].生态学报,2003,23(4):731-737.Liang D L,Tong Y A,Emteryd O et al.Spatial and temporal variation of nitrous oxide concentrations in soil profiles of Manural Loessial Soil[J].Acta Ecol.Sin.,2003,23(4):731-737.
[15]Yoh M,Toda H,Kanda K I et al.Diffusion analysis of N2O cycling in a fertilized soil[J].Nutr.Cycl.Agroecosys.,1997,49:29-33.
[16]Malijanen M,Liikanen A,Silvola J et al.Measuring N2O emissions from organic soils by closed chamber or soil/snow N2O gradient methods[J].Eur.J.Soil Sci.,2003,54:625-631.
[17]Jacinthe P A,Dick W A.Use of silicone tubing to sample nitrous oxide in the soil atmosphere[J].Soil Biol.Biochem.,1996,28(6):721-726.
[18]Kammann C,Gr ü nhage L,Jäger H J.A new sampling technique to monitor concentrations of CH4,N2O and CO2in air at well-defined depths in soils with varied water potential[J].Eur.J.Soil Sci.,2001,52:297-303.
[19]Clough T J,Kelliher F M,Wang Y P et al.Diffusion of15N-labelled N2O into soil columns:A promising method to examine the fate of N2O in subsoils[J].Soil Bio.Biochem.,2006,38:1462-1468.
[20]Barr R F,Watts H.Diffusion of some organic and inorganic compounds in air[J].J.Chem.Eng.Data,1972,17:45-46.
[21]Heincke M,Kaupenjohann M.Effects of soil solution on the dynamics of N2O emissions:a review[J].Nutr.Cycl.Agroecosys.,1999,55:133-157.
[22]Kusa K,Sawamoto T,Hu R et al.Comparisonof the closed-chamber and gas concentration gradient methods for measurement of CO2and N2O fluxes in two upland field soils[J].Soil Sci.Plant Nutr.,2008,54:777-785.

