铜绿假单胞菌注射液对术后早期腹腔化疗时结肠吻合口愈合的影响
孙艳华,董 哲,高成生
(辽宁医学院 第一附属医院 普外科/大肠病区,辽宁 锦州 121001)
Sugarbaker提出的术后早期腹腔化疗理论(early postoperative intraperitoneal chemotherapy,EPIC)较传统的腹腔化疗对预防结直肠癌术后手术创面、腹膜和肝脏转移具有更重要的意义[1]。临床研究表明,EPIC可降低局部复发率,延长患者的生存期[2]。但 EPIC也有增加术后并发症的风险,其中吻合口漏、腹腔脓肿和化学性腹膜炎比较常见,这也成为其广泛临床开展的主要障碍[3]。铜绿假单胞菌注射液(PA-MSHA)是一种生物工程技术制备的新型菌类制剂[4],不但能直接诱导肿瘤细胞凋亡[5],还能有效激活人体免疫系统[6],已广泛用于多种恶性肿瘤的辅助治疗。PA-MSHA能够有效防止肿瘤术后的转移和复发[7],降低感染发生率,延长患者的生存期[8]。为研究 PA-MSHA能否促进术后早期腹腔化疗情况下结肠吻合口的愈合,我们利用SD大鼠的结肠切除吻合模型对此进行了研究。
1 材料和方法
1.1 大鼠结肠吻合模型的建立
雄性 SD大鼠 60只,体重 200~250 g,由辽宁医学院实验动物中心提供,合格证号:SYXK(辽)2009-0011。大鼠术前禁食 12 h,饮水不限。术前称体重,10%水合氯醛3mL/kg腹腔内麻醉,于剑突下1cm处取长约3cm腹正中切口,逐层切开入腹,切除1cm左结肠,5-0的无损伤线间断内翻缝合8~10针,1号丝线缝合腹膜、腹部肌肉和皮肤。术后12 h开始给予常规鼠饲料,术后24 h开始给药。
1.2 实验分组及给药方法
大鼠随机分成3组:A组,术后1~5d腹腔注射生理盐水0.8mg/(kg·d);B组,术后1~5d腹腔内注射 5-氟尿嘧啶(5-Fu)20mg/(kg·d);C组,术前第3天开始双后肢内侧皮下注射 PA-MSHA(北京万特尔生物制药有限公司)0.5mL/次,隔日一次,直至处死或实验结束,术后腹腔化疗方法同B组。各组大鼠均不使用抗生素。
1.3 检查指标及方法
1.3.1 一般情况 造模及给药过程中,密切观察并记录各组大鼠的饮食情况、活动、精神状态和腹部切口愈合情况等。
1.3.2 吻合口漏发生率 对治疗期间死亡的大鼠进行尸检,明确其死亡原因。各组大鼠分别于术后第7和14天,各取10只进行开腹探查,如腹腔内有大量渗出液,吻合口与周围组织及网膜有不同程度粘连,松解粘连,吻合口周围发现脓苔、组织坏死或明显漏口者可判定为吻合口漏,计算各组吻合口漏的总发生率。
1.3.3 淋巴细胞计数 各组大鼠分别于术后第7和14天开腹抽取下腔静脉血3mL,进行淋巴细胞计数。
1.3.4 吻合口破裂压力(ABP) 大鼠开腹后,在吻合口远近两端各3cm结扎肠袜,一端肠袜与压力换能器连接,另一端与微量输液泵连接,通过 LMS-2B型二道生理记录仪记录压力曲线。以输液泵向肠管内注入生理盐水2mL/min,观察压力曲线急骤下降前的最大压力即 ABP。
1.3.5 吻合口羟脯氨酸(HYP)含量 清除吻合口周围粘连组织,切取以吻合口处组织50~100mg,-80°C冰箱保存待检,分别按考马斯亮兰蛋白试剂盒和HYP试剂盒说明操作。
1.3.6 病理组织学观察 取吻合口处组织,10%中性甲醛液内固定,常规石蜡包埋、切片层厚 5μm,行苏木精-伊红染色和免疫组织化学染色后进行显微镜下观察,免疫组织化学染色并做图像分析,结果取像素和面积平均后的乘积。
1.4 统计学处理
2 结 果
2.1 一般情况
各组大鼠在术后6h基本恢复活动力,12 h恢复饮食。术后2~7d,B组较其他两组活动力下降,表现为倦怠,饮食减少,对刺激反应迟钝,术后8d基本恢复。各组大鼠均无腹壁切口感染发生。
2.2 吻合口漏发生率
术后各组大鼠腹腔均有不同程度的粘连,以B组最为明显。A组和C组均无吻合口漏发生,B组共发生 6例吻合口漏,其中术后第4天2例、第5天3例、第7天1例,大鼠均死亡。解剖发现大鼠均发生腹腔感染积液甚至腹腔脓肿。B组吻合口漏发生率为30%,显著高于A组和C组的0(P<0.01)。
2.3 外周血淋巴细胞计数、ABP和HYP测定结果
结果见表1。术后第7天,B组外周血淋巴细胞计数显著低于A组(P<0.05)和C组(P<0.01)。术后第14天,C组外周血淋巴细胞计数显著高于另外两组(P<0.01)。术后第7天,B组ABP和HYP含量均明显低于A组和C组(P<0.01)。术后第14天,3组之间 ABP和HYP含量比较均无显著差异(P>0.05)。
表1 外周血淋巴细胞计数、ABP和HYP测定结果(±s)Tab.1 Determination results of in peripheral blood lymphocyte count,ABP and HYP(±s)

表1 外周血淋巴细胞计数、ABP和HYP测定结果(±s)Tab.1 Determination results of in peripheral blood lymphocyte count,ABP and HYP(±s)
与B组比较:1P<0.05,2P<0.01;与C组比较:3 P<0.01Compared with B group:1 P<0.05,2P<0.01;Compared with C group:3 P<0.01
组别 n 淋巴细胞计数/(109/L)术后7天术后14天ABP/(mmHg)术后7天术后14天HYP/(μg/mgprot)术后7天术后14天A组 10 5.11±0.651 12.09±0.833 132.19±2.551,3 135.92±0.56 3.46±0.371,3 4.06±0.21 B组 7 2.94±2.40 12.04±0.693 92.11±14.40 134.84±2.16 2.81±0.30 3.89±0.19 C组 10 6.49±1.682 18.43±2.65 129.93±5.781 135.73±0.94 3.40±0.301 4.05±0.20
2.4 病理学观察
2.4.1 吻合口细胞浸润和愈合情况 术后第7天,吻合口组织切片HE染色,观察结果显示,B组吻合口组织炎症细胞、成纤维细胞、新生血管均较少,周围黏膜坏死明显且组织疏松;而A组和C组吻合口组织炎症细胞、成纤维细胞、新生血管较多,黏膜坏死脱落相对较轻,各组织也较为致密(图1)。术后第14天,各组吻合口组织更为致密,新生黏膜上皮覆盖,渗出的炎症细胞减少,局部以成纤维细胞为主,新生血管闭合,3组吻合口均愈合良好(图2)。

图1 术后第7天吻合口组织HE染色(200×)Fig.1 HE staining of Anastomotic on the 7th day after surgery(200×)
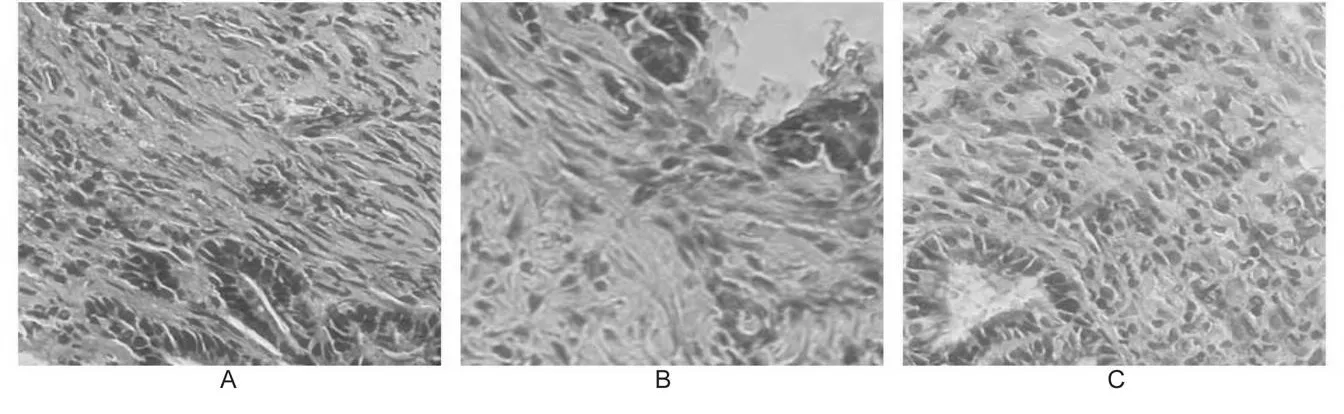
图2 术后第14天吻合口组织HE染色(200×)Fig.2 HEstaining of Anastomotic on the 14th day after surgery(200×)
2.4.2 吻合口Ⅰ型和Ⅲ型胶原表达情况 免疫组织化学染色结果显示,Ⅰ型和Ⅲ型胶原纤维呈棕黄色颗粒状或片状,显色在成纤维细胞胞浆和胶原特定的区域,且在瘢痕组织中表达更为明显。术后第7天,B组吻合口Ⅰ型和Ⅲ型胶原纤维细小且紊乱,而A和C组则粗大且规则;A和C组之间胶原的含量没有差异(P>0.05),但均显著高于B组(P<0.05)(表2)。术后第14天,3组吻合口Ⅰ型和Ⅲ型胶原纤维更加致密,但 3组之间含量已经没有显著差异(P>0.05)(表2)。
3 讨 论
PA-MSHA的有效成分是灭活的铜绿假单胞菌-甘露糖敏感血凝菌毛株,其区别于自然界铜绿假单胞菌的最显著结构特点是具有周身的甘露糖敏感血凝(MSHA)菌毛[4]。最新研究表明,PA-MSHA的MSHA菌毛能够与肿瘤细胞表面 EGFR受体上的甘露糖结合,进而阻断 EGFR受体的活化,抑制肿瘤细胞的生长并诱导其发生凋亡[5]。另一方面,PAMSHA的菌体成分,如 MSHA菌毛能够激活包括TLR4在内的模式识别受体(PRR)[9],活化多种免疫细胞,如树突状细胞、巨噬细胞、T细胞和NK细胞,帮助机体重建免疫监视和免疫防御功能[6]。
本研究选用目前公认为腹腔化疗最有效、最常用的化疗药物——5-Fu,以Sugarbaker提出的EPIC理论为依据,从术后24 h开始,连续 5 d腹腔内注射5-Fu。研究发现,B组的吻合口漏多发生在术后4~5d。既往的研究表明,在吻合术后3~4 d内,吻合口区域胶原酶被激活,胶原合成少于胶原降解导致胶原含量减少,吻合口抗张强度明显下降,这一时期最易于发生吻合口漏。由于大鼠腹腔注射 5-Fu且术后未使用抗生素,5-Fu严重阻碍新生胶原纤维的合成,同时 5-Fu抑制机体免疫导致腹腔感染的发生,也阻碍了胶原纤维合成,使结肠吻合口漏在B组发生例数最多。术后第7天,B组淋巴细胞计数、ABP、HYP较低;显微镜下炎症细胞、成纤维细胞、新生血管均较少,周围黏膜坏死明显;Ⅰ型和Ⅲ型胶原纤维面积较小且紊乱、细小。而C组由于预防性注射 PA-MSHA,拮抗 5-Fu腹腔化疗对大鼠免疫系统的直接抑制作用,激活 T细胞、巨噬细胞等多种免疫细胞,研究表明免疫细胞可分泌一系列的细胞因子,不仅能促进成纤维细胞增殖合成胶原纤维,还可以刺激血管内皮增殖,促进新生毛细血管生成,调节组织修复的全过程[10];另外 PA-MSHA通过诱导大鼠机体产生高效价的跨菌属抗体,增强机体免疫防御功能,有效地预防腹腔感染的发生,所以吻合口愈合良好。术后第14天,大鼠体内 5-Fu完全代谢,各项指标恢复与A组无明显差异,但腹腔粘连明显重于A组和C组,而腹腔粘连在慢性肠梗阻的发病机制中占有重要地位;C组只有淋巴细胞计数仍高于A组和B组,其他指标无明显差异,可见 PA-MSHA并没有导致大鼠吻合口产生过度炎症反应,形成局部纤维瘢痕,造成吻合口狭窄。这是因为组织修复过程是各种免疫细胞及分泌的多种细胞因子共同作用的结果,其中既有促进愈合的作用也有抑制愈合的作用。研究发现这些细胞因子之间存在着复杂的相互作用,如巨噬细胞除了分泌TGF-β1和TGF-β2外,也能分泌 TGF-β3,而TGF-β3可下调 TGF-β1和TGF-β2,从而起到抗瘢痕修复的作用[11]。
总之,本研究发现 PA-MSHA可以减轻术后早期腹腔化疗对吻合口愈合的不良影响,降低吻合口漏的发生率。因此,提示 PA-MSHA皮下注射作为一种结、直肠癌的辅助治疗方法,不但能在术后降低肿瘤的转移和复发,还能促进吻合口的愈合。
表2 吻合口Ⅰ、Ⅲ型胶原纤维的含量测定结果(±s)Tab.2 Determination results ofⅠ,Ⅲ collagen fiber content in anastomotic(±s)

表2 吻合口Ⅰ、Ⅲ型胶原纤维的含量测定结果(±s)Tab.2 Determination results ofⅠ,Ⅲ collagen fiber content in anastomotic(±s)
与B组比较:1P<0.05Compared with B group:1 P<0.05
C组 10 1.44±0.071 2.55±0.08 1.38±0.111 2.24±0.08
[1]Sugarbaker PH.Intraperitoneal chemotherapy for treatment and prevention and peritoneal carcinomatosis and sarcomatosis[J].Dis Colon Rectum,1994,37(2):112-115.
[2]Liberale G,Elias D,Sideris L,etal.Inguinal canal as an anatomic sanctuary site of relapse in peritoneal carcinomatosis previously treated with intraperitoneal chemotherapy[J].JSurg Oncol,2005,91(1):73-76.
[3]Yu W,Whang I,Averbach A,etal.Morbidity and mortality of early postoperative intraperitoneal chemotherapy as adjuvant therapy for gastric cancer[J].Am Surg,1998,4(11):1104-1108.
[4]牟希亚.绿脓杆菌甘露糖敏感血凝菌毛株的建立[J].微生物学报,1986,26(2):176-179.
[5]Liu Z B,Hou Y F,Dong M,etal.PA-MSHA inhibits proliferation and induces apoptosis through the up-regulation and activation of caspases in the human breast cancer cell lines[J].J Cell Biochem,2009,108(1):195-206.
[6]孙文平,付红文,刘妮,等.PA-MSHA菌毛株疫苗对三种癌症患者免疫疗效的临床观察[J].中华微生物学和免疫学杂志,2000,20(4):373-376.
[7]凌伟,刘骅,曹晖,等.铜绿假单胞菌注射液预防胃癌术后腹腔复发与转移的研究[J].中国实用外科杂志,2009,11(29):933-936.
[8]林涛,宋纯,王辉.晚期结直肠癌术中使用铜绿假单胞杆菌制剂的生存期观察[J].中国肺癌杂志,2009,12(6):639-641.
[9]Mossman K L,Mian M F,Lauzon NM,etal.Cuttingedge:FimH adhesin of type 1 fimbriae isa novel TLR4 ligand[J].JImmunol,2008,81(10):6702-6706.
[10]Gillitzer R,Goebeler M.Chemokines in cutaneous wound healing[J].JLeukoc Biol,2001,69(4):513-521.
[11]Martin P.Wound healing aiming for perfect skin regeneration[J].Science,1997,276(5309):75-81.

