疏肝活血方含药血清对大鼠骨髓源性内皮祖细胞血管新生相关基因表达的影响△
李大勇,陈文娜,谷峰,马贤德,王柏庆,袁明殿
(1.辽宁中医药大学附属医院血管外科,辽宁 沈阳 110032;2.辽宁中医药大学,辽宁 沈阳 110032)
疏肝活血方含药血清对大鼠骨髓源性内皮祖细胞血管新生相关基因表达的影响△
李大勇1*,陈文娜2,谷峰2,马贤德2,王柏庆2,袁明殿1
(1.辽宁中医药大学附属医院血管外科,辽宁 沈阳 110032;2.辽宁中医药大学,辽宁 沈阳 110032)
目的观察疏肝活血方含药血清对大鼠骨髓来源的内皮祖细胞(EPCs)血管新生相关基因VEGF、HGF和HIF-1α表达的影响。方法:从大鼠骨髓中获取单个核细胞,体外培养1周后,采用免疫荧光细胞化学和激光共聚焦显微镜鉴定,于培养体系中加入疏肝活血方及其拆方的含药血清,培养24h,Real-Time PCR方法检测EPCs中VEGF、HGF和HIF-1α的mRNA表达。结果贴壁细胞培养诱导后具有内皮细胞的形态学和免疫学特征,Real-Time PCR检测结果发现,疏肝活血方含药血清能明显提高EPCs中VEGF、HGF、HIF-1α的mRNA表达量,与对照相比差异具有显著意义(P<0.01)。结论疏肝活血方能促进EPCs中血管新生相关基因VEGF、HGF和HIF-1α的表达,是该方促血管新生的机制之一。
内皮祖细胞;疏肝活血方;血清药理学
治疗性血管新生(therapeutic angiogenesis)在缺血性疾病的治疗中具有美好的前景,是使缺血部位的侧支血流增加、微循环得以改善的主要机制。人体循环血液中存在内皮祖细胞(EPCs),在缺血的刺激下,EPCs能够被动员、迁移、黏附和分化成内皮细胞,新生血管中25%的内皮细胞由EPCs分化而来[1],EPCs对于血管新生和维持内皮功能完整具有重要作用。
临床实践发现,对于肢体缺血性疾病,疏肝法与活血法配伍应用,可使气机调畅,血脉通利,患者肢体的温度、颜色、间歇性跛行以及破溃的创面均有一定程度的改善[2],实验研究证实疏肝活血方能有效促进血管新生及EPCs数量的增加、功能的改善,减少 EPCs的凋亡[3,4]。本研究拟进一步通过EPCs培养体系观察在疏肝活血含药血清刺激下,EPCs中血管新生相关基因VEGF、HGF和 HIF-1α表达的变化。
1 材料
1.1 动物
健康清洁级雄性Wistar大鼠16只,体重(200±20)g,购自辽宁中医药大学实验动物中心,合格证号:SYXKDK)(辽)2003-0019。
1.2 药物
疏肝活血方(柴胡20g、香附20g、当归15g、赤芍15g),疏肝方(柴胡20g、香附20g),活血方(当归15g、赤芍15g),分别按体表面积比率折算出大鼠的等效用药剂量,计算出水煎剂的终浓度,中药饮片柴胡 (Radix Bupleuri,批 号 090308)、香附(Rhizoma Cyperi,批 号 090310)、 当 归 (Radix Angelica,批号090411)、赤芍(Radix Paeoniae Rubra,批号090312)均购自辽宁中医药大学附属医院,并经该院中药教研室王淑清教授鉴定。
1.3 试剂
胎牛血清(美国Hyclong公司),血管内皮生长因子(vascular endothelial growth factor,VEGF)(美国Biosource公司),碱性成纤维细胞生长因子(美国R&D公司),纤维连接蛋白(新西兰Cal Biochem公司),M199培养基(美国Gibco公司),Dil标记的乙酰化低密度脂蛋白(Dil-acLDL)和 Trizol(美国Invitrogen公司),FITC标记荆豆凝集素Ⅰ(FITCUEA-I)(美国 Sigma公司),荧光定量 PCR试剂盒(大连宝生物公司),PCR引物(北京华大基因公司合成)。
1.4 仪器
二氧化碳培养箱(美国Thermo公司),低温高速离心机(美国Biofuge公司),倒置生物显微镜、倒置荧光显微成像系统和激光扫描共聚焦显微镜(德国LEICA公司),ABIPRISM 7500荧光实时定量PCR仪(美国PE公司)。
2 方法
2.1 中药制剂
疏肝活血方、疏肝方、活血方药物各加蒸馏水5倍,浸泡30min,加热至沸腾,改小火保持微沸30min,滤过。药渣再加水3倍,同法煎煮20min,滤过。合并两次煎液,浓缩至预定容积,灭菌保存。疏肝活血方及其拆方疏肝方、活血方的终浓度分别为0.40g饮片·mL-1、0.23g饮片·mL-1、0.17g饮片·mL-1。
2.2 含药血清制备及分组
将16只大鼠按随机数字等分成4组:疏肝活血方组、疏肝方组、活血方组和生理盐水对照组。每日给予相应的中药或生理盐水3mL灌胃,连续7d,末次给药后1h,麻醉并通过下腔静脉采血,无菌分离出血清,56℃灭活30min,经0.22μm微孔滤膜过滤除菌,将每组大鼠的血清混合,-20℃保存备用。
2.3 EPCs的分离、培养及鉴定
体重200g的Wistar大鼠麻醉后,头部以下浸泡于75%乙醇中约5min,无菌条件下分离出两侧股骨,用0.1mol·L-1PBS冲洗骨髓腔,按等体积比将骨髓冲洗液缓慢加在淋巴细胞分离液的上层,1 500r·min-1,离心10min。取中间的单个核细胞层,M199培养基配成的稀释液调整细胞密度为1×108·cm-2,接种于纤维连结蛋白包被的培养瓶中,37℃、5%CO2、饱和湿度环境下培养。次日弃去上层悬浮细胞,加入培养液(含 VEGF 50ng·mL-1,bFGF 10ng·mL-1,肝素10U·mL-1,青、链霉素各 100U·mL-1,胎牛血清20%),隔日更换半量培养液1次。
将培养1周的贴壁细胞消化后,置于无菌盖玻片,95%冷乙醇固定,漂洗后滴加兔抗鼠CD31多抗(1∶200,Santacruz公司)和兔抗鼠Ⅷ因子多抗(1∶100,Santacruz公司),湿盒内 4℃过夜。PBS振洗,加异硫氰酸标记的二抗50μL(FITC IgG,武汉博士德),湿盒内37℃孵育1h,PBS洗涤后荧光显微镜观察。Ⅷ因子、CD31均为骨髓源性EPCs表面抗原,表达阳性者提示为分化早期的内皮细胞。由2名观察者独立对每块盖坡片上的染色阳性细胞进行记数,随机计数10个非重叠视野(×200),计算阳性细胞表达率。
M199培养液调整培养至9d的贴壁细胞密度为5×108·L-1,加入激光扫描共聚焦显微镜专用培养皿,与 Dil-acLDL(2.4ng·mL-1)37℃孵育 1h,弃去上清液,2%多聚甲醛固定10min,PBS浸洗,与FITC-UEA-Ⅰ(10μg·mL-1)37℃孵育 1h,弃去上清液,PBS浸洗后,激光扫描共聚焦显微镜下观察,Dil-acLDL和FITC-UEA-Ⅰ双染色阳性细胞为正在分化的EPCs[5],随机计数10个非重叠视野(×200),计算双染色阳性细胞比例。
2.4 给药方法
取2个96孔培养板,每板取中央60孔加细胞。将培养至9d的EPCs以0.25%胰蛋白酶消化后,调整细胞密度为5×105·mL-1,每孔加100μL细胞悬液,饥饿培养12h后,分别加入各组血清(将各组血清用含10%小牛血清的1640培养液配成10%的血清孵育液),培养24h。
2.5 EPCs中VEGF、HGF、HIF-1α的mRNA表达
采用实时PCR(Real-Time PCR)检测方法,含药血清作用终点,收集各组贴壁细胞,Trizol法提取总RNA,20μL反转录反应体系中经特异性引物(见表1)反转录成cDNA,以1μL cDNA为模板,以磷酸甘油醛脱氢酶(GAPDH)为内参照,ABI7500 Real-Time PCR仪器中反应,反应参数:预变性95℃30s,95℃变性5s,60℃退火34s,40个循环,95℃ 15s,60℃1min。反应结束后,由7 500 Real-Time PCR软件自动记录荧光曲线并分析计算出Ct值,检测被测样品RNA的完整性和可靠性,应用ΔΔCt[(样品Ct均值-内参照Ct均值)-(对照样品Ct均值-对照内参照Ct均值)]方法进行相对定量,然后取2-ΔΔCt即代表被检样品初始mRNA的含量,大于2是高表达,小于0.5是低表达。

表1 Real-Time PCR引物序列
2.6 统计分析
采用SAS6.12统计软件,统计数据均以x¯±s表示,组间差异性比较采用单因素方差分析,以P<0.05为差异具有统计学意义。
3 结果
3.1 EPCs的培养与鉴定
原代细胞培养24h后,部分细胞出现变形,隐约可见伪足;3d时可见细胞集落形成;7d时可见梭形细胞明显增多,见图1。M199实验培养液诱导培养1周后,骨髓源性EPCs表面抗原Ⅷ因子、CD31阳性表达的细胞分别为(38.4±4.1)%、(35.1±4.5)%,见图2;Dil-acLDL和 FITC-UEA-Ⅰ双染色阳性细胞为(82.3±7.6)%,见图3。
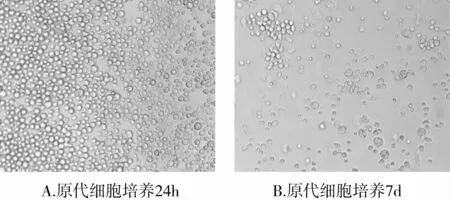
图1 内皮祖细胞(EPCs)的培养(×200)
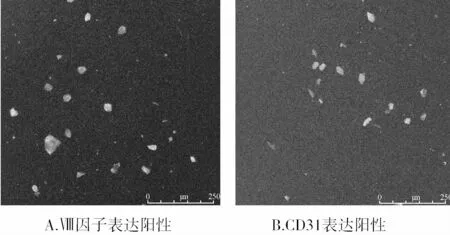
图2 EPCsⅧ因子、CD31免疫荧光染色(FITC标记,×200)
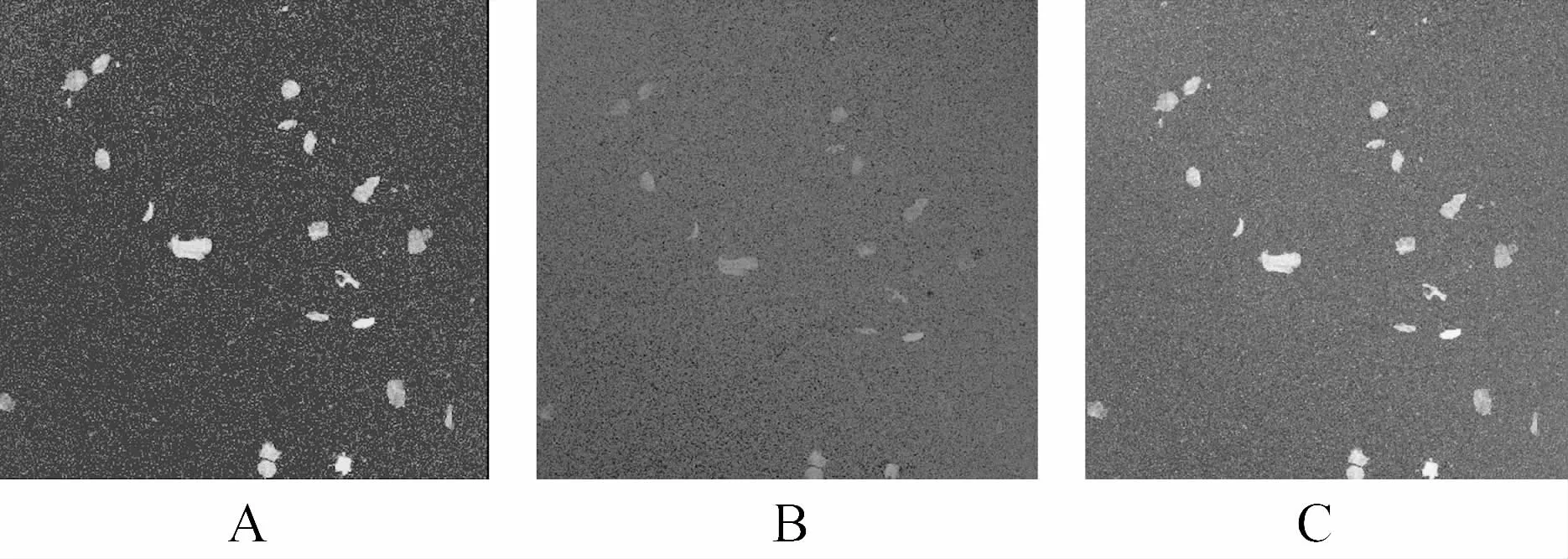
图3 培养的EPCs通过激光共聚焦显微镜鉴定(×200)
3.2 含药血清对 EPCs中 VEGF、HGF、HIF-1α m RNA表达的影响
Real-Time PCR检测结果发现,疏肝活血方能明显提高EPCs中VEGF、HGF、HIF-1α的mRNA表达量,与对照相比,差异具有极显著意义(P<0.01),详见表2。
表2 各组EPCs中VEGF、HGF、HIF-1α的m RNA含量(2-ΔΔCt,±s)
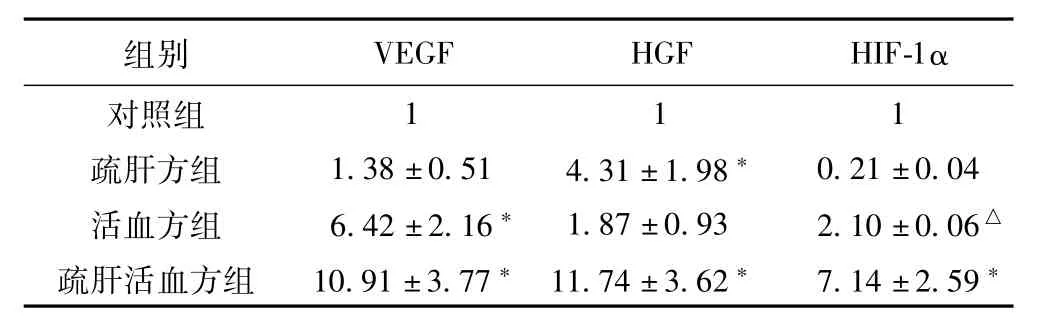
表2 各组EPCs中VEGF、HGF、HIF-1α的m RNA含量(2-ΔΔCt,±s)
注:与对照组比较,*P<0.01,△P<0.05
组别 VEGF HGF HIF-1α对照组111疏肝方组 1.38±0.51 4.31±1.98* 0.21±0.04活血方组 6.42±2.16*1.87±0.93 2.10±0.06△疏肝活血方组 10.91±3.77*11.74±3.62* 7.14±2.59*
4 讨论
内皮细胞是最接近于血流的一层细胞,释放出的蛋白质很容易通过血流扩散到全身从而广泛发挥作用。来源于骨髓的EPCs是内皮细胞的前体,具有旺盛的增殖能力,具有定向移植于血管生成部位的特点,能够直接分化为血管内皮细胞,在缺血等因素的刺激下,能够动员入血,对缺血组织的修复起着重要作用;能有效调控EPCs功能的因素,有可能具有明显的促血管新生作用。本研究成功建立了EPCs培养体系,并通过血清药理学的方法进一步观察了疏肝活血含药血清对EPCs中血管新生相关基因VEGF、HGF和HIF-1α表达的变化。
中医的 “肝”是一个范围广泛的功能活动系统,亦被称为 “造化之始、生命之源。”有学者通过 “从肝治心”立法,运用治肝为主的方药能明显促进缺血心肌新生血管的形成[6]。现代药理学亦证实,柴胡、香附等多数疏肝药物和复方对心血管系统均有改善作用。本研究发现,疏肝法与活血法相配伍,能够明显上调EPCs中血管新生相关基因VEGF、HGF和HIF-1α的表达,其效用明显强于疏肝法和活血法的单独应用。
VEGF是目前发现的最强效的促血管生成因子和调控干细胞向内皮分化的重要细胞因子,能促血管内皮细胞增殖、迁移,维持血管功能。缺血缺氧的刺激可诱导VEGF的基因表达,促进血管新生和对缺血组织的保护作用[7],但内源性VEGF表达的绝对量往往不足以完全代偿缺血缺氧的状态。因此,补充外源性VEGF基因,将会进一步促进血管生成,迅速改善缺血状态[8]。本研究发现,EPCs在疏肝活血方含药血清刺激下,VEGF的基因表达明显增强,其效应强于活血方和疏肝方,提示VEGF基因可能是本方的一个重要作用靶点。
HIF-1α是缺血缺氧发生与VEGF基因表达增强之间的一种重要的核转录调节因子[9]。缺氧促使HIF-1α过表达,并直接调控VEGF中的缺氧反应元件(HRE),在转录水平调控VEGF基因的表达。更深入的研究表明,在缺血缺氧后数小时内局部组织中即可出现 HIF-1αmRNA表达上调,明显早于VEGF的mRNA表达[10];当局部应用反义HIF-1α寡核苷酸时,VEGF的表达亦被阻断[11],将HIF-1α的干扰质粒注入裸鼠的缺血肢体,结果发现缺血肢体血流减少,皮温降低,毛细血管数量受到抑制[12],均提示了组织缺血缺氧诱导HIF-1α在缺血组织中过表达,是血管新生的始动因素之一,是机体对抗缺血缺氧的一种自我保护机制。本研究发现,在疏肝活血方含药血清的刺激下,明显增强了EPCs中内源性HIF-1α基因的表达量,这种效应可能进一步启动一系列的基因转录,包括红细胞生成素、VEGF等,然后通过这些基因的产物,充分发挥其抗缺氧、促进血管新生的作用。
HGF也是近年来被深入研究的功能强大的血管生成因子,既可通过促进血管内皮细胞分裂增殖、迁移趋化及形成管腔样结构而直接促进血管新生,又可通过诱导VEGF的mRNA表达间接促进血管生成,还可通过激活多种信号转导途径发挥抗内皮细胞凋亡的作用。目前,携带HGF质粒DNA转移至缺血组织,促进局部新血管生成的研究已进入临床试验,并可能成为治疗周围动脉闭塞性疾病的一种新手段[13]。本研究中,在疏肝或疏肝活血方含药血清的作用下,明显增强了EPCs中HGF的基因表达,提示疏肝理气方药有可能通过调控局部组织HGF基因的表达,增强EPCs的增殖、迁移及血管新生能力,改善EPCs的生物学功能。
同期进行的动物实验发现,给予肢体缺血裸鼠灌胃疏肝活血方后,肢体的缺血程度得以改善,血管新生效应明显增强(将另成文发表)。本研究结果提示了促进EPCs中血管新生相关基因VEGF、HIF-1α和HGF的表达是疏肝活血方促血管新生作用的机制之一。
[1]Murayama T,Tepper OM,Silver M,et al.Determination of bone marrow-derived endothelial progenitor cell significance in angiogenic growth factor-induced neovascularization in vivo[J].Exp Hematol,2002,30(8):967-972.
[2]李大勇,谭鸿雁,吕延伟,等.中西医结合治疗足部缺血性坏疽——13例报告[J].中国中西医结合外科杂志,2008,14(2):531-532.
[3]李大勇,陈文娜,刘艳玲,等.疏肝活血方含药血清对鸡胚绒毛尿囊膜血管生成的影响[J].中国中医基础医学杂志,2009,15(8):623-624.
[4]李大勇,陈文娜,谷峰,等.疏肝活血方含药血清对内皮祖细胞数量及功能的影响[J].中国中西医结合外科杂志,2009,15(5):535-539.
[5]顾俊,王长谦,范华骅,等.外周血内皮祖细胞体外培养分化研究[J].上海交通大学学报(医学版),2006,26(3):233-236.
[6]刘小雨,王行宽,杨孝芳.从肝治心组方对急性心肌梗死大鼠心肌毛细血管密度的影响[J].中国中西医结合急救杂志,2004,11(1):17-20.
[7]Arany Z,Foo SY,Ma Y,et al.HIF-independent regulation of VEGF and angiogenesis by the transcriptional coactivator PGC-1alpha[J].Nature,2008,451:1008-1012.
[8]刘强,周和成,赵彦平.栓子携带的血管内皮细胞生长因子165在血栓闭塞性脉管炎中的研究[J].江西医药,2009,44(3):223-226.
[9] Jiang M,Wang B,Wang C,et al.Angiogenesis by transplantation of HIF-1 alpha modified EPCs into ischemic limbs[J].JCell Biochem,2008,103:321-334.
[10]黄越芳,庄思齐,陈东平.新生大鼠缺氧缺血性脑病模型脑组织新生血管形成及调控因素[J].中华儿科杂志,2004,42(3):210-215.
[11]周健,黄岚,晋军,等.低氧诱导因子1α抑制大鼠缺血下肢血管生成及内皮祖细胞的动员[J].中华老年心脑血管病杂志,2006,(8):474-477.
[12]姜萌,王彬尧,王长谦,等.低氧诱导因子-1α小干扰质粒(siHIF-1α)抑制体内血管新生[J].标记免疫分析与临床,2008,15(3):150-155.
[13]张庆林,李元敏,吴祖泽.肝细胞生长因子基因治疗周围动脉闭塞症研究进展[J].中国修复重建外科杂志,2006,20(11):1147-1150.
Li Dayong1,Chen Wenna2,Gu Feng2,Ma Xiande2,Wang Baiqing2,Yuan Mingdian1
(1.Department of Vascular Surgery,the First Affiliated Hospital of Liaoning Traditional Chinese Medical University,Shenyang Liaoning 110032,China;2.Liaoning Traditional Chinese Medical University,Shenyang Liaoning 110032,China)
Effects of Shugan Huoxue Recipe Serum on Expression of Angiogenesis Related Genes in EPCs Derived from Rat Bone M arrow
Objective:To investigate the effects of Shugan Huoxue recipe serum on expressions
of angiogenesis related genes of endothelial progenitor cells(EPCs)derived from rat bonemarrow,includingvascular endothelial growth factor(VEGF),hepatocyte growth factor(HGF)and hypoxia inducible factor 1α(HIF-1α).M ethods:The attached mononuclear cells isolated from rat bone marrow were assessed by immunofluorescence cytochemistry and laser scanning confocalmicroscope after 1 week culture.The application of real-time polymerase chain reaction(Real-Time PCR)detection was used to observe themRNA expression of VEGF,HGF and HIF-1αin EPCs,which were stimulated with the drug serum of Shugan Huoxue recipe and its separated recipe for 24h.Results:After cultured and induced by the drug serum,the cells represented the morphology and immunology characteristics identicalwith the endothelial cells.The drug serum of Shugan Huoxue recipe could increase themRNA expressions of VEGF,HGF and HIF-1αin EPCs,and the difference was obviously significant compared with control group(P<0.01).Conclusion:Shugan Huoxue recipe could increase the expressions of angiogenesis related genes in EPCs(VEGF,HGF and HIF-1α),and this pathway was one of themechanisms on promoting angiogenesis.
Endothelial progenitor cells;Shugan Huoxue recipe;Serum pharmacology
国家自然科学基金项目(30600843),“十一五”国家科技支撑计划项目(2008BAI53B012),辽宁省科技厅博士启动基金项目(20061030)
*李大勇,Tel:(024)86291229,E-mail:sylidy@yahoo.com.cn

