沙棘黄酮及其转化研究最新进展
冯淑环,殷丽君,王 佳,袁 圆,焦 翔,李 刚,薛文通,程永强,*
(1.中国农业大学食品科学与营养工程学院,北京 100083; 2.中绿华夏有机食品认证中心,北京 100081;3.青海康普德生物制品有限公司,青海西宁 810003)
沙棘黄酮及其转化研究最新进展
冯淑环1,殷丽君1,王 佳1,袁 圆1,焦 翔2,李 刚3,薛文通1,程永强1,*
(1.中国农业大学食品科学与营养工程学院,北京 100083; 2.中绿华夏有机食品认证中心,北京 100081;3.青海康普德生物制品有限公司,青海西宁 810003)
沙棘黄酮是沙棘中的主要活性成分,其主要的存在形式是由槲皮素等苷元构成的糖苷型化合物。由于相对于糖苷型黄酮来说,苷元型黄酮更利于吸收且功能性更强,因此很多实验报告对糖苷型黄酮类化合物转化为苷元型化合物进行了报道。基于目前的研究情况,本文对沙棘黄酮的结构、存在形式、功能特性及其生物转化等的最新研究进展做了综述。
沙棘,黄酮,苷元,糖苷,转化
1 沙棘黄酮的结构、组成
沙棘 (Hippophae rham noidesL1)为胡颓子科酸刺属灌木或小乔木[1]。沙棘的叶子及果实等部位含有多种对人体有益的功能成分,如维生素、有机酸、氨基酸、脂肪酸、脂类、酚类、蛋白质、微量元素和黄酮类化合物[2]。其中黄酮类化合物是其最重要的功能活性成分之一。
黄酮类化合物 (falconoid)以前主要是指基本母核为 2-苯基色原酮类化合物,现在则是泛指两个苯环(A-与B-环)通过中央三碳链相互连结而成的一系列化合物,见图 1。
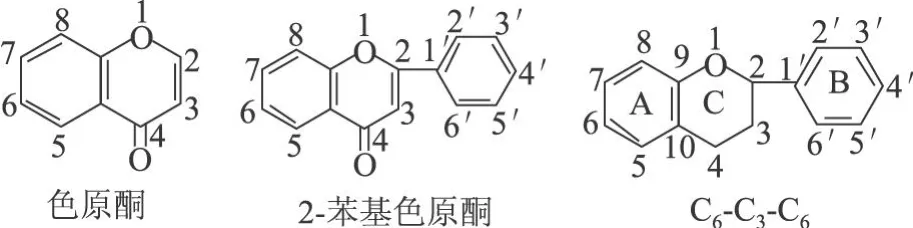
图1 黄酮类化合物结构
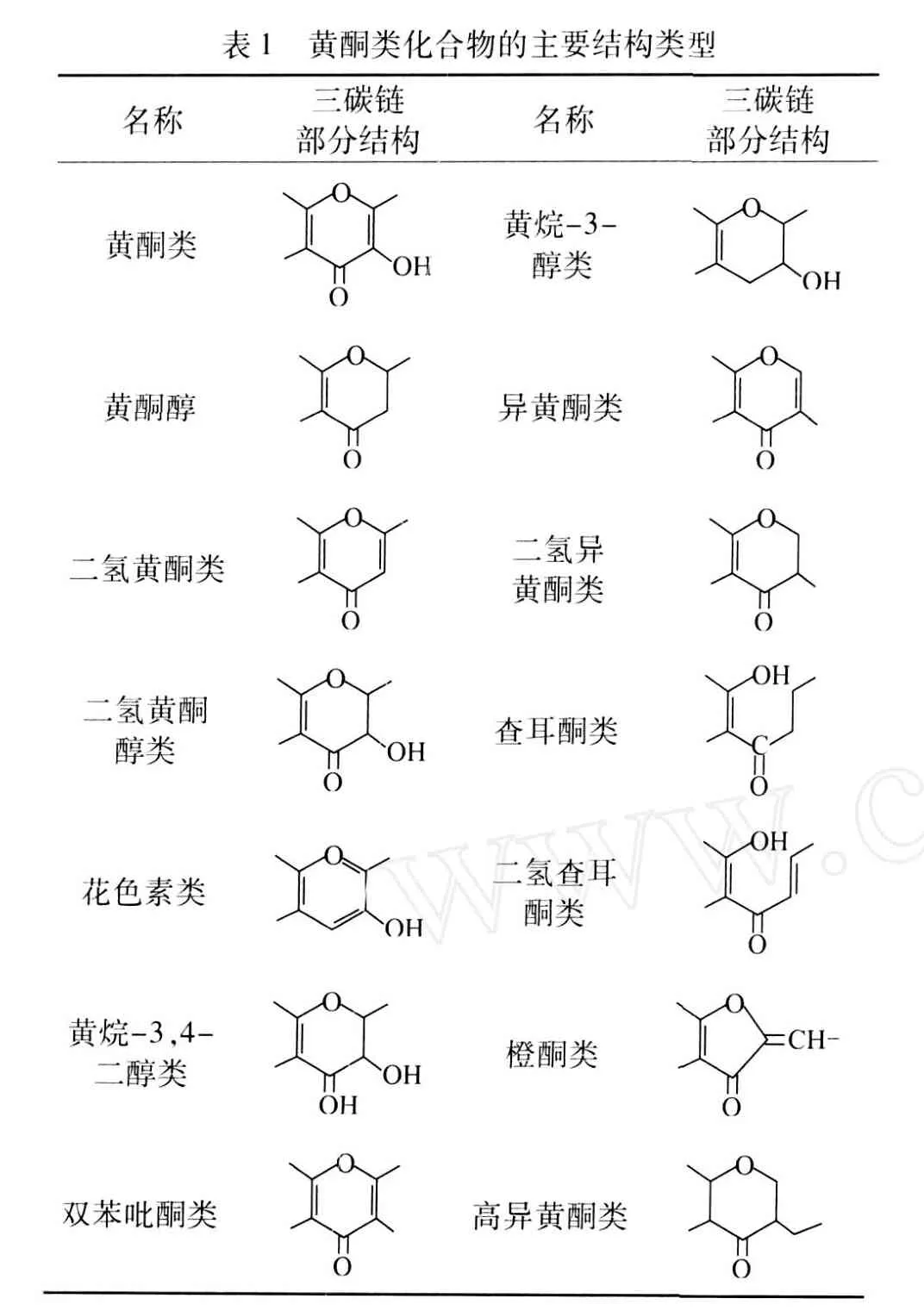
根据中央三碳链氧化程度、B-环连接位置 (2-或 3-)以及三碳链是否构成环状等特点,将重要的天然化合物分类如表 1所示[3]。
黄酮是沙棘及其制品中重要的活性成分。由沙棘果和叶中提取的沙棘黄酮(酚类化合物)是许多化合物的总称,其中包括主要配基山奈酚、槲皮素、异鼠李素、杨梅素和芹菜素等,其存在形式为上述配基的糖苷。构成苷类的糖有:葡萄糖、异鼠李糖、阿拉伯糖、半乳糖,并且以 3-O-糖苷形式为主[4]。黄酮属多酚类化合物,根据化学结构将沙棘中黄酮分为 6类:黄酮醇(I)、二氢黄酮醇 (II)、黄烷醇 (Ⅲ)、白花青素类 (Ⅳ)、查尔酮(V)和花青素类(V I)[5]。见图 2。
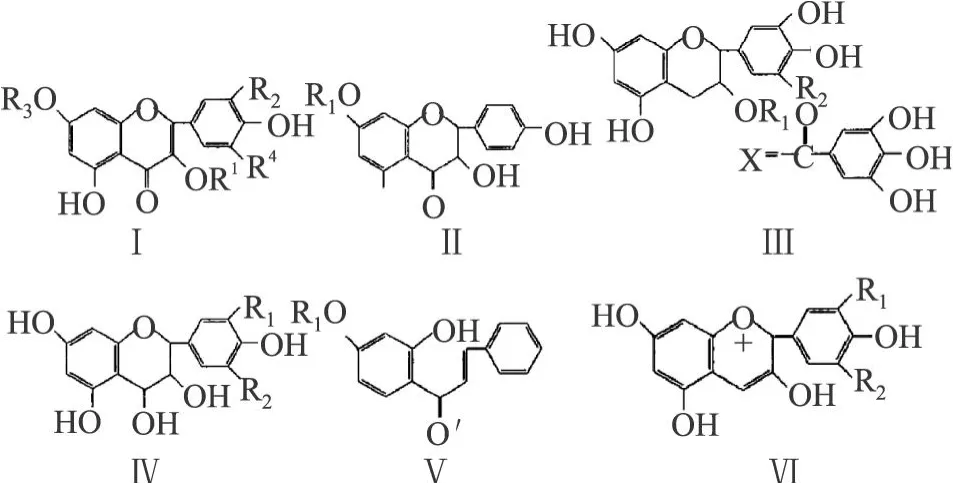
图2 沙棘中黄酮化学结构
?
Zu等[6]用一种快速特定的方法即带有二极管阵列的高效液相色谱法,同时测定了沙棘叶提取物中五种类黄酮包括儿茶素、芦丁、槲皮素、山奈酚、异鼠李素。图 3是这五种类黄酮的结构式。
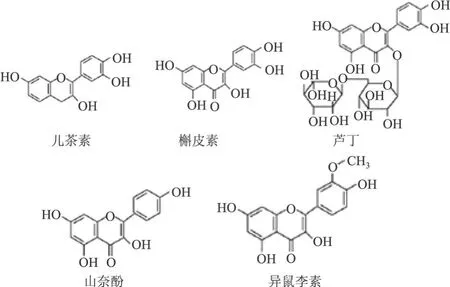
图3 几种重要的沙棘黄酮结构
2 沙棘黄酮的生理功能
近年来,很多体内和体外实验都表明黄酮类化合物有很多的有益生物活性物质,包括抗炎症、抗过敏、抗癌、抗高血压、抗关节炎和抗菌活性,降低慢性疾病如心血管疾病,治疗皮肤病,防止血小管凝集抗过敏作用、抗肿瘤等[7-10]。因此,膳食来源黄酮类化合物已经引起了人们的极大兴趣。
2.1 抑菌、抗病毒作用
黄酮类化合物对自然界中许多病原微生物具有广泛的抑制和杀灭作用。殷彩霞等[11]指出,酚类化合物及其衍生物有杀菌和抑菌的作用。黄酮类化合物的化学结构属于酚类衍生物,从而表现出一定的抑菌功能。
2.2 抗心脑缺血作用
沙棘总黄酮 (TFH),沙棘在许多药理作用方面与银杏相似,而银杏 (TFG)抗心脑缺血作用已在临床上广泛应用。王立群等[12]实验表明,TFH和 TFG对离体大鼠工作心脏缺血后心功能及血流动力学指标有不同程度的改善作用,且 TFH作用明显优于TFG。
2.3 抗氧化、消除自由基作用
吴英等[13]研究表明,沙棘黄酮对大鼠心肌缺血再灌注损伤时能明显减轻缺血再灌注区超微结构的病理改变,显著提高大鼠心肌组织 SOD活性并减少MDA的生成。TFH对大鼠心肌缺血再灌注损伤的保护作用可能与提高自由基清除酶活性及抑制脂质过氧化反应有关。
2.4 降血糖作用
沙棘中黄酮极显著地降低链脲佐菌素诱导糖尿病大鼠血糖、果糖胺、血脂水平,提高血清白蛋白、总蛋白含量,增强机体抗氧化能力。这说明沙棘中黄酮能有效地控制糖尿病大鼠血糖水平,纠正其物质代谢紊乱[14]。
2.5 有效治疗皮肤创伤
Asheesh Gupta等[15]通过小鼠实验,证明沙棘黄酮能够提高伤口面积缩减速度,缩短外皮形成时间。另外,实验发现沙棘黄酮具有抗氧化特性,因为伤口肉芽组织的谷胱甘肽含量增加了 55.0%,维生素 C增加了 70.0%,过氧化氢酶增加了 20%。黄酮治疗同时导致了脂质过氧化物水平降低(39.%)。
3 沙棘不同部位的黄酮含量比较
沙棘叶子和果实中黄酮类化合物随着沙棘种类不同而含量各异,这与基因型和环境有关。Barl等[16]研究了起源于中国、俄国、芬兰和加拿大等国家的不同沙棘品种的果实和叶子的黄酮类化合物的含量,风干的沙棘叶子中异鼠李素类含量为 0.83%~2.00%,冻干果肉中异鼠李素含量 0.18%~0.56%。
同一沙棘品种的不同部位以及不同产地及环境的沙棘资源,黄酮含量也不相同。很多研究表明沙棘叶中黄酮类化合物含量要高于果实中[17]。前苏联学者的测定结果鲜果中最高含量为 854mg/100g,干叶为 3888mg/100g;中国学者测定的数值则是鲜果平均为 354mg/100g,叶子 876mg/100g。李春英等[18]考察了引种于俄罗斯的大果沙棘不同部位总黄酮含量的差异。实验结果表明,叶中总黄酮含量分别是果肉和果皮的 2.3倍和 3.1倍。
4 沙棘叶中黄酮糖苷和黄酮配基的含量
通过对沙棘果实的系统分析,沙棘果实中的黄酮配基是以黄酮糖苷的形式存在,是水解过程中由糖苷经水解反应生成的[19]。翁佳燕等[20]探讨了沙棘叶中的黄酮糖苷和配基的确切含量。实验证明,沙棘叶中的黄酮配基是以黄酮糖苷的形式存在,在水解过程中可由糖苷经水解反应形成,对槲皮素、山奈素和异鼠李素都是如此。与沙棘果的情况完全类似。
通过系统研究发现沙棘的叶子和果实中,几乎所有的沙棘黄酮都是由槲皮素、山奈素、异鼠李素和杨梅素这四种主要的苷元物质和各种糖组成的糖苷型黄酮类化合物,游离的黄酮苷元很少。这种糖苷型的结构使黄酮类化合物很稳定,不易受环境影响而降解。自然界很多植物中的黄酮类化合物如大豆异黄酮、银杏叶黄酮、竹叶黄酮等都是以这种糖苷型存在的。
5 糖苷型和苷元型黄酮化合物的吸收及功能比较
从动物体对黄酮的吸收率来看,黄酮在动物体内的代谢途径不相同,黄酮苷元可以直接被吸收进入动物血液中,黄酮苷元比黄酮糖苷具有更高的生物利用率。在这方面,人们对大豆异黄酮的研究较多。
人体实验表明,大豆异黄酮主要在肠道中被吸收,脂溶性的苷元可从小肠直接吸收,机理尚不清楚,估计是由于苷元的脂溶性以及分子空间结构较小,使得苷元可被小肠壁上的绒毛上皮细胞被动扩散直接吸收。糖苷型的通过结肠中的细菌、微生物的β-葡萄糖苷酶或β-半乳糖苷酶作用而水解,生成的产物又进一步被细胞降解,生成苷元,被结肠壁吸收入血。此外,不同形式的异黄酮在机体内的吸收也不同,其配糖体几乎不被吸收。
Kenneth等[21]研究指出,在人体内,糖苷型异黄酮不能直接被吸收,而是先被小肠的β-葡萄糖苷酶水解后脱去糖基进入血液中,才能发挥各种生理作用。而且小肠的β-葡萄糖苷酶由于个体差异,活性有很大的差别。Mariusz等[22]在动物实验中发现,在小鼠的胃中,苷元型的染料木素和大豆苷元可以被直接吸收,而它们相对应的糖苷型染料木苷和大豆苷却不能被直接吸收。Izumi等[23]经过研究进一步得出结论:在人体内,苷元型的大豆异黄酮比糖苷型吸收更快,被吸收量更多。
另外,由于黄酮苷元更容易被吸收,其各种生物活性功能也更强。高荣海等[24]发现小鼠对大豆异黄酮苷元吸收效果强于大豆异黄酮糖苷,大豆异黄酮苷元免疫功能优于大豆异黄酮糖苷。银杏叶中含有丰富的黄酮类物质,主要是由山奈酚、槲皮素以及异鼠李素等黄酮苷元与葡萄糖等单糖以 O-糖苷键连接而成,具有广泛的药理作用,是极好的天然抗氧化剂。银杏黄酮被水解成苷元后清除人体氧自由基的生物活性要明显高于黄酮糖苷,黄酮苷元的效价是黄酮糖苷效价的 7倍[25]。
可见,改善黄酮类物质的构型是提高其在人体内吸收率的重要途径。对黄酮类化合物进行转化以提高其生物利用率,提高其生物功能的发挥,既能提高对资源的利用,又能为人类健康带来更多的福音。
6 目前关于糖苷物质转化方法的研究
目前已经有很多关于黄酮类化合物的转化实验研究,如大豆异黄酮苷元的制备、银杏黄酮苷元的制备、竹叶黄酮糖苷的水解等,主要是利用酶解法和微生物转化方法。
研究较多的就是大豆异黄酮的转化。大豆异黄酮糖苷属于氧苷类,是酚羟基与糖缩合而成的β-葡萄糖苷。通过水解反应使糖苷键裂解得到大豆异黄酮苷元和葡萄糖配基。大豆异黄酮的水解包括酸水解、碱水解、大豆异黄酮 Smith降解等方法[26]。
6.1 酶解转化
因为酶的专属性很强,酶水解条件温和,多采用弱酸性缓冲溶液,苷元物质破坏较少,因此利用酶水解是工业上制备富含大豆异黄酮苷元保健食品十分有前途的方法。研究最多的大豆异黄酮糖苷水解酶就是β-葡萄糖苷酶。葡萄糖酸酶[27]和半乳糖苷酶等也有很强水解大豆异黄酮糖苷能力。高荣海等[28]以β-葡萄糖苷酶为水解酶确定了大豆异黄酮糖苷转化为大豆异黄酮苷元的最佳酶法水解工艺,酶法水解率 82.54%。并比较得出,酶法水解的水解率高于酸法水解的水解率,且酶法水解反应条件温和,得到的苷元产品稳定。陈庆庆和夏黎明[29]利用固定化β-葡萄糖苷酶把糖苷型异黄酮水解成苷元型异黄酮,转化率均可保持在 90%以上。该研究结果在大豆异黄酮的生物转化方面具有潜在的应用前景。
很多实验对黄酮糖苷生物转化及其黄酮苷元产物进行研究时发现利用柚苷酶结合其它复合酶处理,具有良好的转化作用,提高了黄酮类物质的生物活性及生物利用率。刘萍等[30]将沙棘黄酮糖苷经过α-鼠李糖苷酶(1 IU)、β-葡萄糖苷酶 (2 IU)等复合酶预处理后,黄酮糖苷转化率仅为 0.23%,再用柚苷酶水解可获得高含量的黄酮苷元,总黄酮苷元转化率达85.59%。在银杏叶提取物中黄酮苷酶法转化苷元的研究中,王建伟等[31]将银杏黄酮苷经过复合酶预处理后再用柚苷酶水解,产品银杏苷元黄酮含量达59.65%。
6.2 微生物转化
所谓微生物转化是利用微生物细胞中的酶高效地、选择性地催化一种化学成分进行某种化学反应,以获得具有高活性成分的过程。利用微生物发酵液中的代谢酶转化糖苷型大豆异黄酮为苷元形式的大豆异黄酮不仅可以降低成本,而且具有反应条件温和,大豆异黄酮苷元不易变性等优点,因此成为近年来许多学者研究的热点之一。
大豆制品发酵过程中能分泌β-葡萄糖苷酶的微生物,主要是曲霉、根霉、毛霉和酵母等真菌,尤其是根霉属[32]。李剑梅等[33]以大豆异黄酮粉为原料,用培养米曲霉菌发酵制备的β-葡萄糖苷酶能使大豆异黄酮苷转化率达到 90%以上,生物利用率明显提高。王振丽[34]筛选了产胞外β-葡萄糖苷酶活力较高的菌株LWQ-0508。王秀伶等[35]以氢黄豆苷元为底物,分离出了能转化二氢黄豆苷为 100%S-型雌马酚的革兰氏阴性细菌菌株。本项目为雌马酚的生物转化提供了理论基础,并具有广阔的应用前景,该项目居国际先进水平。
在其他黄酮类化合物的转化方面,孙君社等[36]公开了一种银杏黄酮苷元的生产方法,采用微生物菌株或生物酶作用原料中,黄酮糖苷的生物转化技术提高产物中黄酮苷元含量,达到 85%以上,为原料中黄酮苷元含量的 5~20倍;以大孔吸附树脂结合重结晶技术提高产品中黄酮的含量,可以达到 90%以上。
7 展望
综上所述,关于沙棘黄酮的研究正处于不断探索时期。目前关于沙棘黄酮虽然有一些研究,但是还没有形成系统,相对于大豆异黄酮来说还存在很大的差距。另外,目前对沙棘的综合利用多集中在沙棘果,提取物成本的大大增加,价格远远超过市售的银杏叶提取物。根据文献报道和实验结果证明,以往作为废弃物丢弃的沙棘叶中同样含有大量的黄酮类物质,其含量比果实高。而且,叶子还有产量大,易采摘收集,储存方便,采摘周期长等优势。因此,应该合理利用生物量丰富的沙棘叶资源,变废为宝,促进无废料沙棘的开发。
对于糖苷类物质向苷元的转化,酶解法转化中催化剂是昂贵的糖苷水解酶,成本高,不利于工业化生产,因此应该更多考虑微生物进行转化。微生物在常温、常压等较为温和的条件下进行糖苷的转化,能最大限度保护原料中化学成分免遭破坏,为绿色环保技术,能够在最小成本下获得最大利益,符合未来工业发展的方向。因此,对沙棘黄酮的转化研究应该重点放在高效微生物转化方法的开发上。
[1]金怡,姚明 .沙棘的研究概况[J].中国医药信息,2003,20 (3):21-22.
[2]杨芳 .沙棘的研究进展 [J].第一军医大学分校学报, 2004,27(1):791.
[3]姚新生 .天然药物化学 [M].第二版 .1988,5:192.
[4]翁佳燕,吴晓婧,李瑞霞,等 .沙棘叶中黄酮糖苷和黄酮配基的含量[J].国际沙棘研究与开发,2007,5(2):1-4.
[5]高锦明,张鞍灵,李芸生,等 .沙棘黄酮化学研究的进展[J].沙棘,1998,1(2):34-40.
[6]Yuangang Zu,Chunying Li,Yujie Fu,et al.Simultaneous determination ofcatechin,rutin,quercetin,kaempferoland isorhamnetin in the extract ofsea buckthorn(Hippophae rhamnoidesL.)leaves by RP-HPLC with DAD[J].Journal of Pharmaceutical and BiomedicalAnalysis,2006,41:714-719.
[7]R Puupponen-P imia,L Nohynek,C Meier,etal. Antimicrobial properties of phenolic compounds from berries[J]. Journal ofAppliedMicrobiology,2001,90(4):494-507.
[8]Jiayi Cheng,Kazunao Kondo,Yasuhiro Suzuki,et al. Inhibitory effects of total flavones of Hippophae RhamnoidesL on thrombosisin mouse femoralartery and in vitro platelet aggregation[J].Life Sciences,2003,72:226-227.
[9]李丽芬,杨立志,石相兰 .沙棘粉对小鼠耐寒耐冷缺氧疲劳的影响[J].西北药学杂志,1992,7(3):18-19.
[10]黄华艺,查锡良 .黄酮类化合物抗肿瘤作用进展 [J].中国新药与临床杂志,2002,21(7):428-433.
[11]殷彩霞,谢家敏,张更,等 .茶多酚抑菌抗氧性能研究[J].云南化工,1999(2):24-26.
[12]王立群,郑金生 .沙棘总黄酮 (TFH)与银杏总黄酮(TFG)心血管药效学的对比研究 [J].中国煤炭工业医学杂志,2002,5(12):1205-1207.
[13]吴英,王秉文,王毅,等 .沙棘总黄酮对大鼠心肌再灌注损伤的保护作用[J].中国药理学通报,1997,13(1):53-55.
[14]马文强 .沙棘的生物学功能及其在畜牧业生产中的应用前景[J].NEW FEED,2007,(10):43-45.
[15]Asheesh Gupta,Ratan Kumar,Karan Pal,et al.Influence of sea buckthorn(Hippophae rhamnoides L.)flavone on dermal wound healing in rats[J].Molecular and Cellular Biochemistry, 2006,290:1-2,193-198.
[16]Barl B,Akhov L,Dunlop D,et al.Flavonoid content and composition in leaves and berries of sea buckthorn(Hippophae spp.)of different origin[J].Berry Crop Breeding,Production and Utilization forA New Century,2003,626:397-405.
[17]Liu Xijian,Wang Yanhui,Ma Running.Study on extraction and refining total flavones from marc of sea buckthorn.[J].Food Science,2004,25(6):138-141.
[18]李春英,王微,赵春建,等 .沙棘不同部位总黄酮含量的测定及比较[J].植物研究,2005,25(4):453-456.
[19]苏伟,翁佳燕,李瑞霞,等 .沙棘果中黄酮糖苷和黄酮配基的测定[J].国际沙棘研究与开发,2007,5(1):33-37.
[20]翁佳燕,吴晓婧,李瑞霞,等 .沙棘叶中黄酮糖苷和黄酮配基的含量[J].国际沙棘研究与开发,2007,5(2):1-4.
[21]Kenneth D R S,NadineM B,Linda ZN,et al.Evidence for lack of absorption of soy isoflavone glycosides in humans, supporting the crucial role of intestinalmetabolis m for biovailability[J].American Journal of Clinical Nutrition,2002, 76:447-453.
[22]Mariusz K P,Jun Y,Yukihiko I.Daidzein and genistein but not their glucosides are absorbed from the rat stomach[J].FEBS Letters,1999,447:287-291.
[23]Toru I,Mariusz K P,Sachiko O,et al.Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans[J].The Journal of Nutrition,2000,130:1695-1699.
[24]高荣海,赵秀红,郑艳,等 .大豆异黄酮糖苷和苷元免疫功能研究[J].粮油与油脂,2008(7):43-44.
[25]邹东恢,江洁 .β-葡聚糖酶的开发与应用研究[J].农产品加工,2005,42(8):7-9.
[26]高荣海,刘长江,李长彪,等 .大豆异黄酮糖苷水解研究进展[J].粮食与油脂,2006(8):10-12
[27]Tekel J,Daeseleire E,HeeremansA,et al.Development of a simple method for the determination of genistein,daid-zein, biochanin A,and formonoetin(biochanin B)in human arine[J]. Food Chemistry,1999,47(9):3489-3494.
[28]高荣海,李长彪,孟宪文,等 .大豆异黄酮糖苷水解工艺的研究[J].中国油脂,2007,32(5),52-55.
[29]陈庆庆,夏黎明 .固定化β-葡萄糖苷酶转化糖苷型异黄酮的研究[J].高校化学工程学报,2007,21(2):304-309.
[30]刘萍,郑亚安,王怡斯等 .沙棘叶黄酮糖苷生物转化黄酮苷元研究[J].高校化学工程学报,2006,20(6):996-1000.
[31]王建伟,李岱龙,孙君社 .银杏叶提取物中黄酮苷酶法转化苷元的研究[J].食品工业科技,2008,29(4):177-179.
[32]吴定,江汉湖 .发酵大豆制品中异黄酮形成及其功能[J].中国调味品,2001(6):3-6.
[33]辽宁省微生物科学研究院 .微生物酶法制备大豆异黄酮苷元的方法[P].CN200610134132.9,2007.05.23.
[34]王振丽 .利用微生物代谢酶转化大豆异黄酮的研究[D].沈阳农业大学,2007.
[35]王秀伶,邵建柱,朱宝成,等 .河北农业大学 .大豆异黄酮微生物转化菌株的筛选与鉴定[Z].国家科技成果,2006.
[36]中国农业大学 .银杏黄酮甙元的生产方法 [P]. CN03153489.9,2005.02.16.
The latest research progress in sea buckthorn flavonoids and their transformation
FENG Shu-huan1,Y IN L i-jun1,WANG Jia1,YUAN Yuan1,JIAO Xiang2, L I Gang3,XUEW en-tong2,CHENG Yong-qiang1,*
(1.College of Food Science&Nutritional Engineering,China AgriculturalUniversity,Beijing 100083,China; 2.China Organic Food Certification Center,Beiijing 100081,China; 3.Qinghai ComfortBioproducts Co.,Ltd.,Xining 810003,China)
Flavonoids a rethe m a in ac tive ing red ient in Sea buckthorn.The m a in form a re atyp e of g lycos ide comp ounds cons tituted by que rce tin and so on.Comp a red to g lycos ides typ e,the ag lycone typ e can be absorbed be tte r and is m ore func tiona l.So m any exp e r im enta l rep orts on the b iotransform a tion of g lycos ides into ag lycone typ e comp ounds have been rep orted.Based on current resea rch,the la tes t resea rch p rog ress in the sea buckthorn flavone s truc ture,form,func tion and othe r cha rac te ris tics and b iotransform a tion we re reviewed in this p ap e r.
sea buckthorn;flavonoids;g lycos ide;ag lycone;b iotransform a tion
TS201.1
A
1002-0306(2010)02-0351-05
2009-03-23 *通讯联系人
冯淑环(1985-),女,硕士在读,研究方向:食品生物技术。
国家“十一五”科技支撑计划(2007BAD83B03)。

