香菇多糖的过氧化氢脱色工艺研究
陈 健,耿安静,徐晓飞,2
(1.华南理工大学轻工与食品学院,广东广州 510640; 2.南方李锦记有限公司,广东广州 510620)
香菇多糖的过氧化氢脱色工艺研究
陈 健1,耿安静1,徐晓飞1,2
(1.华南理工大学轻工与食品学院,广东广州 510640; 2.南方李锦记有限公司,广东广州 510620)
为了脱除香菇多糖液中的色素,以过氧化氢 (H2O2)为脱色剂,选择脱色时间、脱色温度、pH和过氧化氢的质量百分比浓度等因素为实验因素,进行单因素实验,以此为基础进行 4因素 3水平的正交实验。结果表明,在脱色时间 3h、温度 55℃、pH7和过氧化氢的质量分数为 7%的脱色条件下,可以有效地去除香菇多糖液中的色素。过氧化氢脱色时间短,香菇多糖保留率高,脱色效果优于树脂。
香菇多糖,过氧化氢,脱色,分子量
香菇多糖(lentinan,LNT)是从伞菌科真菌香菇(lentinus edodes)的子实体中分离到的一种β-1, 3-葡聚糖,具有广泛的药理活性,如免疫调节作用、抗肿瘤[1-4]、抗衰老作用、提高免疫和刺激干扰素形成、对化学物质所致肝损伤具有保护作用以及作为LAK细胞活性向上调节剂(LURA)等,已成为当前研究的热点。本研究以过氧化氢为脱色剂,考察脱色时间、脱色温度、pH和过氧化氢浓度等因素对多糖脱色效果的影响,还考察了过氧化氢的脱色过程对多糖分子量的影响,并比较了过氧化氢脱色和树脂脱色效果,为多糖的分离纯化和香菇的开发利用提供理论与实践依据。
1 材料与方法
1.1 材料与设备
香菇粗多糖液 由南方李锦记有限公司提供,实验室自制;葡聚糖标准品 Dextrans Standand系列Mp=4400、9900、21400、43500、1248000、196000、277000、401000、1285000Da Sigma公司;双蒸水实验室自制;浓硫酸、重蒸苯酚、浓盐酸、氯化钠、无水乙醇、正丁醇、氯仿、H2O2、磷酸二氢钾等 均为分析纯。
JA2003N精密电子天平 上海精密科学仪器有限公司;N-1001旋转蒸发仪 上海爱朗仪器有限公司;AnkeTGL-16G高速台式离心机 上海安亭科学仪器厂;DBS-100自动部分收集器 上海沪西分析仪器厂;DE-310冷冻干燥器 德国威思公司; BT-200B数显恒流泵;凝胶渗透色谱(GPC)系统 美国 waters公司,Waters1525 Binary HPLC Pump、Waters 717 plus Autosampler、Waters 2414 Refractive Index Detector;数据处理系统 Breeze(V3.3)GPC工作站。
1.2 实验方法
1.2.1 脱色样品液的制备 香菇→水提喷雾干燥→得香菇多糖粉末→称量→溶解→乙醇沉淀→sevag法除蛋白→得香菇粗多糖溶液→放置于 4℃的冰箱里备用
1.2.2 单因素脱色条件的确定 影响过氧化氢脱除多糖液色素的重要因素有脱色时间、脱色温度、溶液pH和过氧化氢的浓度等因素。
根据预实验确立因素水平表(表 1),每个处理各取 10mL粗多糖液,于恒温水浴锅中脱色,在 420nm处用可见分光光度计测定溶液色素的吸光度,以脱色率作为实验指标,脱色率的计算公式为:
脱色率 =(脱色前的吸光度 -脱色后的吸光度)/脱色前的吸光度。
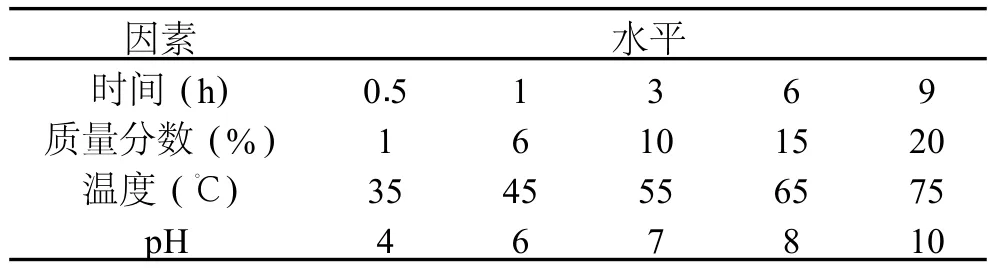
表1 因素水平表
1.2.3 过氧化氢脱色正交实验 在确定最佳单因素条件的基础上,选择 L9(34)表进行 4因素 3水平的正交实验,以确定脱色的最佳方案。以脱色率作为实验指标,实验方案如表 2所示。
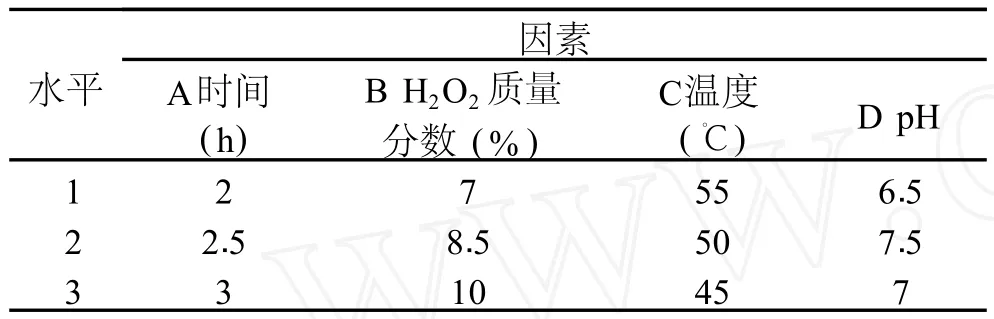
表2 正交因素水平表
1.2.4 树脂脱色工艺 按照文献[5]的方法对树脂进行预处理。取香菇粗多糖溶液,在 420nm测定其吸光度,用已处理的树脂在 45℃的恒温水浴中静态吸附脱色 3h后,再测定其吸光度,计算脱色率。
1.2.5 香菇多糖的纯化流程
1.2.5.1 过氧化氢脱色后的多糖纯化流程 香菇粗多糖溶液→过氧化氢脱色→过DEAE纤维素柱 (水洗脱)→浓缩→冷冻干燥→GPC测定分子量
1.2.5.2 717阴离子交换树脂脱色后的多糖纯化流程 香菇粗多糖溶液→717阴离子交换树脂脱色→过DEAE纤维素柱(水洗脱)→浓缩→冷冻干燥→GPC测定分子量
1.2.6 香菇多糖分子量分布的 GPC表征 按照文献[6]的色谱条件和测定方法进行分析。
2 结果与分析
2.1 时间对过氧化氢脱色的影响
用过氧化氢脱除多糖液色素时,原糖液加入10%的 H2O2溶液,在 45℃水浴中脱色 0.5、1、3、6、9h,脱色时间对多糖液的脱色实验结果如图 1所示。
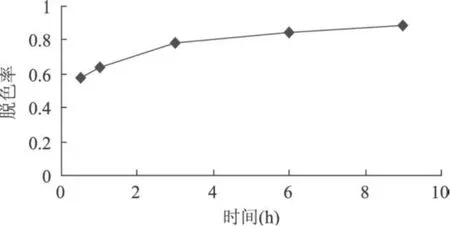
图1 时间对过氧化氢脱色的影响
由图 1可以看出,随着时间的延长,过氧化氢的脱色率逐渐增加,但到 3h以后,脱色率增加得很缓慢。从 0.5h到 3h,脱色率增加了 20.48%,但从 3h到6h,脱色率增加了 5.97%,从 6h到 9h,脱色率只增加了 4.22%。为此,选择 3h为最佳的脱色时间。
2.2 过氧化氢浓度对脱色效果的影响
糖液加入一定质量分数的过氧化氢脱除多糖液色素,在 45℃的水浴中脱色 5h,其结果如图 2所示。
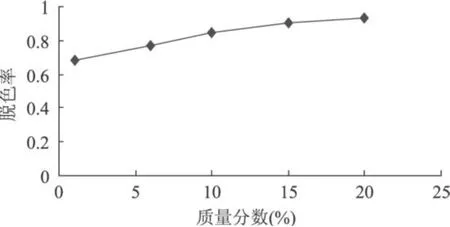
图2 过氧化氢浓度对脱色的影响
由图 2可以看出,随着过氧化氢浓度的增加,脱色率逐渐增加。当浓度由1%提高到10%,脱色率提高 15.9%,由 10%提高到 15%,提高的幅度是 6.4%,由 15%提高到20%时,脱色率仅提高 2.8%,可见,尽管随着过氧化氢的浓度的增加,多糖的脱色率增加,但增加得很平缓,增加的速度很小。考虑到脱色率、成本和降解等因素,实际情况下取 10%作为最大浓度。
2.3 温度对脱色效果的影响
用过氧化氢脱除多糖液色素时,原糖液加入10%的过氧化氢溶液,采用 35、45、55、65、75℃等脱色温度对多糖液的脱色 6h实验,结果如图 3所示。
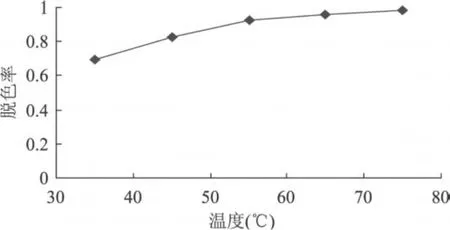
图 3 温度对H2O2脱除多糖色素的影响
由图 3可以看出,随着温度的升高,过氧化氢的脱色率逐渐增加,但当温度升高到 55℃时,脱色率增长幅度开始变得很缓慢。当温度从35℃提高到55℃时,脱色率提高 23.13%,从 55℃提高到 75℃,脱色率只提高 5.39%,考虑到香菇多糖在高温条件下容易降解,选择 55℃为脱色温度。
2.4 pH对脱色效果的影响
加入 pH为 4、6、7、8、10的缓冲液于香菇多糖溶液中,再加入10%的过氧化氢溶液,在55℃恒温水浴中脱色 6h,测定脱色前后的糖液的吸光度,计算脱色率,其结果如图 4所示。
由图 4可知,在酸性条件下,随着 pH上升,脱色率开始时缓慢增加,而后迅速增加,当 pH接近 7时,达到峰值,随后下降。考虑到酸性和强碱的条件下,多糖易降解,实际选择的 pH条件在中性附近。
2.5 过氧化氢脱色正交实验结果
脱色时间、脱色温度、pH和过氧化氢的加样量等综合因素对多糖液的脱色效果及极差分析结果见表3。
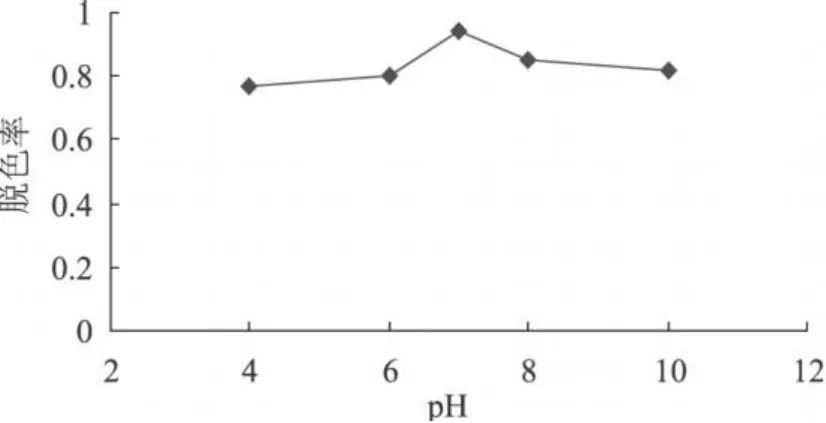
图4 pH对过氧化氢脱色的影响
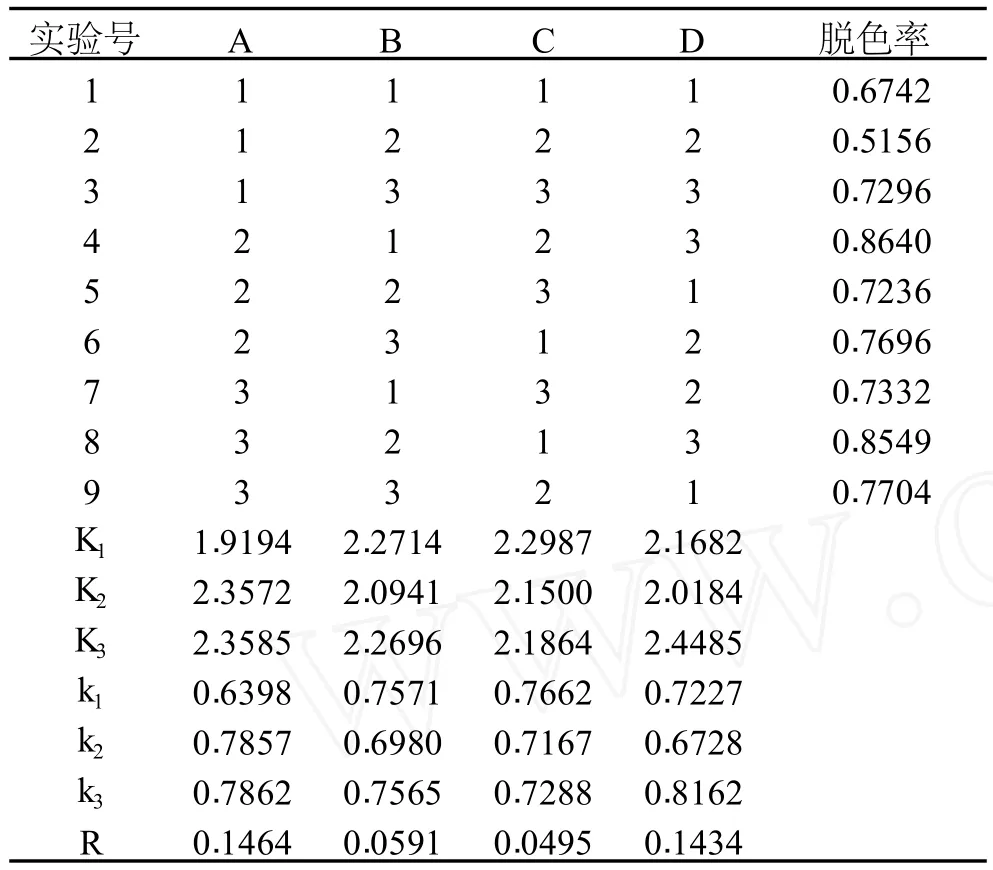
表 3 多因素影响过氧化氢脱除多糖液色素的正交实验结果
由表 3的极差分析可以看出,各因素对过氧化氢脱色影响顺序为A>D>B>C,即时间为最重要因素,其次为 pH、加样量和温度。理论优化方案为A3B1C1D3,即脱色温度为 55℃、时间为 3h、pH为 7,过氧化氢的质量分数为 7%,该条件下过氧化氢的脱色效率最高。
2.6 不同方法脱色所得的香菇多糖的比较
图 5中L1和L2分别为由 717阴离子交换树脂脱色工艺和过氧化氢脱色 (3h,7%,55℃,pH7)及后续纯化后获得的香菇多糖分子量 GPC图。

图 5 不同方法脱色对香菇多糖分子量的影响
可以表 4和图 5可知,经 717阴离子交换树脂脱色后,所得的香菇多糖 L1的重均分子量 (Mw)是 28945Da,多分散性为 2.40,而经过过氧化氢脱色后,所得的香菇多糖的重均分子量 (Mw)是 25967Da,多分散性分别 2.11。二者分子量和峰形状均比较接近,表明经优化的过氧化氢脱色工艺对香菇多糖分子量影响不大,对香菇多糖的降解作用小。
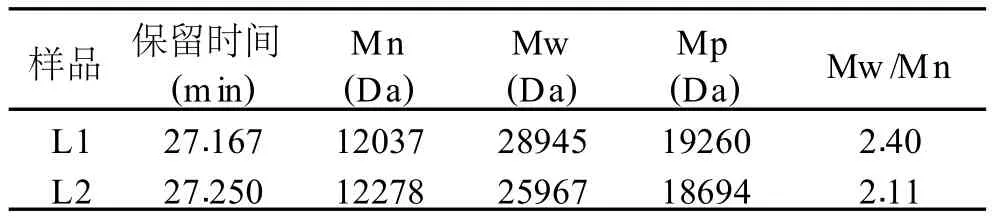
表4 L1与L2的GPC分子量数据

表 5 树脂与过氧化氢的脱色效果的比较
从表 5可知,用 717树脂脱色,脱色率要比过氧化氢脱色方法高出 4.1%;但多糖的保留率要低24.3%。用过氧化氢脱色所得的香菇多糖外观好,而且工艺简单,多糖保留率高。
3 结论
综上所述,为了探索用过氧化氢脱除香菇多糖色素的适宜条件,在脱色时间、脱色温度、pH和过氧化氢的加样量等单因素实验的基础上,设计上述 4因素 3个水平的正交实验方案,实验结果经极差分析发现,适宜的脱色条件是脱色时间 3h、脱色温度55℃、pH7、过氧化氢的质量分数为 7%。香菇多糖经过氧化氢短时间脱色后,不仅脱色率高,而且分子量也没有大的变化。通过比较树脂和过氧化氢脱色的效果、工艺等,过氧化氢除了无麻烦的预处理和再生、环保、脱色率高以外,多糖的保留率高。因此,过氧化氢脱色比树脂脱色更具有优势和广阔的运用前景。
[1]Chihara G,Maeda Y,Hamuro J,et al.Inhibition of mouse sarcom a 180 by polysaccharides from Lentinus edodes(Berk.) Sing[J].Nature,1969,222(5194):687-688.
[2]Chihara G,Hamuro J,Maeda Y,et al.Fractionation and purification ofthe polysaccharides with marked antitumour activity,especially lentinan,from Lentinus edodes(Berk.)Sing [J].Cancer Research,1970,30:2776-2781.
[3]Takuma Sasaki,Nobuo Takasuka.Futher study of the structure of Lentinan,an Antitumor Polysaccharide from Lentinus edodes [J].Carbohydrate Research,1976,47(1):99-104.
[4]袁静 .香菇多糖的抗肿瘤作用[J].上海医院药学,1999,10 (1):29-32.
[5]王元凤,金征宇 .茶多糖脱色的研究[J].食品与发酵工业, 2004,20(12):60-65.
[6]金鑫,赖凤英 .仙人掌多糖的提取、分离纯化及 GPC法测定其分子量[J].现代食品科技,2006(2):138-140,149.
Study on decolorizing technology of lentinan by hydrogen peroxide
CHEN Jian1,GENG An-j ing1,XU Xiao-fei1,2
(1.College ofLight Industry and Food Science,South China University of Technology,Guangzhou 510640,China; 2.NanfangLee Kum Kee Co.,Ltd.,Guangzhou 510620,China)
In orde r to decolorize the lentinan,hyd rogen p e roxide was used to be reagent for decolorizing it,and the t im e,temp e ra ture,pH as we ll as m ass frac tion of hyd rogen p e roxide we re se lec ted to be fac tors for the exp e r im ent of s ing le fac tor,then the orthogona l tes t w ith four fac tors and three leve ls was ca rried out on the aforem entioned bas is.The results showed tha t the p olysaccha ride was decolorized effec tive ly unde r the cond itions which the t im e was3h,the temp e ra ture was a t55℃,the pH was7and the m ass frac tion of hyd rogen p e roxide was7%.The decolora tion t im e by hyd rogen p e roxide was shorte r,and the re tention ra te of lentinan was highe r.In b rief,the decolora tion effec t by hyd rogen p e roxide was be tte r than by res in.
lentinan;hyd rogen p e roxide;decolorize;m olecula rwe ight
TS201.2
B
1002-0306(2010)03-0293-03
2009-03-25
陈健(1967-),男,博士,副教授,主要从事天然产物化学、糖分析等方面的研究工作。

