咸味香精中美拉德反应产物的抗氧化性研究
于汐洋,汪何雅,*,钱 和
(1.江南大学食品学院,江苏无锡 214122; 2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
咸味香精中美拉德反应产物的抗氧化性研究
于汐洋1,汪何雅1,*,钱 和2,*
(1.江南大学食品学院,江苏无锡 214122; 2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
利用膜分离手段从肉味香基中分离得到不同分子量范围的美拉德反应产物(MRPs),考察咸味香精中的肉味香基以及不同分子量的MRPs对卵磷脂脂质体的抗氧化效果。结果表明,肉味香基对脂质体过氧化有抑制能力,其抗氧化能力随反应物浓度的增加而增强。高分子量MRPs的抗氧化能力最强,其次为中分子量MRPs,小分子量MRPs抗氧化能力最弱,并且MRPs的抗氧化能力与其褐色程度成正比。
美拉德反应产物(MRPs),卵磷脂脂质体(LPS),抗氧化,褐色程度
1 材料与方法
1.1 材料与仪器
肉味香基 国内某香精公司;透析袋(MWCO 8000~14000) 国药集团化学试剂有限公司;超滤膜片(MWCO 1000) 无锡赛普膜科技有限公司;大豆卵磷脂、2,2′-盐酸脒基丙烷 (AAPH) sigma公司,纯度 98%;硫代巴比妥酸 (TBA)、三氯乙酸(TCA)、抗坏血酸 (VC) 国药集团化学试剂有限公司,化学纯。
UF201超滤设备 无锡赛普膜科技有限公司; R-501旋转蒸发器 上海申顺生物科技有限公司; YD-900L超声波细胞粉碎机 上海之信仪器有限公司;THZ-82恒温水浴振荡器 常州国华电器有限公司;WFJ7200可见分光光度计 尤尼柯 (上海)仪器有限公司。
1.2 实验方法
1.2.1 肉味香基中美拉德反应产物的初步分离 称取肉味香基原样,稀释、抽滤得澄清液体。4℃去离子水透析,直到透出液呈无色透明。未透出液记为H-MRPs(>14kDa),冷冻干燥备用。浓缩透出液,利用截留分子量 1kDa的超滤膜进行超滤分离(使用压力 0.5MPa),收集滞留液及滤液,分别记为M-MRPs(1~14kDa)、L-MRPs(<1kDa),冷冻干燥备用。
1.2.2 美拉德反应产物对卵磷脂脂质体氧化水平的影响
1.2.2.1 大豆卵磷脂脂质体 (LPS)的制备 参照文献[5]并稍加改进。大豆卵磷脂溶解于石油醚中,通过旋转蒸发器(35r/min,水浴 35℃)和氮气去除有机溶剂,得到均匀分散的卵磷脂薄膜,加入 10mmol/L磷酸缓冲液 PBS(pH 7.4),超声波处理 15min,得到白色、乳状的脂质体溶液LPS。
1.2.2.2 美拉德反应产物对卵磷脂脂质体氧化水平的影响
a.AAPH诱导氧化 首先确定AAPH诱导脂质体氧化最佳反应条件:卵磷脂脂质体浓度、AAPH浓度、反应时间,然后在最佳反应条件下测定样品对AAPH诱导的卵磷脂脂质体氧化水平的影响。在试管中加入不同浓度的LPS、AAPH和样品,混匀,避光于 37℃水浴孵育一定时间,冷却,加入 2mL TCATBA-HCl,混合液于沸水浴加热 15min,迅速冷却, 5500r/min离心 20min,取上清液于 532nm测定得到吸光度 As,重蒸水为空白对照,测得吸光度 Ac[6]。TBARS产物在 532nm的摩尔吸收系数为 1.56× 105M-1·cm-1。按下式计算样品对脂质体过氧化的抑制率:
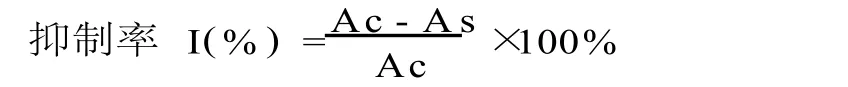
b.Fe3+/VC诱导氧化[7]试管中依次加入 1mL LPS、1mL 400μmol/L FeCl3、1mL 400μmol/L VC和1mL样品,混匀。避光并于 37℃水浴加热 60min,脂质过氧化测定及抑制率的计算方法同上。
c.自动氧化 试管中加入LPS,避光并于 37℃水浴加热 24h,脂质过氧化测定及抑制率的计算方法同上。
1.2.3 美拉德反应产物褐色程度的测定 用可见分光光度计在 420nm处测定。
2 结果与讨论
2.1 AAPH诱导的卵磷脂脂质体氧化条件的确定
不同脂质体浓度、AAPH浓度和反应时间对脂质体氧化的影响见图 1~图 3。
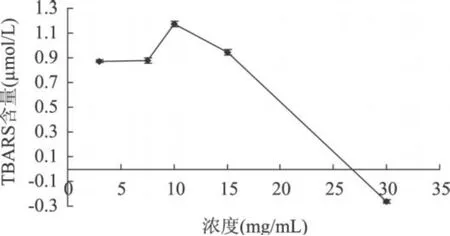
图1 不同浓度脂质体的氧化作用(反应 1h,AAPH为 5mmol/L)
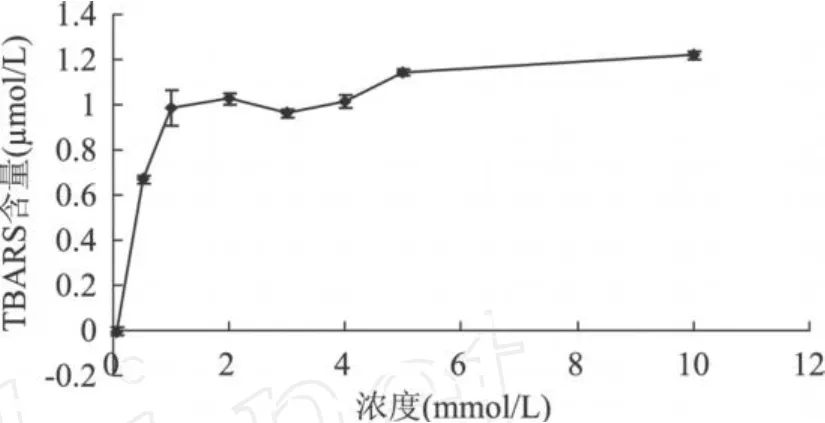
图2 不同浓度AAPH对脂质体的氧化作用(反应 1h,脂质体为 10mg/mL)
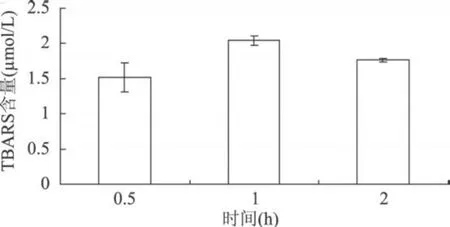
图 3 不同反应时间对脂质体的氧化作用(脂质体为 10mg/mL,AAPH为 5mmol/L)
由图 1可见,当脂质体浓度为 10mg/mL时,其氧化所生成的 TBARS量为最大,而浓度为 15mg/mL的脂质体,由于其本身在 532nm有较大吸收,且乳状液静置有沉淀,故最佳卵磷脂脂质体浓度为 10mg/mL。由图 2可见,AAPH浓度在 1~5mmol/L之间 T BARS量的变化有波动,且 10mmol/L AAPH引发脂质体氧化所生成的 T BARS量相比较 5mmol/L差异不显著(P>0.05),故最佳 AAPH浓度为 5mmol/L。由图 3可见,反应 1h后脂质体氧化程度最大,继续反应脂质体的氧化反而受到抑制,且存在显著差异(P<0.05),故最佳反应时间为 1h。
综上所述,AAPH诱导卵磷脂脂质体氧化的最佳反应条件为:卵磷脂脂质体浓度为 10mg/mL,AAPH浓度为 5mmol/L,反应时间为 1h。
2.2 肉味香基对卵磷脂脂质体氧化水平的影响
肉味香基原样对三种脂质体氧化体系的影响见图 4。由图 4可见,肉味香基原样对三种脂质体氧化体系都表现了较好的抑制能力,随着肉味香基浓度的增大,其对脂质体过氧化的抑制作用增强。很多研究表明,美拉德反应产物中有一定抗氧化活性的物质主要是类黑精、还原酮及一些含 N、S的杂环化合物。类黑精是美拉德反应中的大分子聚合体,由于其短肽氨基酸序列可促进肽与脂肪酸的相互作用,提高其对脂质自由基的捕捉能力,因而具有抗氧化活性[7];还原酮具有还原和螯合作用,这对抗氧化能力有一定的贡献;同时,美拉德反应产生的挥发性杂环化合物,如吡咯、呋喃、噻吩等,有助于自由基的亲电加成,因而具有较好的抗氧化能力[8]。同时,由图 4发现,相同浓度的肉味香基对三种脂质体氧化体系的抑制效果有一定差异,肉味香基对 Fe3+/VC诱导的脂质体氧化的抑制率最强。有学者指出[9],在使用过渡金属的氧化还原反应引发氧化时,体系中的一些成分(如 VC)能与自由基反应,干扰测定结果;同时MRPs不仅能清除自由基,还可螯合金属离子,因此其对 Fe3+/VC诱导的脂质体氧化的抑制作用比对自由基诱导的脂质体氧化要强。

图 4 肉味香基原样对三种脂质体氧化体系的影响
2.3 不同分子量范围的MRPs对卵磷脂脂质体氧化水平的影响
2.3.1 MRPs对AAPH诱导的卵磷脂脂质体氧化水平的影响 图 5描述了不同分子量范围的MRPs对AAPH诱导的卵磷脂脂质体氧化水平的影响。由图可见,初步分离后不同分子量范围的MRPs产物对脂质体表现出抗氧化能力,但是它们的抑制效果有明显差异。反应物起始浓度为 5mg/mL时,H-MRPs (分子量 >14kDa)与M-MRPs(分子量 1~14kDa)显著抑制了AAPH诱导的卵磷脂脂质体氧化,抑制率分别为 74.38%和 24.79%,但 L-MRPs(分子量 <1kDa)没有抑制效果。当反应物起始浓度增为10mg/mL时,L-MRPs的抑制率为 33.44%,而M-MRPs以及 H-MRP对脂质体氧化的抑制率则分别达到了 69.84%和 97.38%,抑制效果非常明显。综上可得,在AAPH引发的脂质体氧化体系中,不同分子量MRPs产物的抗氧化活性大小为:H-MRPs>M-MRPs>L-MRPs,其中 L-MRPs在低浓度不表现出抗氧化能力。
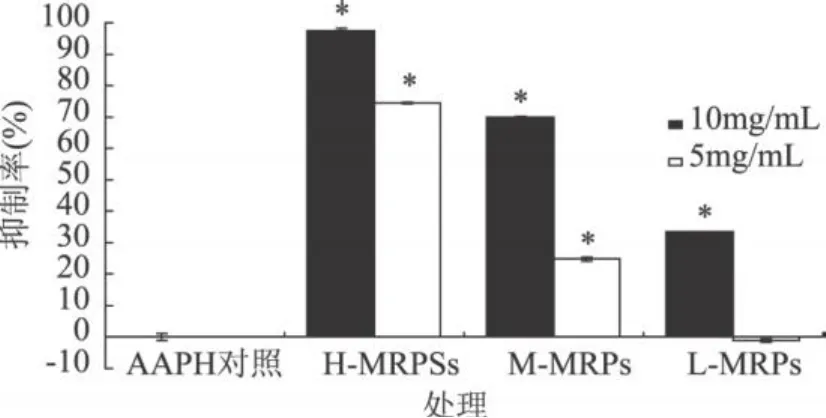
图5 不同分子量范围的MRPs对AAPH诱导的脂质体过氧化的抑制作用注:*与阴性对照相比较 P<0.05,图 6、图 7同。
2.3.2 MRPs对 Fe3+/VC诱导的卵磷脂脂质体氧化水平的影响 图 6描述了不同分子量范围的MRPs对Fe3+/VC诱导的卵磷脂脂质体氧化水平的影响。由图可见,样品浓度为 5mg/mL时,L-MRPs对脂质体氧化基本无影响,M-MRPs和H-MRPs的抗氧化抑制率分别为 46.02%和 75.68%;当浓度增至 10mg/mL后,各分离产物的抗氧化能力明显提高。综上可得,在 Fe3+/VC引发的卵磷脂脂质体氧化体系中,不同分子量MRPs产物的抗氧化活性大小为:H-MRPs>M-MRPs>L-MRPs,其中 L-MRPs在低浓度时对脂质体氧化无影响。

图 6 不同分子量范围MRPs对 Fe3+/VC诱导的脂质体过氧化的抑制作用
2.3.3 MRPs对卵磷脂脂质体自动氧化水平的影响 图7显示了不同分子量范围的MRPs对卵磷脂脂质体自动氧化的影响。由图 6可见,各MRPs对卵磷脂脂质体抗氧化效果与前两种诱导方式所得到的结果相似,不同分子量MRPs产物的抗氧化活性由大到小为:H-MRPs>M-MRPs>L-MRPs,其中L-MRPs在低浓度时对脂质体氧化无影响。

图7 不同分子量的MRPs对脂质体自动氧化的抑制作用
结合三种脂质体氧化体系,测定结果显示,不同分子量范围的MRPs产物对脂质体过氧化均能起到抑制效果,随着反应浓度的增加,其抗氧化能力增大。三种脂质体氧化体系中,不同分子量范围的MRPs抗氧化活性由大到小均为:H-MRPs>M-MRPs>L-MRPs。由此可见,美拉德反应产物的抗氧化作用主要来自于大分子量物质类黑精。Pellegrini等[10]测定可溶性类黑精的抗氧化能力时发现其具有很强的抗氧化性,大分子量的类黑精能够抑制还原型辅酶Ⅱ和谷胱甘肽-S-转移酶的活性。Castillo[11]等从面包中分离得到类黑精,相比较低分子量化合物,类黑精具有更强的清除过氧化自由基的能力。本实验中,虽然 L-MRPs的抗氧化能力最弱,但其在较高浓度下也表现出较好的抗氧化效果,这可能来源于原始反应物,如还原糖类和二羟基丙酮具有强的还原性,而组氨酸、赖氨酸和色氨酸也具有还原能力,同时低分子量的类黑精也具有较强的抗氧化能力[12]。类黑精的抗氧化机理主要表现为捕获亲电子基团、清除氧自由基和螯合金属离子的能力[13]。
2.4 MRPs抗氧化能力与褐色程度的关系
图 8描述了肉味香基及初步分离后的各MRPs产物的抗氧化能力与其褐色程度之间的关系。由图可见,相同浓度下,各MRPs的抗氧化能力与颜色有一定的正相关性,H-MRPs的吸光度最高,其抗氧化能力也最强。H-MRPs的高吸光度主要是褐色聚合体——类黑精的作用,它是一种以短肽和色素相结合的混合体。许多研究表明,美拉德反应物的抗氧化能力与其颜色存在一定的关系。Lingnert等人[14]指出,MRPs抗氧化性能与其颜色成正比。Yosh imura[15]等初步研究葡萄糖一甘氨酸的反应产物的抗氧化能力时发现,一部分类黑精抗氧化能力甚至超过BHA和没食子酸丙酯等,但是如果采用吸附树脂对其脱色处理,其抗氧化能力则大大下降。

图8 肉味香基及不同分子量MRPs的抗氧化能力与褐变程度的关系(反应物浓度为 1mg/mL)
3 结论
本研究结果显示,肉味香基对三种脂质体过氧化体系都表现出较强的抗氧化活性。通过透析与超滤相结合的方法,从肉味香基中初步分离得到三个不同分子量段的 MRPs(H-MRPs、M-MRPs和L-MRPs),三种MRPs均具有显著的抗氧化活性,其抗氧化活性从强到弱依次为:H-MRPs>M-MRPs>L-MRPs,并且MRPs的抗氧化能力与反应物浓度有较好的正相关性。通过研究不同分子量MRPs产物的褐色强度和抗氧化活性的关系,结果发现,MRPs抗氧化性能与其褐色强度成正比。
美拉德反应是一个复杂的反应体系,虽然本研究显示,肉味香基和三个不同分子量段的MRPs都具有显著的体外抗氧化作用,但是体外研究结果并不能完全代表它们的体内功效,对于体内抗氧化作用还需用细胞和动物实验加以验证。此外,MRPs产物非常复杂,对于其中是哪些物质或具有哪类分子结构的物质发挥抗氧化活性尚不清楚,有待进一步的分离纯化,探讨其结构特性与抗氧化活性之间的关系。
[1]LindenmeierM,FaistV,Hofmann T.Structural and functional characterization of pronyl-lysine,a novel protein modification in bread crust melanoidins showing in vitro antioxidative and phase I/II enzyme modulating activity[J].Agric Food Chem,2002,50 (24):6997-7006.
[2]Somoza V,Lindenmeier M,Wenzel E,et al.Activity-guided identification of a chemopreventive compound in coffee beverage using in vitro and in vivo techniques[J].Agric Food Chem,2003, 51(23):6861-6869.
[3]Somoza V,Wenzel E,Lindenmeier M,et al.Influence of feedingmalt,bread crust,and a pronylated protein on the activity of chemopreventive enzymes and antioxidative defense parameters in vivo[J].Agric Food Chem,2005,53(21):8176-8182.
[4]尤新 .氨基酸和糖类的美拉德反应——开发新型风味剂和食品抗氧化剂的新途径 [J].食品工业科技,2004,25 (7):139.
[5]Alejandra N C,Lidia L P,Graciela B,et al.Antioxidant effects ofwater-and lipid-soluble nitroxide radicals in liposomes[J]. Free RadicalBiology andMedicine,2004,37(12):2042-2051.
[6]Yilmaz Y,Toledo R.Antioxidant activity of water-soluble Mailllard reaction products[J].Food Chemistry,2005,93(2):273-278.
[7]项惠丹,许时婴,王璋 .蛋白质与还原糖美拉德反应产物的抗氧化活性[J].食品科学,2008,29(7):52-57.
[8]Yanagimoto K,Lee K G,OchiH,et al.Antioxidative activityof heterocyclic compounds formed inMaillard reaction products[J]. International Congress Series,2002,1245:335-340.
[9]王会,郭立,谢文磊 .抗氧化剂抗氧化活性的测定方法(一)[J].食品与发酵工业,2005,32(3):94.
[10]Pellegrini N,Re R,Yang M,et al.Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2,2’-azinobis(3-ethylenebenzothiazoline-6-sulfonic aid)radical cation decolirization assay[J].Methods Enzymol,1999,299:379-389.
[11]Castillo M,Ferrigno A,Acampa I,et al.In vitro release of angiotensin-converting enzyme inhibitors,peroxyl-radical scavengers and antibacterial compounds by enzymatic hydrolysis of glycated gluten[J].Journal of Ceramic Science,2007,45(3):327-334.
[12]Yamaguchi N,Koyama Y,Fujimaki M.Fractionation and antioxidativeactivity of browning reaction products between D-xylose and glycine[J].Prog Food Nutr Sci,1981,5:429-439.
[13]Delgado A C,Morales F J.Unraveling the contribution of melanoidins to the antioxidant activity of coffee brews[J].Journal ofAgriculture and Food Chemistry,2005,53(5):1403-1407.
[14]Lingnert H,Eriksson C E.Antioxidative Maillard reaction products.II.Products from sugars and peptides or protein hydrolysates[J].Journal of Food Processing and Preservation, 1980,4(3):173-181.
[15]Yoshimura Y,Iijima T,Watanable T,et al.Antioxdative effect ofMaillard reaction products using glucose-glycine model system[J].Food Reviews international,J Am Oil Chem,1997,45 (10):4106-4109.
Antioxidant activities ofMaillard reaction products in savory flavors
YU Xi-yang1,WANG He-ya1,*,QI AN He2,*
(1.Food College,Jiangnan University,Wuxi 214122,China; 2.State Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Three M a illa rd reac tion p roduc ts(MRPs)w ith d iffe rent m olecula r we ights we re p rep a red by m em b rane sep a ra tion from m ea t flavoring.The inhib ition ofm ea t flavoring and the three MRPs w ith d iffe rentm olecula rwe ights aga ins t oxida tion of lec ithin lip osom e sys tem we re inves tiga ted.The results ind ica ted tha t m ea t flavoring inhib ited oxida tion of lec ithin lip osom e sys tem,and its antioxidant cap ac ity inc reased w ith the inc rease of its concentra tion. MRPs w ith highes t m olecula r we ight showed the highes t antioxidant cap ac ity,then MRPs w ith m idd le m olecula r we ight and the lowes twas m olecula rwe ight.The antioxidant cap ac ity ofMRPs was dep endent of its colour index.
M a illa rd reac tion p roduc ts(MRPs);lip osom e(LPS);antioxidant;color
TS264.3
A
1002-0306(2010)03-0181-04
美拉德反应是在食品加工和储存过程中氨基酸或蛋白质和碳水化合物发生的一系列复杂反应,它是食品烹调和加工过程中产生食品风味和食品色泽的重要途径。在面包的烘烤、肉制品的煎炸、咖啡的烘焙等过程中,美拉德反应给食品带来香气,赋予了食品特殊的风味。许多研究表明,氨基酸-还原糖模拟体系的反应产物、面包皮/咖啡提取物或热处理的膳食中的美拉德反应产物 (Maillard reaction products, MRPs)具有抗氧化功能[1-3]。MRPs的抗氧化功能主要来源于有色物类黑精、还原酮及一系列含N、S的杂环化合物,其中的某些物质的抗氧化能力能达到常用抗氧化剂同样的水平,如在高脂类食品中加入MRPs产物能抑制其脂类氧化[4]。通过氨基酸或植物蛋白水解物与还原糖高温加热发生Maillard反应,制备得到的反应型肉味香基香味逼真,成本低廉,是开发咸味香精必不可少的配料,广泛应用于方便面、汤料、肉制品、膨化食品、饼干等加工食品中,以增加或赋予食品肉风味,满足人们对肉风味的需要。尽管人们针对氨基酸-还原糖模拟体系的反应产物、面包皮/咖啡提取物或热处理的膳食中的MRPs的抗氧化性展开了大量研究,但针对咸味香精中MRPs的抗氧化功能还未见报道。本研究以咸味香精调配前的肉味香基为对象,利用膜过滤手段从肉味香基中初步分离得到不同分子量范围的MRPs,考察分离前肉味香基以及分离后MRPs的体外抗氧化效果。同时,探讨了各MRPs的褐色程度与抗氧化效果之间的关系。
2009-06-12 *通讯联系人
于汐洋 (1985-),女,硕士,主要从事食品的功能和安全性研究。

