苦荞和甜荞二氢黄酮醇4-还原酶基因(dfr)的克隆及序列分析
祝 婷,李成磊,吴 琦﹡,蒙 华,陈 惠,邵继荣
(四川农业大学生命科学与理学院,四川 雅安 625014)
苦荞和甜荞二氢黄酮醇4-还原酶基因(dfr)的克隆及序列分析
祝 婷,李成磊,吴 琦﹡,蒙 华,陈 惠,邵继荣
(四川农业大学生命科学与理学院,四川 雅安 625014)
采用同源基因克隆的方法,以苦荞和甜荞叶片为材料,提取总RNA,经RT-PCR扩增获得其二氢黄酮醇4-还原酶基因(dfr)cDNA序列,并通过T载体克隆后测序。序列分析表明,获得了苦荞和甜荞dfr的全长cDNA编码序列,其1026bp的全长开放阅读框(ORF)均编码341个氨基酸,并具典型的dfr结构特征和功能模块。同源性分析显示,苦荞和甜荞与其他植物的dfr基因核苷酸相似性为71%~98%;根据氨基酸序列构建系统进化树表明,二者与豆科、桑科和蔷薇科聚为一类。
苦荞;甜荞;二氢黄酮醇4-还原酶基因;克隆;序列分析
荞麦是世界上一种重要的杂粮作物,它属于蓼科(Polygonaceae)、荞麦属(FagopyrumMill)双子叶禾谷类作物,主要栽培种有甜荞(F. esculentumMoench也称普通荞麦)和苦荞(F. tartaricum(L.) Gaertn又称鞑靼荞麦)[1]。荞麦的蛋白质含量很高,主要有谷蛋白、水溶性清蛋白和盐溶性球蛋白等,其质量均优于大米、小麦、高粱和玉米,尤其是在苦荞中,这3种蛋白占蛋白质总量的50%以上[2]。18种氨基酸中,荞麦不仅有人体必需的8种氨基酸,更有谷类作物最缺少的赖氨酸[3]。加上它们均含有丰富的微量元素、维生素、食物纤维和多种矿物质以及芦丁等生物类黄酮,可起到降低血液胆固醇、治疗高血压、控制糖尿病和微血管脆弱引起的出血病、防治便秘、延缓衰老等作用[4-5],被誉为新型的绿色保健食品。目前在开发利用方面已有生物类黄酮散、生物类黄酮软膏、生物类黄酮胶囊、生物类黄酮牙膏以及生物类黄酮口香糖等产品。随着人们膳食结构的不断改善,以荞麦特别是苦荞为原料的系列保健长寿食品将在人们生活中起到重要的作用。
二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)是花色素苷和原花色素生化合成途径中的关键酶。1985年,O’Reilly等[6]采用转座子标签法首次从玉米和金鱼草中分离了dfr基因。随后,Beld等[7]以金鱼草DFR基因为探针获得了矮牵牛dfr基因。至今人们从多种植物如拟南芥、西红柿、玫瑰、葡萄、水稻、百合等分离出了d fr基因。原花色素(o l i g o m e ri c proanthocyanidins,OPCs)为多羟基酚类化合物,衍生于黄烷类化合物,属生物类黄酮,具有独特的化学和药理活性。本研究以苦荞和甜荞为材料,采用RT-PCR技术克隆其dfr基因的cDNA序列,对了解荞麦花色素苷和原花色素生化合成途径及荞麦主要活性成分代谢的分子机制和在药用次生代谢产物代谢过程中的作用有重要的意义,以期为发展花色基因工程和开发新型药物提供参考。
1 材料与方法
1.1 材料与试剂
苦荞和甜荞种子购于四川阿坝农户,种植于四川农业大学生物系实验基地。经邵继荣教授鉴定,二者分别是圆粒苦荞和太平甜荞。
R N Aout试剂盒 天泽基因工程有限公司;RevertAidTMFirst Strand cDNA合成试剂盒 Fermentas公司;2×TaqPCR Master Mix 北京TIANGEN生物公司;无菌去离子水 实验室自制;Gel Extraction Kit Omega公司;pMD19-T simple Vector 宝生物工程(大连)有限公司。
1.2 仪器与设备
Thermo MicroLite RF 220/240高速冷冻离心机 美国热电公司;MyCyclerTMThermal Cycler PCR仪、S.N.76S凝胶成像系统 美国BIO-RAD公司;DYY-Ⅲ-68型稳压稳流电泳仪 北京市六一仪器厂;DNP-9272型电热恒温培养箱 上海精宏试验设备有限公司。
1.3 总RNA提取及dfr基因cDNA的克隆
采用植物RNAout试剂盒提取荞麦叶片的总RNA,电泳检测。采用RevertAidTMFirst Strand cDNA合成试剂盒进行RT-PCR合成cDNA,反转录反应体系总体积为20μL,含总RNA 4μL、Oligo-dTPrimer(0.5μg/μL) 1μL、DEPC H2O 7μL、5×reaction buffer 4μL、RiboLockTMRiobonuclease Inhibitor 1 μ L和10mmol/L dNTP mix 2μL,最后加入1μL Revert AidTM M-MuLV Reverse Transcriptase。反应条件:42℃ 60min将mRNA反转录为cDNA第一链,70℃ 10min热灭活反转录酶,将合成产物保存于-80℃冰箱备用。
以合成的cDNA为模板进行dfr基因cDNA全长克隆。参照NCBI登录的金荞麦(Fagopyrum cymosum)dfr基因(EF522145)全长的5'端和3'端UTR序列设计一对引物,上游引物5'-CTTTTCTCACCAAAACGACG-3',下游引物5'-TTCTCACAAAAGTAAAACTAATCAA-3', 由上海英骏生物公司合成。PCR反应体系总体积为25μL,含2×TaqPCR Master Mix 12.5μL,10mmol/L 引物各1μL,DNA模板1μL和无菌去离子水9.5μL。PCR反应条件:94℃预变性5min,94℃变性50s、55℃退火50s、72℃延伸90s、35个循环,72℃延伸10min。
PCR产物经1%琼脂糖凝胶电泳,采用Gel Extraction Kit回收后,与pMD19-T simple Vector连接,转化大肠杆菌,筛选阳性克隆,穿刺管培养后,送北京诺赛基因公司测序。
1.4dfr基因的序列分析
将测序结果拼接后,在GenBank进行生物信息学分析。应用DNAMAN软件对推导的氨基酸序列进行多序列比对,并构建系统进化树。
2 结果与分析
2.1 荞麦总RNA的提取
提取的总RNA的电泳检测结果见图1。图1中各泳道可清晰观察到28S RNA、18S RNA和mRNA 3条区带,且28S RNA和18S RNA两者比例符合2:1的特点,表明提取的RNA较为完整,质量较高,可用于RTPCR。

图1 荞麦总RNA的电泳检测Fig.1 Electrophoresis patterns of total RNA from tartary buckwheat and common buckwheat
2.2dfr基因的扩增及序列分析
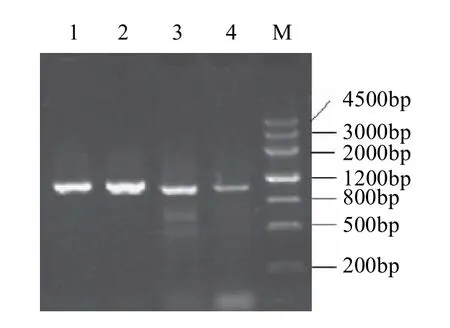
图2 dfr基因全长cDNA PCR扩增产物Fig.2 Full length PCR amplification products of dfr genes from tartary buckwheat and common buckwheat
将苦荞和甜荞的总RNA反转录成cDNA后,再经PCR扩增,均得到约1200bp的特异性条带,结果见图2。序列分析表明,苦荞d f r基因的c D N A长度为1185bp,包含1026bp的完整开放阅读框(ORF),在NCBI Genebank的登录号为GU169468, 将该序列命名为Ftdfr;甜荞dfr基因的cDNA长度为1192bp,包含1026bp的完整开放阅读框(ORF),在NCBI Genebank的登录号为GU169469,将该序列命名为Fedfr。Ftdfr和Fedfr均编码一个含341氨基酸残基的蛋白质(图3)。经在线蛋白质分析服务器(http://www.expasy.org/cgi-bin/protparam)分析表明,Ftdfr相对分子质量为38.53,推测的等电点(pI)为5.78;Fedfr相对分子质量为38.55,推测的等电点(pI)为5.60。此外,在Ftdfr和Fedfr起始密码子ATG附近存在CCATGG序列,与参与真核生物翻译起始的Kozak保守序列(A/GXXATGG)一致。


图3 Ftdfr与Fedfr的cDNA序列及推导的氨基酸序列比较Fig.3 Comparison of cDNA sequences and deduced amino acid sequences between dfr genes from tartary buckwheat and common buckwheat
2.3 植物dfr的序列比对与进化分析
在NCBI(http://www.ncbi.nlm.nih.gov/)网站对Ftdfr进行Blastn比对分析,结果表明该基因的核苷酸序列与其他植物的dfr基因的相似性较高,与金荞麦(Fagopyrum cymosum)、甜荞(Fagopyrum esculentum)、水蓼(Persicaria hydropiper)、单籽山楂(Crataegus monogyna)、苹果(Malus x domestica)、西洋梨(Pyrus communis)、美洲商路(Phytolacca americana)、瞿麦(Gypsophila elegans)、菠菜(Spinacia oleracea)和苜蓿(Medicago truncatula)等的dfr基因相似性均在71%~98%之间,其中与金荞麦相似性最高,为98%(表1)。

表1 Ftdfr与其他植物dfr基因的同源性比较Table 1 Homologous comparison of nucleotide sequences among dfr genes from tartary buckwheat and other plant species
以苦荞ORF序列推导的蛋白质序列进行BLASTp分析结果表明,苦荞dfr基因编码蛋白与其他植物的二氢黄酮醇4-还原酶(DFR)有高度同源性,其中与金荞麦dfr同源性最高为98%。利用DNAMAN软件将Ftdfr与Fedfr推导的氨基酸序列与同源蛋白进行多序列比对(图4),发现在DFR蛋白质序列中存在一个NADP(H)结合保守区域VTGASGFVGSWLVMRLLEHGY,还存在一个底物特异性结合保守区域TVNVEEKQKPVYDETCWSDV DFCRRV。比对结果表明二者与金荞麦、苹果、美洲商路、石竹、拟南芥等在DFR蛋白氨基酸序列系统进化上有高度保守性。

图4 FtDFR和FeDFR与其他植物DFR的氨基酸序列比对Fig.4 Amino acid sequence alignment among dfrgenes from tartary buckwheat and common buckwheat and other plant species
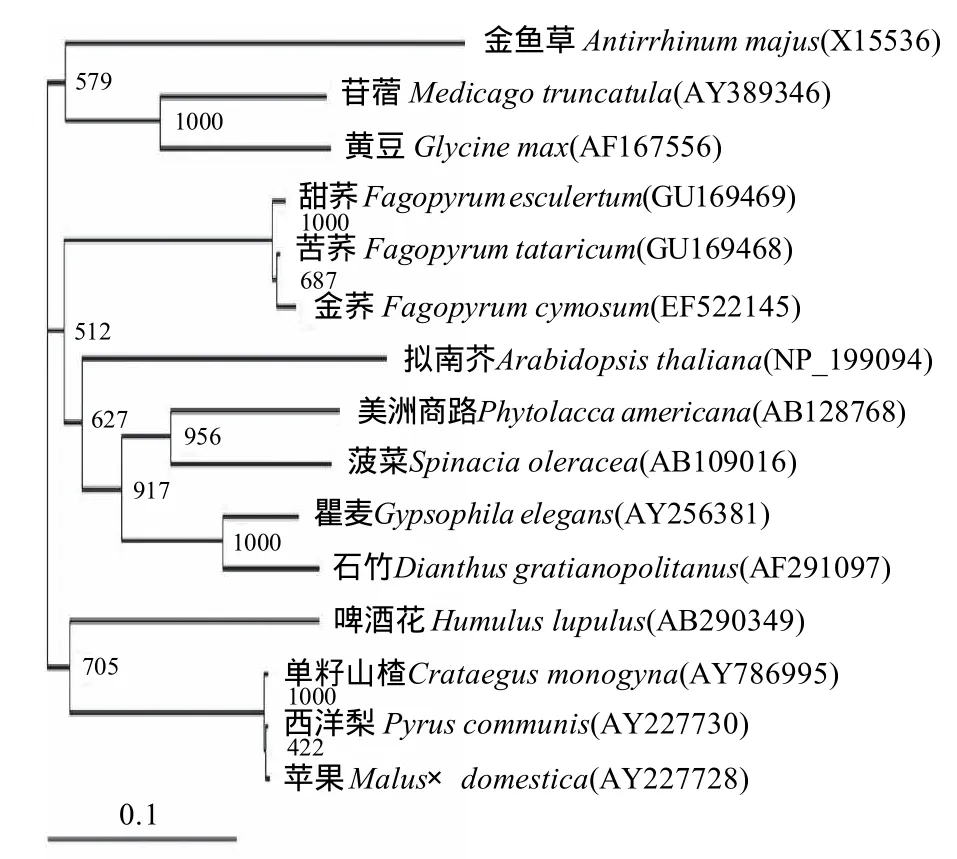
图5 不同植物DFR氨基酸序列的进化树Fig.5 Phylogenetic tree based on amino acid sequence encoded by dfr gene in different plant species
基于Ftdfr和Fedfr氨基酸序列构建系统进化树,结果见图5。结果表明这些植物共聚为3大类,蓼科的苦荞、甜荞和金荞,豆科的苜蓿和黄豆,桑科的啤酒花,蔷薇科的苹果、单籽山楂和西洋梨聚为一类,商路科的美洲商路,藜科的菠菜,石竹科的瞿麦和石竹聚为一类,十字花科的拟南芥和玄参科的金鱼草为另一类。其中,苦荞与金荞麦的同源关系最近,其次是甜荞。
3 讨 论
3.1 二氢黄酮醇4-还原酶(DFR)是花色素苷生化合成途径中的关键酶,是一个重要的调控点。它催化二氢黄酮醇在C4位发生立体特异的还原反应[8],继而在花色素苷合成酶(anthocyanin synthase,ANS)和类黄酮3-O-糖基转移酶(flavonoid 3-O-glucosyltransferase,3GT)的作用下合成各种花色素苷[9]。因此,DFR 是将二氢黄酮醇转变为花色素苷反应的第一个酶,这一反应需要NADP (H)。在不同的物种中,DFR与NADP(H)的结合区域“VTGAAGFIGSWLIMRLLERGY”是高度保守的[10]。不同物种的DFR对底物选择性和表达水平的不同促使不同花色素的合成。关于底物选择特异性的分子机制,早期的研究者提出了一个26个氨基酸的底物特异选择的结构域[7],DFR对不同底物的结合是由其分子中底物结合区的氨基酸序列所决定,这个序列在不同物种中也是高度保守的[11]。该结合区132 位与 141 位的氨基酸可直接影响酶的底物特异性,大多数物种在132 位含有D(天冬氨酸)或N(天冬酞胺),分别被称为Asp型DFR和Asn型DFR;还有一类DFR的第132位氨基酸残基既不是天冬氨酸也不是天冬酰胺,因此被称为非Asn/Asp型DFR[12]。在植物中Asn型DFR分布广泛,单子叶植物都是Asn型DFR,而Asp型DFR只分布在部分双子叶植物中。此外,只有少数植物含有非Asn/Asp型DFR[13],并且在进化上分布较远,由此推测Asp型和非Asn/Asp型DFR有可能是由Asn型DFR进化而来。本研究中苦荞和甜荞均属双子叶植物,而且DFR氨基酸序列的132位为N,则推测其为Asn型DFR,且具有底物选择特异性。
3.2 金荞与甜荞和苦荞之间的亲缘关系是荞麦属种间亲缘关系争论的焦点。Steward[14]、Suvorova等[15]和王莉花等[16]认为金荞与甜荞之间的亲缘关系比与苦荞的亲缘关系近。Kishima等[17]、Sharma等[18]和赵佐成等[19]认为金荞与苦荞的亲缘关系比与甜荞的亲缘关系近。这可能是由于各学者所采用的材料不同或者是野生种不同种群间遗传差异等造成。本研究通过比较不同植物DFR氨基酸序列构建的系统进化树表明金荞和苦荞的亲缘关系与金荞和甜荞的亲缘关系相比较更近。可见,分析同源蛋白的结构对研究种属和种间差异也具有重要意义。
3.3dfr基因已在多种植物中得到分离,其分子特征和调控机制也得到了深入研究,发现它通常是单基因和小基因家族[8]。已报道的dfr基因为单基因的植物有拟南芥[20]和金鱼草[21]等。植物基因启动子是重要的顺式作用元件,位于结构基因5′端上游,指导酶与模板的正确结合,活化RNA聚合酶,决定转录起始部位和转录效率,影响基因的表达。本研究在首次克隆苦荞和甜荞中dfr基因的全长cDNA编码序列的基础上,拟进一步对其启动子和基因表达调控等进行深入研究。
由于荞麦含有独特生物活性成分,具有较高的营养价值和药用价值,荞麦制品正日益受到人们的青睐[22]。我国荞麦资源丰富,利用生物技术扩展对dfr的研究对于黄酮代谢途径工程的研究和保健食品等的开发具有重要作用。
[1] 顾尧臣. 小宗粮食加工(四): 荞麦加工[J]. 粮食与饲料工业, 1999(7): 19-22; 26.
[2] 张宏志, 管正学. 荞麦资源在我国的开发利用[J]. 自然资源, 1996(4): 38-44.
[3] 罗中旺, 李凤英, 王桂珍. 中国苦荞生产开发现状及内蒙古自治区苦荞发展设想[J]. 内蒙古农业科技, 2005(6): 17-19.
[4] KAYASHITA J, SHIMAOKA I, NAKAJOH M, et al. Consumption of buckwheat protein lowers plasma cholesterol and raiscs fecal neut ral sterols in cholesterol-fed rats because of its low digestibility[J]. The Journal of Nutrition, 1997, 127(7): 1395-1400.
[5] KAYASHITA J, SHIMAOKA I. Consumption of a buckwheat protein extract relards 7,12-dimethylbenz [.alpha.] anthracene-induced mammary carcinogenesis in rats[J]. Biosci Bio Biochem, 1999, 63(10): 1837-1839.
[6] O’REILLY C, SHEPHERD N S, PEREIRA A, et al. Molecular cloning of the allocus inZea maysusing the transposable elements En and Mul[J]. EMBO Journal, 1985, 4(4): 877-882.
[7] BELD M, MARTIN C, HUITS H, et al. Flavonoid synthesis inPetunia hybrida: partial characterization of dihydroflavonol 4-reductase genes[J]. Plant Mol Biol, 1989, 13(5): 491-502.
[8] 刘光德, 雷兴华, 祝钦泷, 等. 金荞麦二氢黄酮4-还原酶基因(Fdfr1)的克隆及序列分析[J]. 中国农业科学, 2009, 42(1): 55-63.
[9] 刘娟, 冯群芳, 张杰. 二氢黄酮醇4-还原酶基因(dfr)与花色的修饰[J]. 植物生理学通讯, 2005, 41(6): 715-719.
[10] JOHNSON E T, YI H, SHIN B, et al. Cymbidium hybrida dihydroflavonol 4-reductase does not efficiently reduce dihydrokaempferol to produce pelargonidin-type anthocyanins[J]. Plant J, 1999, 19(1): 81-85.
[11] POLASHOCK J J, GRIESBACH R J, SULLIVAN R F, et al. Cloning of a cDNA encoding the cranberry dihydroflavonol 4-reductase(DFR) and expression in transgenic tobacco[J]. Plant Sci, 2002, 163(2): 241-251.
[12] JOHNSON E T, RYU S, YI H, et al. Alteration of a single amino acid changes the substrate of dihydroflavonol 4-reductase[J]. Plant J, 2001, 25(3): 325-333.
[13] 李春雷, 崔国新, 许志茹, 等. 植物二氢黄酮醇4-还原酶基因的研究进展[J]. 生物技术通讯, 2009, 20(3): 442-445.
[14] STEWARD A N. The Polygoneae of eastern Asia[J]. Contrib GrayHerb Harv Univ, 1930, 88: 117-129.
[15] SUVOROVA G N, FUNATSUKI H, TRAMI F. Phylogenetic relationships among cultivars, species and hybrids in the genusFagopyrumMill. assessed by RAPD analysis[J]. Russian Journal of Genetics, 1999, 35(12): 1428-1432.
[16] 王莉花, 殷富有, 刘继海, 等. 利用RAPD分析云南野生荞麦资源的多样性和亲缘关系[J]. 分子植物育种, 2004, 2(6): 807-815.
[17] KISHIMA Y, OGURA K, MIZUKAMI K, et al. Chloroplast DNA analysis in buckwheat species: Phylogenetic relationships, origin of the reproductive systems and extended inverted repeats[J]. Plant Sci, 1995, 108(2): 173-179.
[18] SHARMA R, JANA S. Species relationships inFagopyrumrevealed by PCR-based DNA fingerprinting[J]. Theor Appl Genet, 2002, 105(2/3): 306-312.
[19] 赵佐成, 周明德, 罗定泽, 等. 中国荞麦属果实形态特征[J]. 植物分类学报, 2000, 38(5): 486-489.
[20] SHIRLEY B W, HANLEY S, GOODMAN H M. Effects of ionizing radiation on a plant genome: analysis of twoArabidopsistransparent testa mutations[J]. Plant Cell, 1992, 4(3): 333-347.
[21] HOLTON T A, CORNISH E C. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7(7): 1071-1083.
[22] 赵小珍, 张政, 景巍, 等. 苦荞麦主要过敏蛋白N端基因片段的克隆及序列分析[J]. 食品科学, 2006, 27(10): 41-44.
Cloning and Sequence Analysis of Dihydroflavonol 4-Reductase Genes from Tartary Buckwheat and Common Buckwheat
ZHU Ting,LI Cheng-lei,WU Qi*,MENG Hua,CHEN Hui,SHAO Ji-rong
(College of Life Science, Sichuan Agricultural University, Ya’an 625014, China)
The cDNA sequence of dihydroflavonol 4-reductase (DFR) gene was amplified from total RNA from the leaves of tartary buckwheat (Fagopyrum tataricum) and common buckwheat (Fagopyrum esculentum) by RT-PCR using homology-based cloning strategy. The amplified fragments were then cloned into T-vector. Sequence analysis indicated that both cDNAs had open reading frames of 1026 bp in full length, which encoded a polypeptide composed of 341 amino acids with typical structure characteristics and functional module of DFR enzyme, respectively. The nucleotide similarity ofdfrgene amongFagopyrum tataricum,Fagopyrum esculentumand other plants ranged from 71% to 98%. In addition, the phylogenetic analysis based on amino acid sequence enconded bydfrgene indicated that both buckwheat varieties,Leguminosae,Moraceae andRosaceaewere classified into one class.
Fagopyrum tataricumGaertn;Fagopyrum esculentumMoench;dihydroflavonol 4-reductase (dfr) gene;cloning;sequence analysis
Q943.2
A
1002-6630(2010)13-0219-05
2009-12-29
四川省科技厅科技攻关项目(04NG001-015;2006Z08-012)
祝婷(1985—),女,硕士研究生,研究方向为基因工程。E-mail:wuyutingpeng@126.com
﹡通信作者:吴琦(1973—),男,副教授,博士,研究方向为酶工程。E-mail:wuqiwq@yahoo.cn

