气质联用法测定丁酸单甘酯
易路遥,郑为完*,廖和菁
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西省食品药品检验所,江西 南昌 330046)
气质联用法测定丁酸单甘酯
易路遥1,2,郑为完1,*,廖和菁1
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西省食品药品检验所,江西 南昌 330046)
建立GC-MS测定丁酸单甘酯含量的方法。采用DB-5MS(30m×0.25mm,0.25μm)毛细管柱,进样口温度280℃,色谱升温条件为起始100℃,以10℃/min升至150℃,再以30℃/min升至250℃,保持5min,氦气流量1.0mL/min,分流比10:1。结果表明:丁酸单甘酯质量浓度在0.5~10μg/mL范围内呈良好线性关系,线性方程Y=146961X-30250(r=0.9997),平均加标回收率为99.9%,重复性实验RSD为1.7%,最低检测限0.2ng。该方法简便、准确且重复性好,可用于丁酸甘油酯中丁酸单甘酯的含量测定。
丁酸单甘酯;气相色谱-质谱;测定
丁酸单甘酯是丁酸和甘油酯化后的产物,从其分子结构上看,其既能作W/O型乳化剂,又可以作O/W型乳化剂[1]。作为一种乳化剂添加到饲料中应用[2-3],在动物消化系统中被分解成丁酸和甘油,甘油能够作为一种能量物质被动物吸收利用,丁酸作为一种生物调节剂对维护动物胃肠道内有益微生物菌丛,增强动物的健康水平起到一定作用[4-10],被认为是抗生素的潜在替代物[11-15],由于合成的丁酸单甘酯多为混合物,可能含有丁酸单甘油酯、双甘油酯或者三甘油酯,主要成分为丁酸单甘酯。目前,气-质联用技术(GC-MS)日益成熟,功能日趋完善,兼有色谱分离效率高、定量准确、选择性高、提供丰富的结构信息、便于定性等特点,对于复杂混合物进行分离、定性、定量分析是一种完美的现代分析方法[16]。本实验对合成的丁酸单甘酯进行GC-MS分析,建立测定丁酸单甘酯含量的气质联用方法,分析方法简便、快速、准确、且能定性确证,获得理想的效果。
1 材料与方法
1.1 试剂
甲醇、乙酸乙酯均为色谱纯;丁酸单甘酯 自制;丁酸单甘酯标准品 美国Chem service公司;丁酸、甘油、四氯化碳、磷酸(均为分析纯)。
1.2 仪器与设备
QP2010气质联用仪 日本岛津公司;ZBHW电热套;三颈瓶;回流装置;蒸馏装置;分液漏斗。
1.3 方法
1.3.1 丁酸甘油酯的制备[17]
将一定量的甘油、丁酸、四氯化碳(带水剂)、磷酸(催化剂),加入到带有温度计、分水器及回流冷凝管的三口烧瓶中,开启磁力搅拌,加热升温回流,带水剂从反应体系中带出生成的水,至分水器中水量基本不变时,停止反应。降温后,减压蒸馏出带水剂四氯化碳,制得粗产物。再用pH10的饱和食盐水多次水洗粗产物,去除未反应的反应物和催化剂,直至水层为碱性,将酯层从分液漏斗上端倒出,置于60℃恒温干燥箱中干燥2~3h。冷却后用底部塞有脱脂棉的漏斗过滤后,滤液为制得的较纯的丁酸甘油酯。
1.3.2 色谱条件
色谱柱:DB-5MS(30m×0.25mm,0.25μm);升温程序:初始温度100℃,以10℃/min升至150℃,再以30℃/min升至250℃,保持5min;载气(He)流速1.0mL/min,进样量1.0μL;分流比10:1;进样口温度280℃。
1.3.3 质谱条件
电子轰击(EI)离子源;电子能量70eV;传输线温度280℃;离子源温度200℃;溶剂切除时间3.2min;SCAN模式:30~350m/z;SIM模式:71、131、145m/z;定量离子71m/z。
1.3.4 样品的配制
分别精确称取合成样品约25mg,置于25mL容量瓶中,先加入5mL甲醇溶解,再用乙酸乙酯定容至刻度,使丁酸单甘酯的质量浓度在1mg/mL,再用乙酸乙酯稀释至约5μg/mL,待GC-MS分析。
阿囡笑道:“七爷写得好,我正是要这样说。就是起头那几个字不好,你把它改了罢。”燕西道:“这是外国人写信的规矩,无论写信给谁,前面都得加上一个亲爱的。”阿囡道:“我又不是外国人,他也不是外国人,我学外国人作什么?”燕西笑道:“我就是这样写,你不合意,就请别人写罢。”阿囡道:“就请你念完了再说罢。”燕西于是又笑着念道:因为这个缘故,我久在北京是很不放心的,我打算今年九、十月里,一定到上海来。
1.3.5 标品标准曲线的配制
精确称取标品25mg,置于25mL量瓶中,先加入5mL甲醇预溶解,再用乙酸乙酯定容至刻度,配制成质量浓度1mg/mL的溶液,再从中精密吸取1mL置于100mL容量瓶中,用乙酸乙酯定容至刻度,配成质量浓度为10μg/mL的溶液。精密吸取上述标准溶液0.5、1、2、5、6mL,分别置于10mL量瓶中,用乙酸乙酯定容至刻度,待GC-MS分析。
2 结果与分析
2.1 丁酸单甘酯的确认
分别取配制的质量浓度为1mg/mL的丁酸单甘酯标准品和实验室自制的样品,进行SCAN模式扫描,比较两者的总离子流色谱图,均在7min出现色谱峰,将两者相同保留时间色谱峰的质谱图进行比较,结果见图1、2,与NIST谱库中丁酸单甘酯质谱图如图3所示,做相似度检索,相似度达94%。
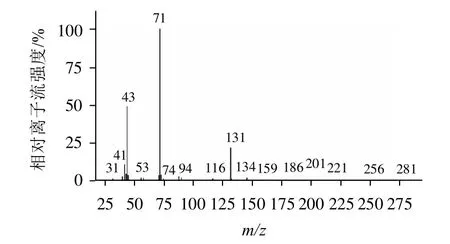
图1 丁酸单甘酯质谱图Fig.1 Mass spectrum of monobutyrin
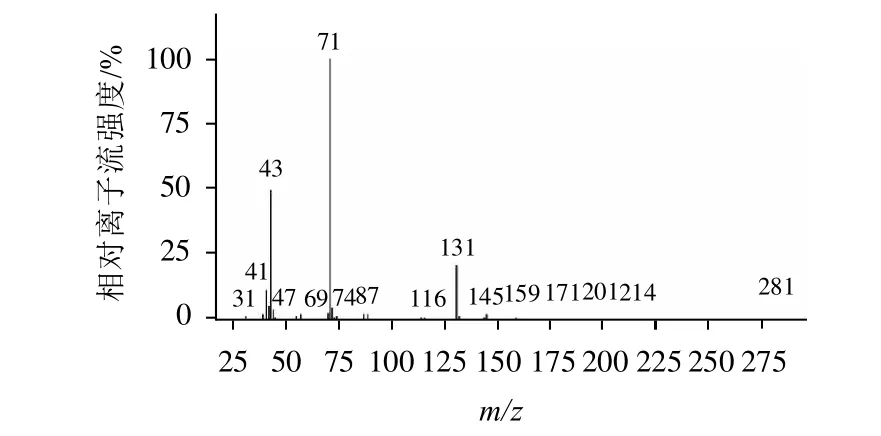
图2 实验室自制样品质谱图Fig.2 Mass spectrum of the home-made samples
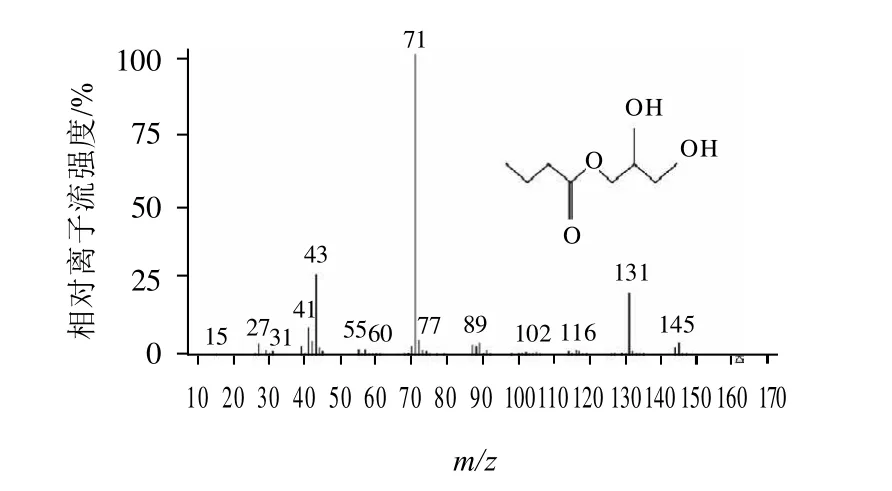
图3 NIST谱库中的丁酸单甘酯质谱图Fig.3 Mass spectrum of monobutyrin in NIST
2.2 线性范围和检测限的测定
分别取上述标准系列溶液1μL进行GC-MS分析,SIM模式扫描,以丁酸单甘油酯的系列质量浓度(0.5、1、2、5、6、10μg/mL)为纵坐标,不同峰面积为横坐标作图(图4),以最小二乘法进行线性回归,回归方程Y=146961X-30250,相关系数r=0.9997,线性范围在0.5~10μg/mL之间,最低检测限0.2ng,结果表明,线性相关性好、线形范围宽、检测限低。
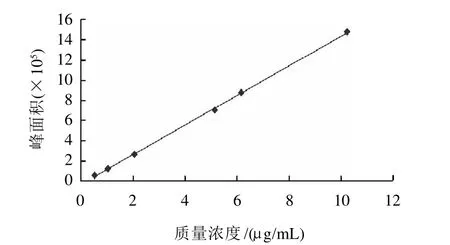
图4 丁酸单甘油酯标准曲线Fig.4 Standard curve of monobutyrin
2.3 样品单甘酯含量测定结果

表1 样品单甘酯含量测定Table 1 The content of monobutyrin
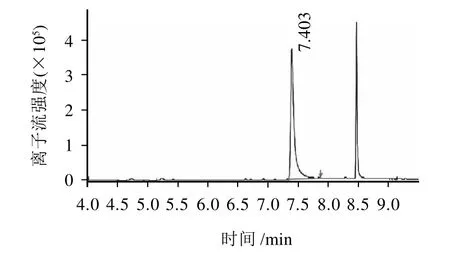
图5 丁酸单甘酯离子流色谱图Fig.5 Ion chromatogram of monobutyrin
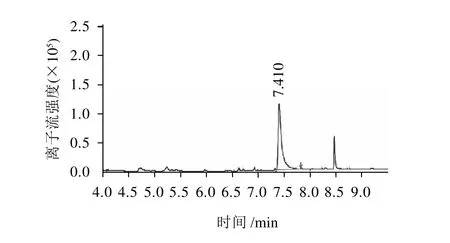
图6 实验室自制样品的离子流色谱图Fig.6 Ion chromatogram of the home-made samples
从表1可以看出,所合成丁酸甘油脂中单甘酯含量高;从图5、6可以看出合成工艺、分离纯化方法可行。色谱图中的第二峰tR=8.5min,经NTST谱库检索是丁酸三甘酯。标样和合成样品中丁酸二甘酯未检出。
2.4 样品加标回收率测定
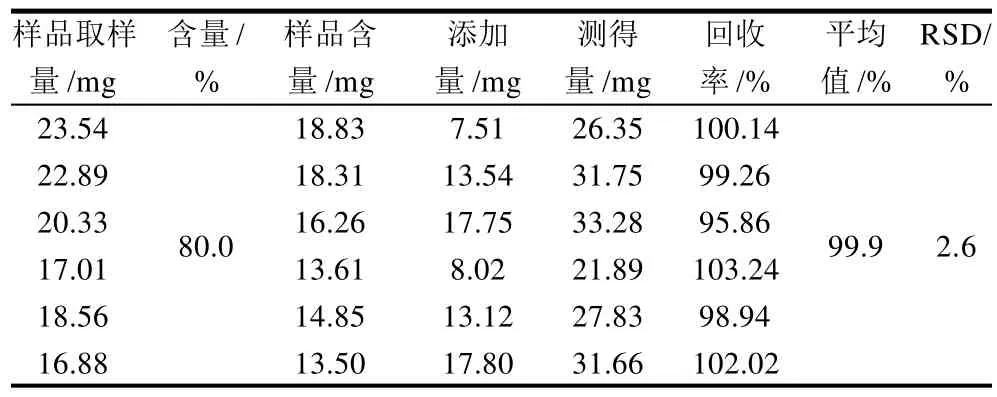
表2 丁酸单甘酯回收率测定Table 2 Recovery rate of monobutyrin
取样品约12.5~25mg共6份,置于25mL量瓶中,分别加入丁酸单甘酯适量,同样品配制,待GC-MS分析,得到测得量。计算回收率,测定结果见表2。
回收率/%=[(测定量-样品含量)/添加量]×100
从表2可以看出:所建立的测定方法加标回收率为103.24%~95.86%,平均回收率达99.9%,测定方法回收率好,无系统误差。
2.5 重复性实验
对合成样品平行测定6次,重复性实验结果见表3。
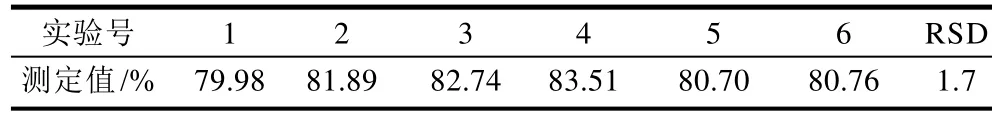
表3 重复性实验Table 3 Results of reproducibility experiments
从表3可以看出,6次平行实验的RSD为1.7%,说明测定结果重现性好,测定方法精密度高。2.6 稳定性实验
取同一份样品溶液,分别于0、2、4、8、12、24h进行测定,色谱峰面积RSD值为1.2%,结果表明丁酸单甘酯溶液在24h内稳定。
3 结 论
3.1 定性分析时,SCAN模式扫描得到完整的质谱图,根据谱库中收载的丁酸单甘酯质谱图以及美国Chem service公司标准品的质谱图,选择出特征离子(m/z71、131、145),比值为100:21:4,以m/z71为定量离子。
3.2 样品处理时,由于一般合成的丁酸单甘酯多为混合物,所以先用5mL甲醇进行预溶解,以防止溶质析出。又考虑到进行气谱分析,选择醇类做溶剂极性偏大。选用乙酸乙酯做溶解溶剂,经实验表明可行。
3.3 本实验建立的气质条件经过方法学验证,测定丁酸单甘酯取得令人满意的结果,丁酸单甘酯质量浓度在0.5~10μg/mL呈良好线性关系,线性方程Y=146961X-30250(r=0.9997),平均加标回收率为99.9%,RSD为1.7%,最低检测限0.2ng。测定方法重现性好,精密度高。由色谱图可以看到,在丁酸单甘酯的后面有一个峰,经过NIST谱库检索是丁酸三甘酯,两者分离效果好,不影响丁酸单甘酯的含量测定。同时表明,未检出丁酸双甘油酯,合成工艺、分离纯化方法可行。
[1] 倪永全, 杜志云, 黄旭东, 等. 不饱和酸单甘酯的研制[J]. 无锡轻工大学学报, 1995, 14(2): 143-148.
[2] 李玉峰. 饲用乳化剂在畜禽饲料中的使用[J]. 饲草饲料, 2009(4): 45-46.
[3] 张华伟, 赵舰. 饲用乳化剂在畜禽饲料中的使用[J]. 饲料工业, 2007,28(7): 69-70.
[4] 台卫平, 罗和生. 丁酸钠对结肠上皮细胞凋亡的影响[J]. 世界华人消化杂志, 2002, 10(7): 830-831.
[5] SCHEPPACH W. Effects of short chain fatty acids on gutmorphology and function[J]. Gut, 1994, 35(Suppl 1): 35-38.
[6] BUTZNER J D, PARMAR R, BELL C J, et al. Butyrate enemtherapy stimulatesmucosal repair in experimental colitis inthe rat[J]. Gut, 1996,38(4): 568-573.
[7] COOK S I, SELLIN J H. Short chain fatty acids in healthand disease[J].Aliment Pharmacol Ther, 1998, 12(6): 499-507.
[8] KORUDAM J, ROLANDELLI R H, BLISS D Z, et al. Parenteral nutrition supplemented with short-chain fatty acids:effecton the smallbowelmucosa in normal rats[J]. Am J Clin Nutr, 1990, 51(4): 685-689.
[9] 马吉锋, 马玉龙. 有机酸在动物生产中的应用研究[J]. 饲料工业,2005, 26(10): 17-22.
[10] ANNISON E F, ARMSTRONG D G. Volatile fatty acid metabolism and en-ergy supply[J]. Physiology of Digestion and Metabolism in the Ruminant, 1970(5): 422-437.
[11] DIERICK N A, DECUYPERE J A, MOLLY K, et al. The combined use of triacylglycerols containing medium chain fatty acids and exogenous lipolytic enzymes as an alternative for nutritional antibiotics in piglet nutrition[J]. Livest Prod Sci, 2002, 75: 129-142.
[12] KWAN Y M, RICKE S C. Induction of acid resistance of salmonellaty phimurium by exposure to short chain fatty acids[J]. Appl Environ Microbiol, 1998, 64(3): 458-463.
[13] KRUH J. Effects of sodium butyrate, a new pharmacological agent, on cells in culture[J]. Mol Cell Biochem, 1982, 42: 65-82.
[14] MILLER S J, HOGGATT A M, FANLK W P. Induction of endothelial intercellular adhesion molecule-1 expression by butyrate[J]. FASEBJ,1998, 12: 84.
[15] POUILLART P, CERUTTI I, RONCO G. Protective activity of monoacetone glucoses-butyrate, prodrug ofn-butyric acid, against the fatal effect of on cephalomy ocarditis vivis in mice[J]. C R Acacl Sci Ⅲ, 1992,314: 49-54.
[16] 刘艳霞, 骆传环. 色谱-质谱联用法在新药研究中的应用[J]. 生命科学仪器, 2004, 2(5): 6-8.
[17] 廖和菁, 郑为完, 易路遥, 等. 丁酸甘油酯的合成及其在油脂微囊化中的应用[J]. 食品科学, 2009, 30(16): 203-205.
Determination of Monobutyrin by GC-MS
YI Lu-yao1,2,ZHENG Wei-wan1,*,LIAO He-jing1
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Jiangxi Provicial Institute for Drug and Food Control, Nanchang 330046, China)
A GC-MS method for quantitative analysis of monobutyrin was established. The determination parameters were the capillary column DB-5MS (30 × 0.25 mmm, 0.25μm), injection temperature of 280 ℃ programmed temperature increase from 100 to 150 ℃ with an increase rate of 10 ℃/min, then programmed temperature increase from 150 ℃ to final temperature of 250 ℃ at an increase rate of 30 ℃/min, helium flow rate of 1.0 mL/min and split ratio of 10:1, respectively. Results indicated that a good linear relationship between integral value (Y) of peak area and the content of monobutyrin (X) in the range of 0.5-10μg/mL was observed and the linear equation wasY=146961X-30250 (r=0.9997). Recovery rate of monobutyrin were 99.9% with the RSD of 1.7%. The limit of determination was 0.2 ng. This method is simple, accurate and reproducible so that it can be used for the determination of monobutyrin.
GC-MS;monobutyrin;determination
TS207.3
A
1002-6630(2010)20-0402-04
2010-05-25
易路遥(1983—),女,药师,硕士研究生,主要从事食品、药品检验研究。E-mail:yao-161@163.com
*通信作者:郑为完(1946—),男,教授,硕士,主要从事食品新资源开发研究。E-mail:zheng3008@126.com

